Альдостерон у человека является основным представителем минералокортикоидных гормонов, производных холестерола.
Синтез
Осуществляется в клубочковой зоне коры надпочечников. Образованный из холестерола прогестерон на пути к альдостерону подвергается последовательному окислению 21-гидроксилазой, 11-гидроксилазой и 18-гидроксилазой . В конечном итоге образуется альдостерон.

Схема синтеза стероидных гормонов (полная схема)
Регуляция синтеза и секреции
Активируют :
- ангиотензин II , выделяемый при активации ренин-ангиотензиновой системы,
- повышение концентрации ионов калия в крови (связано с деполяризацией мембран, открытием кальциевых каналов и активацией аденилатциклазы).
Активация ренин-ангиотензиновой системы
- Для активации этой системы существует два пусковых момента:
- снижение давления в приносящих артериолах почек, которое определяется барорецепторами клеток юкстагломерулярного аппарата. Причиной этого может быть любое нарушение почечного кровотока – атеросклероз почечных артерий, повышенная вязкость крови, обезвоживание, кровопотери и т.п.
- снижение концентрации ионов Na + в первичной моче в дистальных канальцах почек, которое определяется осморецепторами клеток юкстагломерулярного аппарата. Возникает в результате бессолевой диеты, при длительном использовании диуретиков.
Постоянная и независимая от почечного кровотока секреция ренина (базовая) поддерживается симпатической нервной системой.
- При выполнении одного или обоих пунктов клетки юкстагломерулярного аппарата активируются и из них в плазму крови секретируется фермент ренин .
- Для ренина в плазме имеется субстрат – белок α2-глобулиновой фракции ангиотензиноген . В результате протеолиза от белка отщепляется декапептид под названием ангиотензин I . Далее ангиотензин I при участии ангиотензин-превращающего фермента (АПФ) превращается в ангиотензин II .
- Главными мишенями ангиотензина II служат гладкие миоциты кровеносных сосудов и клубочковая зона коры надпочечников:
- стимуляция кровеносных сосудов вызывает их спазм и восстановление артериального давления .
- из надпочечников после стимуляции секретируется альдостерон , действующий на дистальные канальцы почек.
При воздействии альдостерона на канальцы почек увеличивается реабсорбция ионов Na + , вслед за натрием движется вода . В результате давление в кровеносной системе восстанавливается и концентрация ионов натрия увеличивается в плазме крови и, значит, в первичной моче, что снижает активность РААС.

Активация ренин-ангиотензин-альдостероновой системы
Механизм действия
Цитозольный.
Мишени и эффекты
Воздействует на слюнные железы, на дистальные канальцы и собирательные трубочки почек. В почках усиливает реабсорбцию ионов натрия и потерю ионов калия посредством следующих эффектов:
- увеличивает количество Na + ,K + -АТФазы на базальной мембране эпителиальных клеток,
- стимулирует синтез митохондриальных белков и увеличение количества нарабатываемой в клетке энергии для работы Na + ,K + -АТФазы,
- стимулирует образование Na-каналов на апикальной мембране клеток почечного эпителия.
Патология
Гиперфункция
Синдром Конна (первичный альдостеронизм) – возникает при аденомах клубочковой зоны. Характеризуется триадой признаков: гипертензия, гипернатриемия, алкалоз.
Вторичный гиперальдостеронизм – гиперплазия и гиперфункция юкстагломерулярных клеток и избыточная секреция ренина и ангиотензина II. Отмечается повышение артериального давления и появление отеков.
Ренин-ангиотензин-альдостероновая система является комплексом ферментов и гормонов, которые поддерживают гомеостаз. Регулирует равновесие соли и воды в организме и уровень артериального давления.
Механизм работы
Физиология ренин-ангиотензин-альдостероновой системы берет начало на границе коркового и где имеются юкстагломерулярные клетки, вырабатывающие пептидазу (фермент) - ренин.
Ренин является гормоном и начальным звеном РААС.
Ситуации, при которых ренин выделяется в кровь
Существует несколько состояний, при которых идет попадание гормона в кровеносное русло:
- Уменьшение кровотока в ткани почек - при воспалительных процессах (гломерулонефрит др.), при диабетической нефропатии, опухолях почек.
- Снижение (при кровотечении, многократной рвоте, поносах, ожогах).
- Падение уровня артериального давления. В артериях почек имеются барорецепторы, которые реагируют на изменение системного давления.
- Изменение концентрации ионов натрия. В организме человека имеются скопления клеток, которые отвечают на изменение ионного состава крови стимуляцией выработки ренина. Соль теряется при обильном потоотделении, а также при рвоте.
- Стрессы, психоэмоциональные нагрузки. почки иннервируется симпатическими нервами, которые активируются при негативных психологических влияниях.
В крови ренин встречается с белком - ангиотензиногеном, который вырабатывается клетками печени и забирает у него фрагмент. Образуется ангиотензин I, который является источником воздействия для ангиотензинпревращающего фермента (АПФ). В итоге получается ангиотензин II, который служит вторым звеном и является мощным вазоконстриктором артериальной системы (суживает сосуды).
Эффекты ангиотензина II
Цель: повысить артериальное давление.
- Способствует синтезу альдостерона в клубочковой зоне коры надпочечников.
- Воздействует на центр голода и жажды в головном мозге, вызывая "солевой" аппетит. Поведение человека становится мотивированным на поиск воды и соленой пищи.
- Влияет на симпатические нервы, способствуя высвобождению норадреналина, который тоже является вазоконстриктором, но менее слабым по действию.
- Воздействует на сосуды, вызывая их спазм.
- Участвует в развитии хронической сердечной недостаточности: способствует пролиферации, фиброзу сосудов и миокарда.
- Снижает
- Тормозит выработку брадикинина.

Альдостерон - третий компонент, который действует на конечные канальцы почек и способствует выделению из организма ионов калия, магния и обратному всасыванию (реабсорбции) натрия, хлора, воды. Благодаря этому возрастает объем циркулирующей жидкости, поднимаются цифры артериального давления, и усиливается почечный кровоток. Рецепторы к альдостерону имеются не только в почках, но и в сердце, сосудах.
Когда организм достигает гомеостаза, начинают вырабатываться вазодилататоры (вещества, расширяющие сосуды) - брадикинин и каллидин. А компоненты РААС разрушаются в печени.
Схема ренин-ангиотензин-альдостероновой системы

Как любая система, РААС может давать сбой. Патофизиология ренин-ангиотензин-альдостероновой системы проявляет при следующих состояниях:
- Поражение коры надпочечников (инфекция, кровоизлияние и травма). Развивается состояние нехватки альдостерона, и организм начинает терять натрий, хлор и воду, что приводит к уменьшению объема циркулирующей жидкости и снижению артериального давления. Состояние компенсируют введением солевых растворов и стимуляторов рецепторов к альдостерону.
- Опухоль коры надпочечников приводит к избытку альдостерона, который реализует свои эффекты и повышает давление. Также активизируются процессы деления клеток, возникает гипертрофия и фиброз миокарда, и развивается сердечная недостаточность.
- Патология печени, когда нарушается разрушение альдостерона и происходит его накопление. Патология лечится блокаторами рецепторов к альдостерону.
- Воспалительные заболевания почек.

Значение РААС для жизни и медицины
Ренин-ангиотензин-альдостероновая система и ее роль в организме:
- принимает активное участие в поддержании нормального показателя артериального давления;
- обеспечивает равновесие воды и солей в организме;
- поддерживает кислотно-основной баланс крови.
Система может давать сбой. Воздействуя на ее компоненты, можно бороться с гипертонической болезнью. Механизм возникновения почечной гипертензии также тесно связан с РААС.
Высокоэффективные группы препаратов, которые синтезированы благодаря изучению РААС
- "Прилы". АПФ. Ангиотензин I не переходит в ангиотензин II. Нет вазоконстрикции - нет повышения артериального давления. Препараты: Амприлан, Эналаприл, Каптоприл и др. Ингибиторы АПФ значительно улучшают качество жизни больных сахарным диабетом, обеспечивая профилактику почечной недостаточности. Препараты принимают в минимальной дозировке, которая не вызывает снижения давления, а лишь улучшает местный кровоток и клубочковую фильтрацию. Медикаменты незаменимы при почечной недостаточности, хронической болезни сердца и служат одним из средств лечения гипертонической болезни (если нет противопоказаний).
- "Сартаны". Блокаторы рецепторов к ангиотензину II. Сосуды не реагируют на него и не сокращаются. Препараты: Лозартан, Эпросартан и др.

Противоположной ренин-ангиотензин-альдостероновой системе является кининовая. Поэтому блокирование РААС приводит к повышению в крови компонентов кининовой системы (брадикинин и др.), что благоприятно влияет на ткани сердца и стенки сосудов. Миокард не испытывает голодания, потому как брадикинин усиливает местный кровоток, стимулирует выработку естественных вазодилататоров в клетках мозгового вещества почек и микроцитах собирательных трубочек - простагландинов Е и И2. Они нейтрализуют прессорное действие ангиотензина II. Сосуды не спазмированы, что обеспечивает адекватное кровоснабжение органов и тканей организма, кровь не задерживается и снижается формирование атеросклеротических бляшек и тромбов. Кинины благоприятно воздействуют на почки, увеличивают диурез (суточное выделение мочи).
Ренин
– фермент, синтезируемый юкстагломерулярными клетками почечных афферентных артериол, имеющий ММ около 40 кДа. Особенно интенсивно образование ренина происходит при ишемии почек. Локализация юкстагломерулярных клеток делает их особенно чувствительными к изменениям кровяного давления, а также концентрации ионов Na + и К + в жидкости, протекающей через почечные канальцы. Благодаря указанным свойствам любая комбинация факторов, вызывающая снижение объема жидкости (обезвоживание, падение кровяного давления, кровопотеря и др.) или снижение концентрации NaCl, стимулирует высвобождение ренина.
В то же время большинство регуляторов синтеза ренина действуют через почечные барорецепторы. На освобождение ренина оказывает влияние состояние ЦНС, а также изменение положения тела в пространстве. В частности, при переходе из положения лёжа в положение сидя или стоя (клиностатическая проба) секреция ренина увеличивается. Эта рефлекторная реакция обусловлена повышением тонуса симпатической части автономной нервной системы, передающей импульсы к b-адренорецепторам юкстагломерулярных клеток.
Основным субстратом, на который воздействует ренин, является ангиотензиноген – белок, входящий во фракцию a 2 -глобулинов и образуемый печенью. Под воздействием глюкокортикоидов и эстрогенов синтез ангиотензиногена значительно возрастает. В результете действия ренина ангиотензиноген превращается в декапептид ангиотензин I. Это соединение обладает чрезвычайно слабым действием и существенного влияния на уровень кровяного давления не оказывает.
Между тем ангиотензин I под воздействием так называемого ангиотензинпревращающего фермента (АПФ) переходит в мощный сосудосуживающий фактор – ангиотензин II. АПФ (дипептидкарбооксипептидаза) является интегральным белком, расположенным преимущественно на мембране эндотелиальных клеток, эпителии, мононуклеарах, нервных окончаниях, клетках репродуктивных органов и др. Растворимая форма АПФ присутствует практически во всех жидкостях организма.
Принято выделять две изоформы АПФ. Первая из них получила условное наименование «соматической». Эта изоформа имеет ММ 170 кДа и включает гомологичные С- и N-домены. Вторая форма АПФ («репродуктивная») найдена в семенной жидкости, имеет ММ около 100 кДа и соответствует С-домену первой изоформы АПФ. Каждый из 2 указанных доменов содержит аминокислотные остатки, которые могут принимать участие в образовании связи с атомом цинка. Такие Zn 2+ -структуры являются типичными для многих металлопротеиназ и оказываются основными участками взаимодействия фермента как с субстратом, так и с ингибиторами АПФ.
Следует заметить, что АПФ не только приводит к образованию ангиотензина II, но и разрушает брадикинин – соединение, расширяющее кровеносные сосуды. Следовательно, увеличение кровяного давления при воздействии АПФ связано как с образованием ангиотензина II, так и с распадом брадикинина (рис. 32).
Важную роль для действия АПФ играет ионный состав и, в частности, содержание ионов хлора. Так, при высокой концентрации Cl – С-домен АПФ гидролизует и брадикинин, и ангиотензин-I быстрее, чем N-домен. Во внеклеточных регионах, где концентрация анионов хлора высока, за превращение ангиотензина-I отвечает преимущественно N-домен. Однако внутриклеточно, где концентрация Cl – низкая, N-домен может участвовать в гидролизе других пептидных субстанций.
За последние годы установлено, что АПФ играет важную роль в гемопоэзе, ибо под его воздействием ингибируется образование гематопоэтического пептида , тормозящего образование гематопоэтических клеток костного мозга.
Роль АПФ в организме была выявлена на мышах, лишенных гена АПФ. У таких животных отмечалось низкое кровяное давление, различные сосудистые дисфункции, нарушение структуры и функции почек и бесплодие у самцов.
Ангиотензин II
увеличивает кровяное давление, вызывая сужение артериол, и является самым сильнодействующим из известных вазоактивных агентов. Кроме того, он по механизму обратной связи тормозит образование и высвобождение ренина юкстагломерулярными клетками почки, что в конечном итоге должно восстанавливать нормальный уровень кровяного давления. Под воздействием ангиотензина II резко возрастает продукция основного минералокортикоида – альдостерона. Несмотря на то, что это действие является прямым, ангиотензин II не влияет на продукцию кортизола. Основное назначение альдостерона сводится к задержке Na + (за счет усиления его реабсорбции в почечных канальцах) и выделению К + и Н + (главным образом через почки). Эти реакции осуществляются следующим образом.
Альдостерон
проникает из внеклеточной жидкости в цитоплазму клетки и там соединяется со специфическим рецептором, после чего образовавшийся комплекс (альдостерон+рецептор) проникает в ядро. Альдостерон также стимулирует открытие Na + каналов, благодаря чему ионы Na + входят в клетку через апикальную мембрану из просвета канальца.
Увеличение секреции К + под воздействием альдостерона обусловлено возрастанием проницаемости апикальной мембраны по отношению к этим ионам, благодаря чему К + поступает из клетки в просвет канальца.
Задержка Na + в организме, как и ангиотензин II, способствует повышению кровяного давления.
Ангиотензин II способен связываться со специфическими рецепторами клубочковых клеток надпочечника. Содержание этих рецепторов во многом зависит от концентрации ионов К + . Так, если уровень К + повышается, то возрастает число рецепторов к ангиотензину II в клубочковых клетках. При уменьшении концентрации ионов К + отмечается прямо противоположный эффект. Следовательно, ионы К + играют основную роль в действии ангиотензина II на надпочечники.
За последнее время установлено, что ангиотензин II способен активировать макрофаги, благодаря чему усиливается агрегация тромбоцитов и ускоряется свёртывание крови. Одновременно при этом высвобождается ингибитор активатора плазминогена- I (ИАП-1), что может сопровождаться депрессией фибринолиза. Ангиотензин II является одним из факторов, способствующих развитию атерогенеза, торможению апоптоза и усилению оксидативного стресса в тканях, тем самым провоцируя агрегацию тромбоцитов и тромбообразование.
Ангиотензин II способен усиливать функцию миокарда, участвует в биосинтезе норадреналина и других физиологически активных веществ. Одновременно он может действовать как ростовой фактор, приводя к сосудистой и сердечной гипертрофии.
У некоторых животных и у человека ангиотензин II под воздействием фермента аминопептидазы превращается в гептапептид ангиотензин III. У человека уровень ангиотензина II приблизительно в 4 раза выше, чем ангиотензина III. Оба эти соединения оказывают влияние на уровень кровяного давления и продукцию альдостерона и довольно быстро разрушаются под воздействием ферментов ангиотензиназ.
При тяжелых заболеваниях почек, сопровождающихся их ишемией, благодаря повышенному образованию и секреции ренина наблюдается стойкое повышение кровяного давления (почечная гипертензия). Применение ингибиторов АПФ в этих условиях приводит к быстрой нормализации кровяного давления.
В заключение следует еще раз подчеркнуть, что ангиотензин-ренино-альдостероновая система теснейшим образом связана с функцией калликреин-кининовой системы, ибо образование ангиотензина II и разрушение брадикинина осуществляется под воздействием одного и того же фермента – АПФ.
Catad_tema Артериальная гипертензия - статьи
Catad_tema Ожирение - статьи
Ожирение и артериальная гипертония
Опубликовано в журнале:ПРОБЛЕМЫ ЖЕНСКОГО ЗДОРОВЬЯ № 4, том 3, 2008
Е.И.Асташкин, М.Г.Глезер
Московская медицинская академия им. И.М.Сеченова
РЕЗЮМЕ
В обзоре анализируются роль ожирения в развитии артериальной гипертонии и сердечно-сосудистых заболеваний, патофизиологические механизмы этой связи, доминирующее значение ренин-ангиотензин-альдостероновой системы (РААС). Обсуждаются вопросы фармакологической коррекции высокого артериального давления у больных с ожирением с применением фиксированной комбинации препаратов, блокирующих РААС, и верапамила. Представлен анализ эффективности и безопасности применения сибутрамина для снижения веса у больных с высоким артериальным давлением.
Ключевые слова:
ожирение, артериальная гипертония, лечение.
ABSTRACT
Authors analyzed the role of obesity in development of arterial hypertension and cardiovascular diseases, pathophysiological mechanisms of this relationship, and dominating role of rennin-angiotensin-aldosterone system (RAAS). It was shown that pharmacological correction of high blood pressure in patients with obesity with fixed combination of RAAS blockers and verapamil is effective. The analysis of effectiveness and safety of sibutramine for weight loss in patients with high blood pressure is presented.
Key words:
obesity, arterial hypertension, treatment.
Актуальность рассматриваемой темы обусловлена тем, что во всем мире в последние годы наблюдается значительное увеличение числа людей, имеющих ожирение . Ожирение в настоящее время рассматривают как один из основных факторов, способствующих развитию заболеваний, которые являются главными причинами в структуре смертности среди взрослого населения. В первую очередь речь идет о развитии сахарного диабета 2 типа, а также сердечно-сосудистых и онкологических заболеваниях . Увеличение веса на 1 кг увеличивает риск сердечно-сосудистых заболеваний на 3,1% и диабета - на 4,5-9% .
Известно, что при ожирении риск развития артериальной гипертонии - фактора, также значительно влияющего на появление таких сердечно-сосудистых заболеваний, как инфаркты и инсульты, увеличен втрое по сравнению с людьми, имеющими нормальную массу тела. Как показано в исследовании INTERSALT, на каждые 4,5 кг прибавки веса систолическое артериальное давление (АД) увеличивается на 4,5 мм рт. ст. .
Ожирение, как фактор риска у женщин с артериальной гипертонией, особенно старшего возраста, встречается чаще, чем у мужчин. Одной из причин этого является гипоэстрогения, возникающая в период постменопаузы. Отмечают некоторые особенности распространенности ожирения при разных типах артериальной гипертонии. Так, среди пожилых женщин с изолированной систолической гипертонией ожирение встречается не столь часто, и нет данных о влиянии снижения веса на эту категорию пациентов . У женщин же с абдоминальным типом ожирения, имеющих систоло-диастолические формы артериальной гипертонии, снижение веса является важным моментом в контроле заболевания .
При ожирении возникает ряд гемодинамических изменений, в частности, увеличение объема циркулирующей крови, ударного объема и сердечного выброса при относительно нормальном сосудистом сопротивлении . Считается, что высокое АД у пациентов с ожирением обусловлено, главным образом, увеличенным сердечным выбросом при "неадекватно нормальном" периферическом сопротивлении .
Такое гемодинамическое состояние оказывает стимулирующее воздействие на две антагонистические регуляторные системы, контролирующие объем крови и периферическое сопротивление - ренин-ангиотензин-альдостероновую систему (РААС) и систему натриуретических пептидов сердца. Их нарушенная регуляция может в значительной степени объяснять высокий сердечный выброс у полных пациентов с артериальной гипертонией. Более того, эти сердечно-сосудистые регуляторные системы участвуют в метаболических изменениях, связанных с избыточной массой тела при сердечнососудистых заболеваниях .
Итак, при ожирении в патогенезе артериальной гипертонии играют существенную роль три основных механизма:
Патогенез развития артериальной гипертонии и сердечно-сосудистых заболеваний при ожирении схематично приведен на рисунке 1.
Рисунок 1. Схема патогенеза артериальной гипертонии и сердечно-сосудистых заболеваний при ожирении
Системная и тканевая ренин-ангиотензин-альдостероновая система и ее изменения при ожирении
В состав РААС входят ангиотензиноген, ренин, ангиотензин I, ангиотензин-превращающий фермент (АПФ) и ангиотензин II (АТ II). АТ II оказывает многообразное действие на разные клетки, имеющие специфические рецепторы.
Согласно классическим представлениям ангиотензиноген образуется в печени и под влиянием ренина, синтезируемого в околоклубочковых клетках почек (юкстагломерулярных клетках), ангиотензиноген превращается в крови в ангиотензин I. АПФ ответственен за расщепление АТ I, в результате которого образуется АТ II.
Важно отметить, что при ожирении происходит нарушение механизмов регуляции работы РААС . В физиологических условиях повышение активности РААС приводит к повышению сопротивления периферических сосудов и, соответственно, к повышению АД. По принципу обратной связи повышение АД должно вызывать снижение секреции ренина, падение уровня АТ II и уменьшать содержание альдостерона. Это, в свою очередь, снижает задержку жидкости и натрия и поддерживает АД на нормальном уровне.
Однако у пациентов с висцеральным ожирением нарушается регуляция уровня системных циркулирующих компонентов РААС . Несмотря на повышенное АД, задержку натрия и жидкости, а также увеличение объема циркулирующей крови, активность ренина плазмы и альдостерона остается нормальной или даже несколько повышенной . Подобное нарушение регуляции РААС при ожирении может быть следствием увеличения образования компонентов РААС и/или вторичного роста их концентрации, обусловленного дефектами в системе натрийуретических пептидов.
Было установлено, что помимо РААС крови существует тканевая, или так называемая локальная РААС, которая была выявлена в ряде тканей и органов, в том числе мозге, сердце, сосудах, почках, яичках, жировой ткани и др.
Как известно, ключевую роль в образовании АТ II играют два фактора: активность ренина и концентрация ангиотензиногена. Синтез и секреция ангиотензиногена в клетках разного типа не только определяет повышение локальной концентрации АТ II, но и увеличивает системную активность РААС. Хроническая инфузия АТ II мышам сопровождалась существенным увеличением содержания мРНК ангиотензиногена в адипоцитах . Эти результаты свидетельствуют о наличии положительной обратной связи между АТ II и ангиотензиногеном, когда увеличение уровня одного агента стимулирует образование второго. При ожирении, особенно висцерального типа, активность ренина в плазме сохраняется, как это уже указывалось, на нормальном или несколько повышенном уровне, а уровни ангиотензиногена и АТ II увеличены .
Структура и физиологические свойства жировой ткани
В состав жировой ткани входят клетки разного типа, в том числе адипоциты, макрофаги, фибробласты, эндотелиальные клетки сосудов и преадипоциты (адипобласты) . Последний вид клеток происходит из полипотентных стволовых клеток мезодермы. Из преадипоцитов во взрослом организме человека образуются новые дифференцированные ("малые") адипоциты . Эти адипоциты увеличиваются в размере ("большие" адипоциты) вследствие повышенного поступления с пищей жирных кислот. Длинноцепочечные жирные кислоты попадают в адипоциты из крови и депонируются в виде нейтральных триацилглицеринов. Жировая ткань ответственна за хранение и секрецию длинноцепочечных жирных кислот, выступающих в качестве одного из основных энергетических субстратов для многих органов и тканей, например, для сердечной и скелетной мускулатуры. "Большие" адипоциты секретируют существенно больше насыщенных жирных кислот. Гидролиз триглицеридов и высвобождение жирных кислот происходят под влиянием внутриклеточной гормон-чувствительной липазы, активность которой контролируется катехоламинами (положительная регуляция) и инсулином (отрицательная регуляция).
Эндокринная активность жировой ткани
В отличие от подкожного жира, который составляет обычно 75% от всей жировой ткани организма и является основным хранилищем липидов, висцеральный жир в настоящее время рассматривают как активную гормонпродуцирующую ткань.
Адипоциты продуцируют широкий спектр гормонов и цитокинов, участвующих в метаболизме глюкозы (адипонектин, резистин и др.), липидов (белок, переносящий эфиры холестерина), воспалении (ФНО-α, интерлейкин-6), коагуляции (ингибитор активатора плазминогена-1), регуляции давления крови (ангиотензиноген, АТ II), пищевом поведении (лептин), а также влияющих на метаболизм и функциональную активность различных органов и тканей, в том числе мышц, печени, мозга и сосудов (см. таблицу) .
Таблица. Эндокринная функция адипоцитов: адипоцитокины
| Адипоцитокины | Эффекты адипоцитокинов |
| Лептин | Поглощение пищи, масса жира |
| Адипонектин | |
| Резистин | Резистентность к инсулину, воспаление |
| Висфатин | Резистентность к инсулину |
| Оментин | Резистентность к инсулину |
| Серпин, высвобождающийся из жировой висцеральной ткани (Vaspin) | Резистентность к инсулину |
| Апелин | Вазодилатация |
| Белок, переносящий эфиры холестерина (CETP) | Метаболизм липидов |
| Липопротеиновая липаза (LPL) | Метаболизм липидов |
| Гормончувствительная липаза (HSL) | Метаболизм липидов |
| Белоксвязывающий жирные кислоты в адипоцитах-4 (A-FABP-4 (aP2)) | Метаболизм липидов |
| Перлипин | Метаболизм липидов |
| Ренитол связывающий белок (RBP) | Метаболизм липидов |
| Белокстимулирующий ацилирование (ASP) | Метаболизм липидов |
| Ангиотензин II (AT II) | Артериальное давление |
| Ангиотензин-превращающий фермент (ACE) | Артериальное давление |
| Ангиотензиноген (AGT) | Артериальное давление |
| Фактор некроза опухоли альфа (ФНО-а) | Воспаление |
| Интерлейкин, 6 (ИЛ-6) | Воспаление |
| С-реактивный белок (CRP) | Воспаление |
| Адипоцит-трипсин/комплемент фактор D (Адипсин) | Воспаление |
| Хемоаттрактантный белок макрофагов-1 (МСР-1) | Аттрактант для макрофагов |
| Межклеточная адгезионная молекула-1 (ICAM-1) | Активация макрофагов |
| Ингибитор активатора плазминогена-1 (PAI-1) | Фибринолиз |
Важно подчеркнуть, что даже небольшое увеличение объема висцерального жира играет значительную роль в нарушениях метаболизма, регуляции водноэлектролитного баланса и сердечно-сосудистых заболеваниях.
При увеличении массы жировой ткани содержание практически всех адипокинов в крови возрастает. Исключение составляет адипонектин, уровень которого в этих условиях падает . Лептин и адипонектин являются наиболее изученными адипокинами в настоящее время.
Лептин. Продукция лептина происходит, главным образом, в "больших" адипоцитах . Лептин часто рассматривается в качестве сигнальной молекулы, осуществляющей взаимосвязь между содержанием питательных веществ, поступающих в организм, состоянием жировой ткани и центральной нервной системой (гипоталамусом) . Лептин увеличивает окисление липидов в печени, а также липолиз в адипоцитах и скелетных мышцах . Инсулин стимулирует образование лептина. На уровень лептина также влияют свободные жирные кислоты, ФНО-α, эстрогены и гормон роста .
Адипонектин. Образование адипонектина происходит исключительно в адипоцитах . Адипонектин оказывает разнообразные биологические эффекты - оказывает антиатерогенное действие, увеличивает чувствительность клеток к инсулину, подавляет синтез глюкозы в печени, усиливает ее транспорт в мышцы, увеличивает окисление жирных кислот. Уровень адипонектина снижается при ожирении, резистентности к инсулину и сахарном диабете второго типа .
Жировая ткань и активность РААС
Оказалось, что жировая ткань занимает второе место после печени по образованию ангиотензиногена. Например, количество мРНК ангиотензиногена в адипоцитах составляет около 70% от уровня этого показателя в печени . Наличие взаимосвязи между уровнем ангиотензиногена, ожирением и артериальной гипертонией четко продемонстрировано в экспериментах на модели трансгенных мышей, экспрессирующих избыточные количества ангиотензиногена в жировой ткани. Эти мыши имеют висцеральное ожирение и гипертонию . Преадипоциты и дифференцированные жировые клетки имеют полный набор компонентов, необходимый для локального синтеза АТ II, а также АТ 1 рецептор для АТ II, что обеспечивает внутриклеточную передачу сигналов активации, запускаемых АТ II . При ожирении объем висцеральных дифференцированных адипоцитов увеличивается в 20-30 раз. Ожирение характеризуется дисфункцией адипоцитов, под которой понимают усиление образования и секреции различных адипокинов, цитокинов, а также увеличение содержания компонентов РААС, прежде всего, в висцеральном жире.
Суммируя данные различных исследований, можно констатировать, что при ожирении происходит повышение активности РААС, что находит свое отражение в следующих фактах:
Высокая активность РААС, в свою очередь, приводит к увеличению массы жировой ткани. В частности, трансгенные мыши, чрезмерно экспрессирующие ангиотензиноген только в жировых клетках, демонстрировали повышение уровня ангиотензиногена в крови, развитие гипертонии и увеличение массы жировой ткани . Тканевой АТ II по сути выполняет функцию фактора роста для адипоцитов . АТ II в результате воздействия на АТ 1 рецепторы вызывает увеличение белка циклина D 1 , который участвует в регуляции роста и деления жировых клеток . Показано, что АТ II индуцирует прохождение G 1 фазы клеточного цикла в преадипоцитах человека . Этот эффект был связан с влиянием на АТ 1 рецепторы и последующей активацией циклин D 1 -зависимой киназы .
Установлено, что АТ II вызывает дифференцировку преадипоцитов , активирует ключевые ферменты образования липидов (липогенеза) и увеличивает накопление триглицеридов в адипоцитах .
Висцеральное ожирение сопровождается увеличением активности 11-бета-гидроксистероид дегидрогеназы типа 1, что приводит к образованию кортизола, ключевого гормона дифференцировки преадипоцитов в адипоциты .
Активность тканевой РАС тесно связана с продукцией адипокинов жировой тканью. Показано, например, что АТ II вызывает экспрессию лептина в адипоцитах . Было высказано предположение, что такая активность свойственна только локально синтезируемому АТ II в отличие от системного АТ II .
Ожирение и активность симпатической нервной системы
При ожирении, особенно при абдоминальном его варианте, очень часто наблюдается активация симпатической нервной системы . В исследовании NAS (Normotesive Aging Study) было обнаружено увеличение норадреналина в моче, пропорциональное индексу массы тела . При снижении веса активность симпатической нервной системы уменьшается .
Повышению активности симпатической нервной системы при ожирении способствует наличие гиперинсулинемии и инсулинорезистентности. Инсулин может повышать активность симпатоадреналовой системы сам по себе, но отчасти это может быть связано с действием лептина. Известно, что по мере увеличения степени ожирения тощаковый уровень лептина, который секретируется адипоцитами, растет. Лептин увеличивает активность симпатической нервной системы, особенно в почках. Это приводит, с одной стороны, к высокому выбросу и увеличению частоты сердечных сокращений, а с другой - к повышению реабсорбции натрия и увеличению внутрисосудистого объема крови.
Установлено наличие взаимосвязи между РААС и симпатической нервной системой. С активацией симпатической нервной системы связывают усиление секреции ренина в почках, и происходит это независимо от внутрипочечной сенсорной системы, регулирующей секрецию ренина почками. Более того, увеличение циклического аденозинмонофосфата под влиянием катехоламинов, стимулирует экспрессию ангиотензиногена в адипоцитах человека . Увеличение уровня АТ II усиливает у людей активность симпатической нервной системы. Установлено, что АТ II активирует локальную симпатическую нервную систему, участвующую в повышении температуры тела (термогенезе). Холодовая обработка приводит к увеличению содержания АТ II в адипоцитах без сопутствующего изменения уровня АТ II в плазме .
Таким образом, нарушение регуляции РААС при ожирении также способно стимулировать активность симпатической нервной системы.
Методы фармакологической коррекции повышенного АД при ожирении
Вклад разных патогенетических механизмов в поддержание высокого АД при ожирении может быть различным. Следовательно, в этой ситуации благоприятное действие могут оказывать антигипертензивные препараты с самыми разными механизмами действия.
В соответствии с современными рекомендациями по лечению артериальной гипертонии залогом успеха значимого снижения АД является использование комбинированной терапии. Для пациентов с ожирением в первую очередь основные компоненты такой терапии должны содержать комбинацию препаратов, снижающих активность РААС (ИАПФ и сартаны), с препаратами, снижающими активность симпатической нервной системы (β-адреноблокаторы и недигидропиридиновые антагонисты кальция), и диуретиками. Высокая эффективность использования препаратов, блокирующих РААС, при ожирении показана во многих исследованиях . По поводу использования β-адреноблокаторов данные весьма противоречивы, прежде всего, вообще в связи с сомнениями в их полезности для лечения пациентов с неосложненной артериальной гипертонией, во-вторых, в связи с тем, что β-адреноблокаторы, во всяком случае классические, могут увеличивать вес пациентов и усиливать инсулинорезистентность . Следовательно, если и выбирать β-адреноблокаторы для лечения пациентов с ожирением или метаболическим синдромом, то это должны быть препараты, обладающие особыми свойствами, в частности, карведилол и небиволол.
В то же время установлено, что недигидропиридиновый антагонист кальция верапамил может не только значимо снижать АД , но и уменьшать активность симпатической нервной системы .
Таким образом, при ожирении для лечения артериальной гипертонии можно воспользоваться комбинацией препаратов, блокирующих РААС, и верапамила.
Следует подчеркнуть, что такого типа сочетание лекарственных препаратов существует в виде готовой комбинированной лекарственной формы - препарата Тарка, содержащего в своем составе жирорастворимый ИАПФ - трандолаприл и верапамил медленного высвобождении (верапамил СР). Такой подход очень важен для проведения эффективной терапии, так как использование готовых лекарственных форм улучшает приверженность пациентов к лечению .
Имеются данные, свидетельствующие о том, что препарат Тарка в большей степени, чем каждый из входящих в него компонентов, снижает АД, обладает выраженной способностью снижать гипертрофию левого желудочка, способствует нормализации эндотелиальной функции, является метаболически нейтральным, даже у пациентов с сахарным диабетом .
Двойное действие - снижение активности РААС под влиянием трандолаприла и симпатической нервной системы за счет верапамила пролонгированного действия - обеспечивают важное влияние на патогенетические механизмы развития артериальной гипертонии при ожирении и механизмы, провоцирующие поражение органов-мишеней при данном виде АГ.
Особое внимание, обсуждая лечение АГ при ожирении, следует обратить на то, что терапия, основанная на комбинации трандалаприла с верапамилом длительного действия, позволяет уменьшить риск развития сахарного диабета по сравнению с использованием другой тактики лечения - комбинации сартана с малой дозой тиазидного диуретика. Результаты исследования STAR отчетливо свидетельствует о том, что при применении препарата Тарка в течение одного года у меньшего числа людей с метаболическим синдромом, при котором абдоминальному ожирению придают главенствующее значение, развивается сахарный диабет (рис. 2) .
Рисунок 2. Развитие новых случаев сахарного диабета (глюкоза натощак > 126 мг/дл или 2-часовой уровень при проведении глюкозотолерантного теста > 200 мг/дл) в зависимости от типа антигипертензивной терапии у лиц с метаболическим синдромом в исследовании STAR

Кроме того по данным исследования SТAR-LET, даже при возникновении сахарного диабета на фоне лекарственной терапии перевод этих пациентов на прием препарата Тарка позволил у половины пациентов нормализовать углеводный обмен .
Результаты этих исследований заставляют пересмотреть рекомендации по медикаментозной терапии артериальной гипертонии у лиц с метаболическим синдромом и начинать терапию с комбинации, содержащей ИАПФ (или сартан) и антагонист кальция, или перевести пациентов на подобную терапию.
Как уже неоднократно упоминалось, для лечения артериальной гипертонии уменьшение веса пациентов и степени абдоминального ожирения играет важную роль. Конечно, снижение тем или иным способом массы тела может оказывать значимое влияние на снижение частоты сердечно-сосудистых заболеваний. В настоящее время существуют разные подходы для медикаментозной терапии ожирения . Первый - это симптоматическое лечение, а именно уменьшение количества потребляемых калорий за счет снижения всасывания жира, поступающего с пищей. Подобный подход можно назвать компенсаторным. Действительно, при такой терапии заболевание не устраняется (так как пациент продолжает переедать), а лишь временно компенсируется препаратом. Другой подход к лечению излишней массы тела и ожирения - это устранение сути проблемы, а именно хронического переедания. Так действует сибутрамин (препарат Меридиа). Он приводит к наступлению быстрого насыщения, снижает количество потребляемой пищи за счет подавления обратного захвата норадреналина и серотонина в синапсах нейрональных цепей . Сегодня Меридиа - это единственный оригинальный препарат, устраняющий причину ожирения.
Принципиальным отличием сибутрамина является то, что, не вызывая снижения аппетита, он способствует более раннему наступлению чувства сытости. Человек избавляется от патологической привычки переедать, результатом чего является постепенное и устойчивое снижение массы тела. Под влиянием сибутрамина потребление пищи снижается примерно на 20%. Наряду с этим сибутрамин опосредованно влияет на уровень биогенных аминов в крови, которые активируют адренорецепторы жировой ткани и инициируют липолиз в адипоцитах, что сопровождается изменением содержания энергетических субстратов в крови. Сибутрамин за счет активации β 2 - и β 3 -адренорецепторов усиливает процессы термогенеза и увеличивает расход энергии в организме.
Клиническая эффективность и безопасность сибутрамина (Меридиа) были продемонстрированы в большом количестве многоцентровых исследований. В частности, в исследовании STORM (Sibutramine Trial on Obesity Reduction and Maintenance), в которое включили 605 пациентов с ожирением, было показано, что двухлетний прием сибутрамина снижал вес пациентов в 3 раза, а окружность талии - в 2 раза более выраженно, чем плацебо . Важно, что в течение двух лет достигнутое снижение веса поддерживали 80% пациентов по сравнению с 16% пациентов, получавшими плацебо (p < 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов высокой плотности повысился на 21% при снижении уровней липопротеидов низкой плотности и триглицеридов.
Положительное действие уменьшения веса в лечении пациентов с артериальной гипертонией и другими сердечно-сосудистыми заболеваниями может заключаться также в том, что уменьшение внутрибрюшного жира может снизить механическое сдавление почек, что может привести к улучшению их кровоснабжения и снижению активности РААС. Уменьшение жировой ткани внутри и вокруг почек может привести к снижению интерстициального давления, компрессии тонкой части петли Генли, увеличению кровотока в vasa recta, снижению канальцевой реабсорбции Na + и воды . Тем самым снижение веса, обусловленное методами немедикаментозной или медикаментозной коррекции, может уменьшать высоту артериального давления.
Однако до последнего времени в реальной клинической практике сибутрамин применяли с осторжностью, опасаясь его возможного негативного влияния на показатели АД и ЧСС, что, в свою очередь, могло приводить, хоть и у небольшого числа пациентов, но к неприятным субъективным ощущениям. Для изучения влияния сибутрамина на сердечно-сосудистую систему и доказательства безопасности препарата у группы пациентов с повышенным риском сердечно-сосудистых заболеваний было инициировано крупномасштабное многоцентровое двойное слепое плацебо контролируемое международное исследование SCOUT (Sibutramine Cardiovascular OUTcomes), где наблюдались 10 742 пациентов, из которых 97% имели заболевания сердечно-сосудистой системы, 88 - артериальную гипертонию и 84% - сахарный диабет 2 типа. По результатам первого завершившегося этапа исследования было установлено, что назначение сибутрамина привело к достоверному (р < 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Возникает закономерный вопрос, как будет соотноситься тот или иной вид антигипертензивной терапии с лечением сибутрамином. Несколько исследований было проведено для того, чтобы получить ответ на этот вопрос. Так, например, было показано, что использование комбинированной лекарственной формы, содержащей верапамил 180 мг/трандолаприл 2 мг в сочетании с сибутрамином 10 мг, приводило в течение 6 месяцев к более выраженному снижению АД, чем проведение только антигипертензивной терапии - систолическое АД снизилось, соответственно, на 21,9 ± 8,1 против 15,9 ± 12,3 мм рт. ст. и диастолическое - на 15,7 ± 8,1 против 9,1 ± 9,9 мм рт. ст. (p = 0,03). Комбинированная терапия приводила также к более выраженному улучшению антропометрических показателей; достоверное (p <5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
В проспективном, многоцентровом, плацебо-контролируемом, двойном слепом исследовании HOS (Hypertension-Obesity-Sibutramine) в течение 16 недель было проведено сопоставление проведения различных режимов антигипертензивной терапии (фелодипин 5 мг/рамиприл 5 мг (n = 57), верапамил 180 мг/трандолаприл 2 мг (n = 55), метопролол сукцинат 95 мг/гидрохлортиазид 12,5 мг n = 59) при назначении сибутрамина и плацебо . В этом исследовании было подтверждено, что сибутрамин может повышать АД. Поэтому, конечно, необходимо адекватное проведение антигипертензивной терапии в период применения сибутрамина у пациентов с артериальной гипертонией. Показано также, что при лечении комбинацией β-адреноблокатора и гидрохлортиазида положительные эффекты сибутрамина по снижению веса, окружности талии и влиянию на метаболический профиль были выражены существенно меньше, чем при сочетании комбинированной терапии ИАПФ и антагонистами кальция с сибутрамином. Это еще раз подтверждает необходимость тщательного выбора антигипертензивной терапии у пациентов с ожирением, особенно при проведении программ, направленных на снижение веса. И в заключение следует отметить, что с нашей точки зрения одной из значимых проблем, снижающих эффективность борьбы с ожирением, является то, что ни врачи, ни население не рассматривают ожирение как значимый фактор риска. Более того, пациенты часто не оценивают себя как людей, имеющих ожирение. Например, в исследовании ПОЛОНЕЗ по оценке врачей, основанной на вычислении ИМТ, ожирение и у мужчин, и у женщин регистрировалось в три раза чаще, чем по самооценке пациентов . Таким образом, должна быть усилена и проводиться разъяснительная работа среди населения о необходимости предупреждения увеличения массы тела, коррекция имеющегося ожирения и важности постоянной терапии артериальной гипертонии. ЛИТЕРАТУРА
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Prevalence and trends in obesity among US adults, 1999-2000. JAMA 2002; 288: 1723-7.
2. Pi-Sunyer F.X. The epidemiology of central fat distribution in relation to disease. Nutr Rev 2004; 62(7): 120-6.
3. Arbeeny C.M. Addressing the unmet medical need for safe and effective weight loss therapies. Obes Res 2004; 12(8): 1191-6.
4. Stamler J., Rose G., Stamler R., et al. INTERSALT study findings. Public health and medical care implications. Hypertension 1989; 14(5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Excessive weight and hypertension in the elderly - the results of the community study. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et al. Decrease in intra-abdominal visceral fat may reduce blood pressure in obese hypertensive women. Hypertension 1996; 27(1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et al. American Heart Association; Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation 2006; 113: 898-918.
8. Alpert M.A. Obesity cardiomyopathy; pathophysiology and evolution of the clinical syndrome. Am J Med Sci 2001; 321: 225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hypertension and obesity. Recent Progr Horm Res 2004; 59: 169-205.
10. Engeli S., Sharma A.M. The renin-angiotensin system and natriuretic peptides in obesity-associated hypertension. J Mol Med 2001; 79: 21-9.
11. Lafontan M., Moro C., Sengenes C., et al. An unsuspected metabolic role for atrial natriuretic peptides: the control of lipolysis, lipid mobilization, and systemic nonesterified fatty acids levels in humans. Arterioscler Thromb Vasc Biol 2005; 25: 2032-42.
12. Hall J.E. The kidney, hypertension and obesity. Hypertension 2003; 41(3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et al. ACE, angiotensinogen and obesity: a potential pathway leading to hypertension. J Hum Hypertens 1997; 11: 107-11.
14. Lu Н., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotensin II increases adipose angiotensinogen expression. Am J Physiol Endocrinol Metab 2007; 292: 1280-7.
15. Engeli S., Negrel R., Sharma A.M. Physiology and pathophysiology of the adipose tissue renin-angiotensin system. Hypertension 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. Adipose development: from stem cell to adipocyte. Crit Rev Biochem Mol Biol 2005; 40: 229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. Adipose tissue dysfunction in obesity, diabetes, and vascular diseases. Eur Heart J 2008; 29: 2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A., et al. Adipokines and risk of type 2 diabetes in older men. Diabetes Core 2007; 30: 1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et al. Plasma insulin, leptin, and soluble TNF receptoirs levels in relation to obesity-related atherogenic and thrombogenic cardiovascular disease risk factors among men. Atheroslerosis 2001; 157: 495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Relationship between adipocyte size and adipokine expression and secretion. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T, Fukui T., et al. Angiotensin II infusion decreases plasma adiponectin level via its type 1 receptor in rats: an implication for hypertension related insulin resistance. Metabolism 2006; 55: 478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et al. Serum immunoreactive-leptin concentration in normal-weight and obese human. N Engl J Med 1996; 334: 292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et al. Central nervous system control of food intake. Nature 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanocortin neurons are direct targets for leptrin in the hypothalamus. Endocrinology 1997; 138; 4489-92.
25. Long Y.C., Zierath J.R. AMP-activated protein kinase signaling in metabolic regulation. J Clin Invest 2006; 116: 1776-83.
26. Saladin R., De Vos P., Guerre-Millo M., et al. Transient increase in obese gene expression after food intake or insulin administration. Nature 1995; 377: 527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Tumor necrosis factor-alpha exerts dual effects on huuman adipose leptin synthesis and release. Mol Cell Endocrinol 2000; 159: 79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., et al. Adiponectin and development of type 2 diabetes in the Pima Indian population. Lancet 2002; 360: 57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et al. Low plasma levels of adiponectin are associated with low risk for future cardiovascular events in patients with clinical evident vascular disease. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D., et al. Adipose angiotensinogen is involved in adipose tissue growth and blood pressure regulation. FASEB J 2001; 15: 2727-9.
31. Paul M., Mehr A.P., Kreutz R. Physiology of local renin-angiotensin systems. Physiol Rev 2006; 86: 747-803.
32. Karlsson C., Lindell K., Ottosson M., et al. Human adipose tissue expresses angiotensinogen and enzymes required for its conversion to angiotensin II. J Clin Endocrinol Metab 1998; 83: 3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Hormonal regulation of the human adipose-tissue renin-angiotensin system: relationship to obesity and hypertension. J Hypertens 2002; 20: 965- 73.
34. Engeli S., Gorzelniak K., Kreutz R., et al. Co-expression of renin-angiotensin system genes in human adipose tissue. J Hypertens 1999; 17: 555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., et al. Renin receptor expression in human adipose tissue. Am J Physiol Regul Integr Comp Physiol 2007; 292: 274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Renin-angiotensin system, natrriuretic peptides, obesity, metabolic syndrome, and hypertension: an integrated view in human. J Hypertens 2008; 26: 831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et al. Angiotensin II receptors in human preadipocytes: role in cell cycle regulation. Endocrinology 1999; 140: 154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G., et al. Angiotensin II as a trophic factor of white adipose tissue: stimulation of adipose cell formation. Endocrinology 2001; 142: 487-92.
39. Watanabe G., Lee R.J., Albanese C., et al. Angiotensin II activation of cyclin D1-dependent kinase activity. J Biol Chem 1996; 271: 22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Differentiation of preadipose cells: paracrine role of prostacyclin upon stimulation of adipose cells by angiotensin-II. Endocrinology 1994; 135: 2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotensin II increases lipogenesis in 3T3-L1 and human adipose cells. Endocrinology 1997; 138: 1512-9.
42. Wake D.J., Walker B.R. Inhibition of 11beta-hydroxysteroid dehydrogenase type 1 in obesity. Endocrine 2006; 29: 101-8.
43. Engeli S., Bohnke J., Feldpausch M., et al. Regulation of 11beta-HSD genes in human adipose tissue: influence of central obesity and weight loss. Obes Res 2004; 12: 9-17.
44. Kim S., Whelan J., Claycombe K., et al. Angiotensin II increases leptin secretion by 3T3-L1 and human adipocytes via a prostaglandin-independent mechanism. J Nutr 2002; 132: 1135-40.
45. Cassis L.A., English V.L., Bharadwaj K., Boustany C.M. Differential effects of local versus systemic angiotensin II in the regulation of leptin release from adipocytes. Endocrinology 2004; 145: 169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et al. The sympathetic nervous system and the metabolic syndrome. J Hypertens 2007; 25: 909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Sympathetic system activity in obesity and metabolic syndrome. Ann N Y Acad Sci 2006; 1083: 129-52.
48. Landsberg L., Troisi R., Parker D., et al. Obesity, blood pressure, and the sympathetic nervous system. Ann Epidemiol 1991; 1: 295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Human adipose angiotensinogen gene expression and secretion are stimulated by cyclic AMP via increased DNA cyclic AMP responsive element binding activity. Endocrine 2004; 25: 97-104.
50. Cassis L.A. Role of angiotensin II in brown adipose thermogenesis during cold acclimation. Am J Physiol Endocrinol Metab 1993; 265: 860-5.
51. Cassis L.A., Dwoskin L.P. Presynaptic modulation of neurotransmitter release by endogenous angiotensin II in brown adipose tissue. J Neural Transm 1991; 34: 129-37.
52. Reisin E., Weir M., Falkner B., et al. Lisinopril versus hydrochlorothiazide in obese hypertensive patients: a multi-center placebo-controlled trial. Treatment in Obese Patients With Hypertension (TROPHY) Study Group. Hypertension 1997; 30(1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., et al. The efficacy and safety of low- and high-dose fixed combinations of irbesartan/hydrochlorothiazide in patients with uncontrolled systolic blood pressure on monotherapy: the INCLUSIVE trial. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Беленков Ю.Н., Чазова И.Е., Мычка В.Б. от имени исследовательской группы "ЭКО". Многоцентровое рандомизированное открытое исследование по изучению эффективности изменения образа жизни и терапии ингибиторами АПФ (квинаприлом) у больных ожирением и артериальной гипертонией (ЭКО). Артериальная гипертензия 2003; 9(6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Antihypertensive therapy and insulin sensitivity: do we have to redefine the role of beta-blocking agents? Am J Hypertens 1998; 11(10): 1258-65.
56. Kaaja R., Kujala S., Manhem K., et al. Effects of sympatholytic therapy on insulin sensitivity indices in hypertensive postmenopausal women. Int J Clin Pharmacol Ther 2007; 45(7): 394-401.
57. Kuperstein R., Sasson Z. Effects of antihypertensive therapy on glucose and insulin metabolism and on left ventricular mass: a randomized, double-blind, controlled study of 21 obese hypertensives. Circulation 2000; 102(15): 1802-6.
58. Halperin A.K., Cubeddu L.X. The role of calcium channel blockers in the treatment of hypertension. Am Heart J 1986; 111(2): 363-82.
59. McAllister R.G. Jr. Clinical pharmacology of slow channel blocking agents. Prog Cardiovasc Dis 1982; 25(2): 83-102.
60. Binggeli C., Corti R., Sudano I., et al. Effects of chronic calcium channel blockade on sympathetic nerve activity in hypertension. Hypertension 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K., et al. The effects of dihydropyridine and phenylalkylamine calcium antagonist classes on autonomic function in hypertension: the VAMPHYRE study. Am J Hypertens 2001; 14(11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Compliance patterns of patients treated with 2 separate antihypertensive agents versus fixed-dose combination therapy Am J Hypertens 2004; 175: 223.
63. Dezii C.M. A retrospective study of persistence with single-pill combination therapy vs. concurrent two-pill therapy in patients with hypertension. Manag Care. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. Adherence patterns among patients treated with fixed-dose combination versus separate antihypertensive agents. Am J Health Syst Pharm 2007; 64(12): 1279-83.
65. Jackson K. Persistence of fixed versus free combination with valsartan and HCTZ for patients with hypertension. Value Health Suppl 2006; 9: 363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Cardiovascular effects of a trandolapril/verapamil combination in patients with mild to moderate essential hypertension. Am J Cardiol 1997; 79(6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. Trandolapril/verapamil sustained release: a review of its use in the treatment of essential hypertension. Drugs 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Managing hypertension in diabetic patients - focus on trandolapril/verapamil combination. Vasc Health Risk Manag 2007; 3(4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et al. Differences in glucose tolerance between fixed-dose antihypertensive drug combinations in people with metabolic syndrome. Diabetes Care 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., et al. Reversal of diuretic-associated impaired glucose tolerance and new-onset diabetes: results of the STAR-LET study. J Cardiometab Syndr 2008; 3(1): 18-25.
71. Bailey C.J., Day C. New pharmacological approaches to obesity. Obesity Practice 2005; 1: 2-5.
72. Yanovski S.Z., Yanovski J.A.Y. Obesity. N Engl J Med 2002; 346(8): 591-602.
73. Day C., Bailey C.J. Sibutramine update. Br J Diabet Vasc Dis 2002; 2: 392-7.
74. James W.P., Astrup A., Finer N., et al. Effect of sibutramine on weight maintenance after weight loss: a randomised trial. STORM Study Group. Sibutramine Trial of Obesity Reduction and Maintenance. Lancet 2000; 356: 2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W., et al. Cardiovascular responses to weight management and sibutramine in high-risk subjects: an analysis from the SCOUT trial. Eur Heart J 2007; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W., et al. Blood pressure changes associated with sibutramine and weight management - an analysis from the 6-week lead-in period of the sibutramine cardiovascular outcomes trial (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et al. Effects of sibutramine plus verapamil sustained release/trandolapril combination on blood pressure and metabolic variables in obese hypertensive patients. Expert Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., et al. Optimal treatment of obesity-related hypertension: the Hypertension-Obesity-Sibutramine (HOS) study. Circulation 2007; 115(15): 1991-8.
79. Глезер М.Г. Результаты российского исследования ПОЛОНЕЗ (Эффективность и безоПаснОсть энаренаЛа у пациентОв с артериальНой гипЕртенЗией). Терапевтический архив 2006; 4: 44-50.
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.


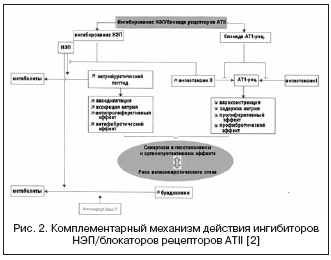
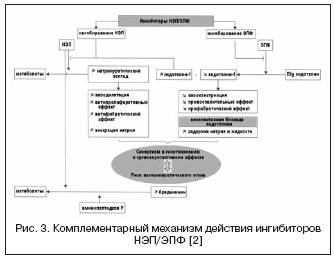
Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.


