Альдостерон у людини є основним представником мінералокортикоїдних гормонів, похідних холестеролу.
Синтез
Здійснюється у клубочковій зоні кори надниркових залоз. Утворений із холестеролу прогестерон на шляху до альдостерону піддається послідовному окисленню 21-гідроксилазою, 11-гідроксилазою та 18-гідроксилазою . Зрештою утворюється альдостерон.

Схема синтезу стероїдних гормонів (повна схема)
Регуляція синтезу та секреції
Активують:
- ангіотензин II, що виділяється при активації ренін-ангіотензинової системи,
- підвищення концентрації іонів каліюу крові (пов'язане з деполяризацією мембран, відкриттям кальцієвих каналів та активацією аденілатциклази).
Активація ренін-ангіотензинової системи
- Для активації цієї системи існує два пускові моменти:
- зниження тискуу приносять артеріолах нирок, що визначається барорецепторамиклітин юкстагломерулярного апарату Причиною цього може бути порушення ниркового кровотоку - атеросклероз ниркових артерій, підвищена в'язкість крові, зневоднення, крововтрати і т.п.
- зниження концентрації іонів Na +у первинній сечі у дистальних канальцях нирок, що визначається осморецепторами клітин юкстагломерулярного апарату. Виникає в результаті дієти без солі, при тривалому використанні діуретиків.
Постійна та незалежна від ниркового кровотоку секреція реніну (базова) підтримується симпатичною нервовою системою.
- При виконанні одного або обох пунктів клітини юкстагломерулярного апаратуактивуються та з них у плазму крові секретується фермент ренін.
- Для реніну в плазмі є субстрат – білок α2-глобулінової фракції. ангіотензиноген. В результаті протеолізу від білка відщеплюється декапептид під назвою ангіотензин I. Далі ангіотензин І за участю ангіотензин-перетворюючого ферменту(АПФ) перетворюється на ангіотензин II.
- Головними мішенями ангіотензину II є гладкі міоцити. кровоносних судині клубочкова зона коринадниркових залоз:
- стимуляція кровоносних судин викликає їх спазм та відновлення артеріального тиску.
- з надниркових залоз після стимуляції секретується альдостерон, що діє на дистальні канальці нирок.
При дії альдостерону на канальці нирок збільшується реабсорбція іонів Na +, слідом за натрієм рухається вода. В результаті тиск у кровоносній системі відновлюється і концентрація іонів натрію збільшується в плазмі крові і, отже, у первинній сечі, що знижує активність РААС.

Активація ренін-ангіотензин-альдостеронової системи
Механізм дії
Цитозольний.
Мішені та ефекти
Впливає на слинні залози, на дистальні канальці та збиральні трубочки нирок. У нирках посилює реабсорбцію іонів натріюі втрату іонів калію за допомогою таких ефектів:
- збільшує кількість Na + ,K + -АТФази на базальній мембраніепітеліальних клітин,
- стимулює синтез мітохондріальних білків і збільшення кількості енергії, що напрацьовується в клітині, для роботи Na + ,K + -АТФази,
- стимулює утворення Na-каналів на апікальній мембрані клітин ниркового епітелію.
Патологія
Гіперфункція
Синдром Конна (первинний альдостеронізм) – виникає при аденомах клубочкової зони. Характеризується тріадою ознак: гіпертензія, гіпернатріємія, алкалоз.
Вториннийгіперальдостеронізм – гіперплазія та гіперфункція юкстагломерулярних клітин та надмірна секреція реніну та ангіотензину II. Відзначається підвищення артеріального тиску та поява набряків.
Ренін-ангіотензин-альдостеронова система є комплексом ферментів та гормонів, які підтримують гомеостаз. Регулює рівновагу солі та води в організмі та рівень артеріального тиску.
Механізм роботи
Фізіологія ренін-ангіотензин-альдостеронової системи бере початок на межі коркового і де є юкстагломерулярні клітини, що виробляють пептидазу (фермент) – ренін.
Ренін є гормоном та початковою ланкою РААС.
Ситуації, за яких ренін виділяється в кров
Існує кілька станів, за яких йде попадання гормону в кровоносне русло:
- Зменшення кровотоку в тканині нирок – при запальних процесах (гломерулонефрит ін.), при діабетичної нефропатії, пухлини нирок.
- Зниження (при кровотечі, багаторазовому блюванні, проносах, опіках).
- Падіння рівня артеріального тиску. В артеріях нирок є барорецептори, які реагують зміну системного тиску.
- Зміна концентрації іонів натрію. В організмі людини є скупчення клітин, які відповідають зміну іонного складу крові стимуляцією вироблення реніну. Сіль втрачається при рясному потовиділенні, а також при блюванні.
- Стреси, психоемоційні навантаження. нирки іннервуються симпатичними нервами, які активуються при негативних психологічних впливах.
У крові ренін зустрічається з білком – ангіотензиногеном, який виробляється клітинами печінки та забирає у нього фрагмент. Утворюється ангіотензин I, який є джерелом впливу для ангіотензинперетворюючого ферменту (АПФ). У результаті виходить ангіотензин II, який є другою ланкою і є потужним вазоконстриктором артеріальної системи(Звужує судини).
Ефекти ангіотензину ІІ
Ціль: підвищити артеріальний тиск.
- Сприяє синтезу альдостерону в клубочковій зоні кори надниркових залоз.
- Впливає на центр голоду та спраги в головному мозку, викликаючи "сольовий" апетит. Поведінка людини стає мотивованою на пошук води та солоної їжі.
- Впливає на симпатичні нервисприяючи вивільненню норадреналіну, який теж є вазоконстриктором, але менш слабким за дією.
- Впливає на судини, викликаючи їхній спазм.
- Бере участь у розвитку хронічної серцевої недостатності: сприяє проліферації, фіброзу судин та міокарда.
- Знижує
- Гальмує вироблення брадикініну.

Альдостерон – третій компонент, який діє на кінцеві канальці нирок та сприяє виділенню з організму іонів калію, магнію та зворотному всмоктуванню (реабсорбції) натрію, хлору, води. Завдяки цьому зростає обсяг циркулюючої рідини, піднімаються цифри артеріального тиску і посилюється нирковий кровотік. Рецептори до альдостерону є у нирках, а й у серці, судинах.
Коли організм досягає гомеостазу, починають вироблятися вазодилататори (речовини, що розширюють судини) – брадикінін та каллідін. А компоненти РААС руйнуються у печінці.
Схема ренін-ангіотензин-альдостеронової системи

Як і будь-яка система, РААС може давати збій. Патофізіологія ренін-ангіотензин-альдостеронової системи виявляє при наступних станах:
- Ураження кори надниркових залоз (інфекція, крововилив та травма). Розвивається стан нестачі альдостерону, і організм починає втрачати натрій, хлор та воду, що призводить до зменшення об'єму циркулюючої рідини та зниження артеріального тиску. Стан компенсують запровадженням сольових розчинівта стимуляторів рецепторів до альдостерону.
- Пухлина кори надниркових залоз призводить до надлишку альдостерону, який реалізує свої ефекти та підвищує тиск. Також активізуються процеси поділу клітин, виникає гіпертрофія та фіброз міокарда, та розвивається серцева недостатність.
- Патологія печінки, коли порушується руйнація альдостерону та відбувається його накопичення. Патологія лікується блокаторами рецепторів до альдостерону.
- Запальні захворювання нирок.

Значення РААС для життя та медицини
Ренін-ангіотензин-альдостеронова система та її роль в організмі:
- приймає активна участьу підтримці нормального показника артеріального тиску;
- забезпечує рівновагу води та солей в організмі;
- підтримує кислотно-основний баланс крові.
Система може давати збій. Впливаючи на її компоненти, можна боротися із гіпертонічною хворобою. Механізм виникнення ниркової гіпертензії також тісно пов'язаний із РААС.
Високоефективні групи препаратів, які синтезовані завдяки вивченню РААС
- "Прили". АПФ. Ангіотензин I не перетворюється на ангіотензин II. Немає вазоконстрикції – немає підвищення артеріального тиску. Препарати: Амприлан, Еналаприл, Каптоприл та ін. Інгібітори АПФ значно покращують якість життя хворих на цукровий діабет, забезпечуючи профілактику ниркової недостатності. Препарати приймають у мінімальному дозуванні, яке не викликає зниження тиску, а лише покращує місцевий кровотік та клубочкову фільтрацію. Медикаменти незамінні при нирковій недостатності, хронічної хворобисерця і є одним із засобів лікування гіпертонічної хвороби (якщо немає протипоказань).
- "Сартани". Блокатори рецепторів ангіотензину II. Судини не реагують на нього та не скорочуються. Препарати: Лозартан, Епросартан та ін.

Протилежною ренін-ангіотензин-альдостероновою системою є кінінова. Тому блокування РААС призводить до підвищення в крові компонентів кінінової системи (брадикінін та ін), що сприятливо впливає на тканини серця та стінки судин. Міокард не відчуває голодування, тому як брадикінін посилює місцевий кровотік, стимулює вироблення природних вазодилататорів у клітинах мозкової речовини нирок та мікроцитах збірних трубочок – простагландинів Е та І2. Вони нейтралізують пресорну дію ангіотензину ІІ. Судини не спазмовані, що забезпечує адекватне кровопостачання органів та тканин організму, кров не затримується та знижується формування атеросклеротичних бляшок та тромбів. Кініни сприятливо впливають на нирки, збільшують діурез (добове виділення сечі).
Ренін
- фермент, що синтезується юкстагломерулярними клітинами ниркових аферентних артеріол, що має ММ близько 40 кДа. Особливо інтенсивно утворення реніну відбувається при ішемії нирок. Локалізація юкстагломерулярних клітин робить їх особливо чутливими до змін кров'яного тиску, а також концентрації іонів Na+ та К+ у рідині, що протікає через ниркові канальці. Завдяки зазначеним властивостям будь-яка комбінація факторів, що викликає зниження обсягу рідини (зневоднення, падіння кров'яного тиску, крововтрата та ін.) або зниження концентрації NaClстимулює вивільнення реніну.
У той же час більшість регуляторів синтезу реніну діють через ниркові барорецептори.На звільнення реніну впливає стан ЦНС, і навіть зміна становища тіла у просторі. Зокрема, при переході з положення лежачи в положення сидячи або стоячи (клиностатична проба), секреція реніну збільшується. Ця рефлекторна реакція обумовлена підвищенням тонусу симпатичної частини автономної нервової системи, що передає імпульси до b-адренорецепторів юкстагломерулярних клітин
Основним субстратом, на який впливає ренін, є ангіотензиноген- Білок, що входить у фракцію a 2 -глобулінів і утворюється печінкою. Під впливом глюкокортикоїдів та естрогенів синтез ангіотензиногену значно зростає. У результаті дії реніну ангіотензиноген перетворюється на декапептид. ангіотензинI.Ця сполука має надзвичайно слабку дію і істотного впливу на рівень кров'яного тиску не має.
Тим часом ангіотензинIпід впливом так званого ангіотензинперетворюючого ферменту (АПФ)переходить у потужний судинозвужувальний фактор – ангіотензинІІ. АПФ(Дипептидкарбооксипептидаза) є інтегральним білком, розташованим переважно на мембрані ендотеліальних клітин, епітелії, мононуклеарах, нервових закінченнях, клітинах репродуктивних органів та ін. Розчинна форма АПФ присутня практично у всіх рідинах організму.
Прийнято виділяти дві ізоформи АПФ. Перша їх отримала умовне найменування «соматичної». Ця ізоформа має ММ 170 кДа і включає гомологічні С- та N-домени. Друга форма АПФ («репродуктивна») знайдена в насінній рідині, має ММ близько 100 кДа і відповідає С-домену першої ізоформи АПФ. Кожен із 2 вказаних доменів містить амінокислотні залишки, які можуть брати участь в утворенні зв'язку з атомом цинку. Такі Zn 2+ -структури є типовими для багатьох металопротеїназ і виявляються основними ділянками взаємодії ферменту як із субстратом, так і з інгібіторами АПФ.
Слід зазначити, що АПФ не лише призводить до освіти ангіотензину II,але й руйнує брадикінін -з'єднання, що розширює кровоносні судини. Отже, збільшення кров'яного тиску при дії АПФ пов'язане як із утворенням ангіотензину II, так і з розпадом брадикініну (рис. 32).
Важливу роль дії АПФ грає іонний склад і, зокрема, вміст іонів хлору. Так, при високій концентрації Cl - С-домен АПФ гідролізує і брадикінін, і ангіотензин-I швидше, ніж N-домен. У позаклітинних регіонах, де концентрація аніонів хлору висока, перетворення ангіотензину-I відповідає переважно N-домен. Однак внутрішньоклітинно, де концентрація Cl – низька, N-домен може брати участь у гідролізі інших пептидних субстанцій.
За останні рокивстановлено, що АПФ відіграє важливу роль у гемопоезі, бо під його впливом пригнічується освіта гематопоетичного пептиду, що гальмує утворення гематопоетичних клітин кісткового мозку
Роль АПФ в організмі виявили на мишах, позбавлених гена АПФ. У таких тварин відзначався низький кров'яний тиск, різні судинні дисфункції, порушення структури та функції нирок та безплідність у самців.
АнгіотензинII
збільшує кров'яний тиск, викликаючи звуження артеріол, і є сильнодіючим з відомих вазоактивних агентів. Крім того, він за механізмом зворотного зв'язку гальмує утворення та вивільнення реніну юкстагломерулярними клітинами нирки, що зрештою має відновлювати нормальний рівень кров'яного тиску. Під впливом ангіотензинуIIрізко зростає продукція основного мінералокортикоїду альдостерону.Незважаючи на те, що ця дія є прямою, ангіотензин II не впливає на продукцію кортизолу. Основне призначення альдостерону зводиться до затримки Na+ (за рахунок посилення його реабсорбції в ниркових канальцях) та виділення К+ та Н+ (головним чином через нирки). Ці реакції здійснюються в такий спосіб.
Альдостерон
проникає з позаклітинної рідини в цитоплазму клітини і там з'єднується зі специфічним рецептором, після чого комплекс (альдостерон + рецептор), що утворився, проникає в ядро. Альдостерон також стимулює відкриття Na+ каналів, завдяки чому іони Na+ входять до клітини через апікальну мембрану з просвіту канальця.
Збільшення секреції К+ під впливом альдостерону обумовлено зростанням проникності апікальної мембрани по відношенню до цих іонів, завдяки чому К+ надходить із клітини у просвіт канальця.
Затримка Na+ в організмі, як і ангіотензин II, сприяє підвищенню артеріального тиску.
АнгіотензинIIздатний зв'язуватися зі специфічними рецепторами клубочкових клітин надниркових залоз. Зміст цих рецепторів багато в чому залежить від концентрації іонів К+. Так, якщо рівень К+ підвищується, то зростає кількість рецепторів до ангіотензину II у клубочкових клітинах. При зменшенні концентрації іонів К+ відзначається прямо протилежний ефект. Отже, іони К+ відіграють основну роль дії ангіотензину II на надниркові залози.
За останнім часомвстановлено, що ангіотензинIIздатний активувати макрофаги, завдяки чому посилюється агрегація тромбоцитів та прискорюється згортання крові. Одночасно при цьому вивільняється інгібітор активатора плазміногену-I (ІАП-1),що може супроводжуватися депресією фібринолізу. А нгіотензинIIє одним із факторів, що сприяють розвитку атерогенезу, гальмування апоптозу та посилення оксидативного стресу в тканинах, тим самим провокуючи агрегацію тромбоцитів та тромбоутворення.
АнгіотензинIIздатний посилювати функцію міокарда, бере участь у біосинтезі норадреналіну та інших фізіологічно активних речовин. Одночасно він може діяти як ростовий фактор, що призводить до судинної та серцевої гіпертрофії.
У деяких тварин та у людини ангіотензинIIпід впливом ферменту амінопептидазиперетворюється на гептапептид ангіотензинІІІ.У людини рівень ангіотензину II приблизно вчетверо вищий, ніж ангіотензину III. Обидві ці сполуки впливають на рівень кров'яного тиску та продукцію альдостерону і досить швидко руйнуються під впливом ферментів ангіотензиназ.
При тяжких захворюваннях нирок, що супроводжуються їх ішемією, завдяки підвищеній освіті та секреції реніну спостерігається стійке підвищення кров'яного тиску ( ниркова гіпертензія). Застосування інгібіторів АПФ у умовах призводить до швидкої нормалізації кров'яного тиску.
На закінчення слід ще раз підкреслити, що ангіотензин-ренін-альдостеронова система тісно пов'язана з функцією калікреїн-кінінової системи, бо утворення ангіотензину II і руйнування брадикініну здійснюється під впливом одного і того ж ферменту - АПФ.
Catad_tema Артеріальна гіпертензія- статті
Catad_tema Ожиріння - статті
Ожиріння та артеріальна гіпертонія
Опубліковано у журналі:ПРОБЛЕМИ ЖІНОЧОГО ЗДОРОВ'Я № 4, том 3, 2008
Е.І.Асташкін, М.Г.Глезер
Московська медична академія ім. І.М.Сєченова
РЕЗЮМЕ
В огляді аналізуються роль ожиріння у розвитку артеріальної гіпертонії та серцево-судинних захворювань, патофізіологічні механізми цього зв'язку, домінуюче значення ренін-ангіотензин-альдостеронової системи (РААС) Обговорюються питання фармакологічної корекції високого артеріального тиску у хворих з ожирінням із застосуванням фіксованої комбінації препаратів, що блокують РААС, та верапамілу. Наведено аналіз ефективності та безпеки застосування сибутраміну для зниження ваги у хворих з високим артеріальним тиском.
Ключові слова:ожиріння, артеріальна гіпертонія, лікування.
ABSTRACT
Всіх analyzed the role of obesity in development of arterial hypertension and cardiovascular diseases, pathophysiological mechanisms of this relationship, and dominant role of rennin-angiotensin-aldosterone system (RAAS). Вона була впевнена, що фармакологічне виправлення високої глибини тиску в пацієнтів з небезпекою з фіксованими комбінаціями RAAS блоки і варіамілі є ефективним. Analysis ofeffectiveness and safety sibutramine for weight loss in patients with high blood pressure is presentd.
Key words: obesity, arterial hypertension, treatment.
Актуальність аналізованої теми обумовлена тим, що у світі останніми роками спостерігається значне збільшення кількості людей, мають ожиріння . Ожиріння в даний час розглядають як один із основних факторів, які сприяють розвитку захворювань, які є головними причинами у структурі смертності серед дорослого населення. Насамперед йдетьсяпро розвиток цукрового діабету 2 типу, а також серцево-судинних та онкологічних захворюваннях. Збільшення ваги на 1 кг збільшує ризик серцево-судинних захворювань на 3,1% та діабету – на 4,5-9%.
Відомо, що при ожирінні ризик розвитку артеріальної гіпертонії – фактора, який також значно впливає на появу таких серцево-судинних захворювань, як інфаркти та інсульти, збільшений утричі порівняно з людьми, які мають нормальну масу тіла. Як показано в дослідженні INTERSALT, на кожні 4,5 кг збільшення ваги систолічний артеріальний тиск (АТ) збільшується на 4,5 мм рт. ст. .
Ожиріння, як фактор ризику у жінок з артеріальною гіпертонією, особливо старшого віку, трапляється частіше, ніж у чоловіків. Однією з причин цього є гіпоестрогенія, що виникає під час постменопаузи. Відзначають деякі особливості поширеності ожиріння за різних типів артеріальної гіпертонії. Так, серед жінок похилого віку з ізольованою систолічною гіпертонією ожиріння зустрічається не так часто, і немає даних про вплив зниження ваги на цю категорію пацієнтів. У жінок з абдомінальним типом ожиріння, що мають систоло-діастолічні форми артеріальної гіпертонії, зниження ваги є. важливим моментому контролі захворювання.
При ожирінні виникає низка гемодинамічних змін, зокрема збільшення обсягу циркулюючої крові, ударного об'єму і серцевого викиду при відносно нормальному судинному опорі. Вважається, що високий артеріальний тиск у пацієнтів з ожирінням обумовлено, головним чином, збільшеним серцевим викидом при "неадекватно нормальному" периферичному опорі.
Такий гемодинамічний стан має стимулюючий вплив на дві антагоністичні регуляторні системи, що контролюють об'єм крові та периферичний опір- ренін-ангіотензин-альдостеронову систему (РААС) та систему натріуретичних пептидів серця. Їхня порушена регуляція може значною мірою пояснювати високий серцевий викид у повних пацієнтів з артеріальною гіпертонією. Більш того, ці серцево-судинні регуляторні системи беруть участь у метаболічних змінах, пов'язаних із надмірною масою тіла при серцево-судинних захворюваннях.
Отже, при ожирінні в патогенезі артеріальної гіпертонії відіграють істотну роль три основні механізми:
Патогенез розвитку артеріальної гіпертонії та серцево-судинних захворювань при ожирінні схематично наведено на малюнку 1.
Малюнок 1. Схема патогенезу артеріальної гіпертонії та серцево-судинних захворювань при ожирінні
Системна та тканинна ренін-ангіотензин-альдостеронова система та її зміни при ожирінні
До складу РААС входять ангіотензиноген, ренін, ангіотензин I, ангіотензин-перетворюючий фермент (АПФ) та ангіотензин II (АТ II). АТ II надає різноманітну дію різні клітини, мають специфічні рецептори.
Згідно з класичними уявленнями ангіотензиноген утворюється в печінці і під впливом реніну, синтезованого в навколоклубочкових клітинах нирок (юкстагломерулярних клітинах), ангіотензиноген перетворюється на крові в ангіотензин I. АПФ відповідальний за розщеплення АТ I, в результаті якого утворюється АТ II.
Важливо, що з ожирінні відбувається порушення механізмів регуляції роботи РААС . У фізіологічних умовах підвищення активності РААС призводить до підвищення опору периферичних судині, відповідно, до підвищення АТ. За принципом зворотного зв'язку підвищення артеріального тиску має викликати зниження секреції реніну, падіння рівня АТ II та зменшувати вміст альдостерону. Це, у свою чергу, знижує затримку рідини та натрію та підтримує АТ на нормальному рівні.
Однак у пацієнтів з вісцеральним ожирінням порушується регуляція рівня системних циркулюючих компонентів РААС. Незважаючи на підвищений АТ, затримку натрію та рідини, а також збільшення об'єму циркулюючої крові, активність реніну плазми та альдостерону залишається нормальною або навіть дещо підвищеною. Подібне порушення регуляції РААС при ожирінні може бути наслідком збільшення утворення компонентів РААС та/або вторинного зростання їхньої концентрації, обумовленого дефектами в системі натрійуретичних пептидів.
Було встановлено, що крім РААС крові існує тканинна або так звана локальна РААС, яка була виявлена в ряді тканин і органів, у тому числі мозку, серці, судинах, нирках, яєчках, жировій тканині та ін.
Як відомо, ключову роль в утворенні АТ II відіграють два фактори: активність реніну та концентрація ангіотензиногену. Синтез та секреція ангіотензиногену в клітинах різного типуяк визначає підвищення локальної концентрації АТ II, а й збільшує системну активність РААС. Хронічна інфузія АТ II мишам супроводжувалася істотним збільшенням вмісту мРНК ангіотензиногену в адипоцитах. Ці результати свідчать про наявність позитивного зворотного зв'язку між АТ II та ангіотензиногеном, коли збільшення рівня одного агента стимулює утворення другого. При ожирінні, особливо вісцерального типу, активність реніну в плазмі зберігається, як це вже зазначалося, на нормальному або дещо підвищеному рівні, а рівні ангіотензиногену та АТ II збільшені .
Структура та фізіологічні властивості жирової тканини
До складу жирової тканини входять клітини різного типу, у тому числі адипоцити, макрофаги, фібробласти, ендотеліальні клітини судин та преадипоцити (адипобласти). Останній вид клітин походить з поліпотентних стовбурових клітин мезодерми. З преадипоцитів у дорослому організмі людини утворюються нові диференційовані ("малі") адипоцити. Ці адипоцити збільшуються у розмірі ("великі" адипоцити) внаслідок підвищеного надходження з їжею жирних кислот. Довголанцюгові жирні кислоти потрапляють в адипоцити з крові та депонуються у вигляді нейтральних триацилгліцеринів. Жирова тканина відповідальна за зберігання та секрецію довголанцюгових жирних кислот, що виступають як один з основних енергетичних субстратів для багатьох органів і тканин, наприклад, для серцевої та скелетної мускулатури. "Великі" адипоцити секретують значно більше насичених жирних кислот. Гідроліз тригліцеридів та вивільнення жирних кислот відбуваються під впливом внутрішньоклітинної гормон-чутливої ліпази, активність якої контролюється катехоламінами (позитивна регуляція) та інсуліном (негативна регуляція).
Ендокринна активність жирової тканини
На відміну від підшкірного жиру, Який становить зазвичай 75% від усієї жирової тканини організму і є основним сховищем ліпідів, вісцеральний жир в даний час розглядають як активну гормонпродукцію тканину.
Адипоцити продукують широкий спектргормонів і цитокінів, що беруть участь у метаболізмі глюкози (адипонектин, резистин та ін), ліпідів (білок, що переносить ефіри холестерину), запаленні (ФНП-α, інтерлейкін-6), коагуляції (інгібітор активатора плазміногену-1), регуляція ангіотензиноген, АТ II), харчовій поведінці(лептин), а також впливають на метаболізм та функціональну активність різних органів та тканин, у тому числі м'язів, печінки, мозку та судин (див. таблицю).
Таблиця. Ендокринна функціяадипоцитів: адипоцитокіни
| Адіпоцитокіни | Ефекти адипоцитокінів |
| Лептін | Поглинання їжі, маса жиру |
| Адіпонектин | |
| Резистин | Резистентність до інсуліну, запалення |
| Вісфатин | Резистентність до інсуліну |
| Оментін | Резистентність до інсуліну |
| Серпін, що вивільняється з жирової вісцеральної тканини (Vaspin) | Резистентність до інсуліну |
| Апелін | Вазодилатація |
| Білок, який переносить ефіри холестерину (CETP) | Метаболізм ліпідів |
| Ліпопротеїнова ліпаза (LPL) | Метаболізм ліпідів |
| Гормончутлива ліпаза (HSL) | Метаболізм ліпідів |
| Білокзв'язуючий жирні кислоти в адипоцитах-4 (A-FABP-4 (aP2)) | Метаболізм ліпідів |
| Перліпін | Метаболізм ліпідів |
| Ренітол сполучний білок (RBP) | Метаболізм ліпідів |
| Білокстимулюючий ацилювання (ASP) | Метаболізм ліпідів |
| Ангіотензин II (AT II) | Артеріальний тиск |
| Ангіотензин-перетворюючий фермент (ACE) | Артеріальний тиск |
| Ангіотензиноген (AGT) | Артеріальний тиск |
| Чинник некрозу пухлини альфа (ФНП-а) | Запалення |
| Інтерлейкін, 6 (ІЛ-6) | Запалення |
| С-реактивний білок (CRP) | Запалення |
| Адіпоцит-трипсин/комплемент фактор D (Адіпсин) | Запалення |
| Хемоаттрактантний білок макрофагів-1 (МСР-1) | Атрактант для макрофагів |
| Міжклітинна адгезійна молекула-1 (ICAM-1) | Активація макрофагів |
| Інгібітор активатора плазміногену-1 (PAI-1) | Фібриноліз |
Важливо наголосити, що навіть невелике збільшення обсягу вісцерального жирувідіграє значну роль у порушеннях метаболізму, регуляції водноелектролітного балансу та серцево-судинних захворюваннях.
При збільшенні маси жирової тканини вміст практично всіх адипокінів у крові зростає. Виняток становить адипонектин, рівень якого у умовах падає . Лептин та адипонектин є найбільш вивченими адипокінами в даний час.
Лептін.Продукція лептину відбувається, головним чином, у "великих" адипоцитах. Лептин часто розглядається як сигнальна молекула, що здійснює взаємозв'язок між вмістом поживних речовин, що надходять в організм, станом жирової тканини і центральною нервовою системою (гіпоталамусом). Лептин збільшує окислення ліпідів у печінці, а також ліполіз в адипоцитах та скелетних м'язах. Інсулін стимулює утворення лептину. На рівень лептину також впливають вільні жирні кислоти, ФНП-α, естрогени та гормон росту.
Адіпонектин.Утворення адипонектину відбувається виключно в адипоцитах. Адипонектин виявляє різноманітні біологічні ефекти - виявляє антиатерогенну дію, збільшує чутливість клітин до інсуліну, пригнічує синтез глюкози в печінці, посилює її транспорт у м'язи, збільшує окислення жирних кислот. Рівень адипонектину знижується при ожирінні, резистентності до інсуліну та цукровому діабеті другого типу.
Жирова тканина та активність РААС
Виявилося, що жирова тканина посідає друге місце після печінки за утворенням ангіотензиногену. Наприклад, кількість мРНК ангіотензиногену в адипоцитах становить близько 70% рівня цього показника в печінці. Наявність взаємозв'язку між рівнем ангіотензиногену, ожирінням та артеріальною гіпертонією чітко продемонстровано в експериментах на моделі трансгенних мишей, що експресують надмірну кількість ангіотензиногену в жировій тканині. Ці миші мають вісцеральне ожиріння та гіпертонію. Преадипоцити та диференційовані жирові клітинимають повний набір компонентів, необхідний для локального синтезу АТ II, а також АТ 1 рецептор для АТ II, що забезпечує внутрішньоклітинну передачу активації сигналів, що запускаються АТ II . При ожирінні обсяг вісцеральних диференційованих адипоцитів збільшується у 20-30 разів. Ожиріння характеризується дисфункцією адипоцитів, під якою розуміють посилення освіти та секреції різних адипокінів, цитокінів, і навіть збільшення вмісту компонентів РААС, передусім, у вісцеральному жирі.
Підсумовуючи дані різних досліджень, можна констатувати, що при ожирінні відбувається підвищення активності РААС, що знаходить своє відображення у таких фактах:
Висока активністьРААС, своєю чергою, призводить до збільшення маси жирової тканини. Зокрема, трансгенні миші, що надмірно експресують ангіотензиноген тільки в жирових клітинах, демонстрували підвищення рівня ангіотензиногену в крові, розвиток гіпертонії та збільшення маси жирової тканини. Тканинний АТ II власне виконує функцію чинника зростання адипоцитів . АТ II внаслідок впливу на АТ 1 рецептори викликає збільшення білка цикліну D 1 , який бере участь у регуляції росту та поділу жирових клітин . Показано, що АТ II індукує проходження G 1 фази клітинного циклуу преадипоцитах людини. Цей ефект був пов'язаний із впливом на АТ 1 рецептори та подальшою активацією циклін D 1 -залежної кінази.
Встановлено, що АТ II викликає диференціювання преадипоцитів, активує ключові ферменти утворення ліпідів (ліпогенезу) та збільшує накопичення тригліцеридів в адипоцитах.
Вісцеральне ожиріння супроводжується збільшенням активності 11-бета-гідроксистероїд дегідрогенази типу 1, що призводить до утворення кортизолу, ключового гормону диференціювання преадипоцитів в адипоцити.
Активність тканинної РАС тісно пов'язана з продукцією адипокінів жировою тканиною. Показано, наприклад, що АТ II викликає експресію лептину в адипоцитах. Було висловлено припущення, що така активність властива тільки АТ II, що локально синтезується, на відміну від системного АТ II .
Ожиріння та активність симпатичної нервової системи
При ожирінні, особливо при його абдомінальному варіанті, дуже часто спостерігається активація симпатичної нервової системи. У дослідженні NAS (Normotesive Aging Study) було виявлено збільшення норадреналіну в сечі, пропорційне до індексу маси тіла. При зниженні ваги активність симпатичної нервової системи зменшується.
Підвищенню активності симпатичної нервової системи при ожирінні сприяє наявність гіперінсулінемії та інсулінорезистентності. Інсулін може підвищувати активність симпатоадреналової системи сам собою, але частково це може бути пов'язане з дією лептину. Відомо, що зі збільшенням ступеня ожиріння тощаковий рівень лептину, який секретується адипоцитами, зростає. Лептин збільшує активність симпатичної нервової системи, особливо у нирках. Це призводить, з одного боку, до високого викиду та збільшення частоти серцевих скорочень, а з іншого – до підвищення реабсорбції натрію та збільшення внутрішньосудинного об'єму крові.
Встановлено наявність взаємозв'язку між РААС та симпатичною нервовою системою. З активацією симпатичної нервової системи пов'язують посилення секреції реніну у нирках, і відбувається це незалежно від внутрішньониркової сенсорної системи, що регулює секрецію реніну нирками. Більш того, збільшення циклічного аденозинмонофосфату під впливом катехоламінів стимулює експресію ангіотензиногену в адипоцитах людини. Збільшення рівня АТ II посилює в людей активність симпатичної нервової системи. Встановлено, що АТ II активує локальну симпатичну нервову систему, що бере участь у підвищенні температури тіла (термогенезе). Холодова обробка призводить до збільшення вмісту АТ II у адипоцитах без супутньої зміни рівня АТ II у плазмі.
Таким чином, порушення регуляції РААС при ожирінні також здатне стимулювати активність симпатичної нервової системи.
Методи фармакологічної корекції підвищеного артеріального тиску при ожирінні
Внесок різних патогенетичних механізмів на підтримку високого АТ при ожирінні може бути різним. Отже, у цій ситуації сприятливу дію можуть надавати антигіпертензивні препарати з різними механізмами дії.
Відповідно до сучасних рекомендацій щодо лікування артеріальної гіпертонії запорукою успіху значущого зниження АТ є використання комбінованої терапії. Для пацієнтів з ожирінням насамперед основні компоненти такої терапії повинні містити комбінацію препаратів, що знижують активність РААС (ІАПФ та сартани), з препаратами, що знижують активність симпатичної нервової системи (β-адреноблокатори та недигідропіридинові антагоністи кальцію), та діуретиками. Висока ефективністьвикористання препаратів, що блокують РААС, при ожирінні показано в багатьох дослідженнях. З приводу використання β-адреноблокаторів дані дуже суперечливі, насамперед, взагалі у зв'язку з сумнівами в їх корисності для лікування пацієнтів з неускладненою артеріальною гіпертонією, по-друге, у зв'язку з тим, що β-адреноблокатори, принаймні класичні, можуть збільшувати вага пацієнтів та посилювати інсулінорезистентність. Отже, якщо і вибирати β-адреноблокатори для лікування пацієнтів з ожирінням або метаболічним синдромом, то це мають бути препарати, що мають особливі властивості, зокрема карведилол і небіволол.
У той же час встановлено, що недигідропіридиновий антагоніст кальцію верапаміл може не тільки значно знижувати АТ, але і зменшувати активність симпатичної нервової системи.
Таким чином, при ожирінні для лікування артеріальної гіпертонії можна скористатися комбінацією препаратів, що блокують РААС, та верапамілу.
Слід наголосити, що такого типу поєднання лікарських препаратівіснує у вигляді готової комбінованої лікарської форми- препарату Тарка, що містить у своєму складі жиророзчинний ІАПФ - трандолаприл та верапаміл повільного вивільнення (верапаміл СР). Такий підхід дуже важливий для проведення ефективної терапії, оскільки використання готових лікарських форм покращує прихильність пацієнтів до лікування.
Є дані, що свідчать про те, що препарат Тарка більшою мірою, ніж кожен з компонентів, що входять до нього, знижує АТ, має виражену здатність знижувати гіпертрофію лівого шлуночка, сприяє нормалізації ендотеліальної функції, є метаболічно нейтральним, навіть у пацієнтів з цукровим діабетом.
Подвійна дія- зниження активності РААС під впливом трандолаприлу та симпатичної нервової системи за рахунок верапамілу пролонгованої дії - забезпечують важливий вплив на патогенетичні механізмирозвитку артеріальної гіпертонії при ожирінні та механізми, що провокують ураження органів-мішеней при даному виді АГ.
Особливу увагу, обговорюючи лікування артеріальної гіпертензії при ожирінні, слід звернути на те, що терапія, заснована на комбінації трандалаприлу з верапамілом тривалої дії, дозволяє зменшити ризик розвитку цукрового діабету в порівнянні з використанням іншої тактики лікування - комбінації сартана з малою дозою тіазидного діуретика. Результати дослідження STAR чітко свідчать про те, що при застосуванні препарату Тарка протягом одного року у меншої кількості людей з метаболічним синдромом, при якому абдомінальному ожирінню надають чільне значення, розвивається цукровий діабет(рис. 2).
Рисунок 2. Розвиток нових випадків цукрового діабету (глюкоза натще > 126 мг/дл або 2-годинний рівень при проведенні глюкозотолерантного тесту > 200 мг/дл) залежно від типу антигіпертензивної терапії у осіб із метаболічним синдромом у дослідженні STAR

Крім того, за даними дослідження SТAR-LET, навіть при виникненні цукрового діабету на тлі лікарської терапіїпереведення цих пацієнтів на прийом препарату Тарка дозволило у половини пацієнтів нормалізувати вуглеводний обмін.
Результати цих досліджень змушують переглянути рекомендації щодо медикаментозної терапіїартеріальної гіпертонії в осіб з метаболічним синдромом і розпочинати терапію з комбінації, що містить ІАПФ (або сартан) та антагоніст кальцію, або перевести пацієнтів на подібну терапію.
Як уже неодноразово згадувалося, для лікування артеріальної гіпертонії зменшення ваги пацієнтів та ступеня абдомінального ожиріння відіграє важливу роль. Звичайно, зниження тим чи іншим способом маси тіла може значний вплив на зниження частоти серцево-судинних захворювань. В даний час існують різні підходи для медикаментозної терапії ожиріння. Перший – це симптоматичне лікування, А саме зменшення кількості споживаних калорій за рахунок зниження всмоктування жиру, що надходить з їжею. Такий підхід можна назвати компенсаторним. Дійсно, при такій терапії захворювання не усувається (оскільки пацієнт продовжує переїдати), а лише тимчасово компенсується препаратом. Інший підхід до лікування зайвої маси тіла та ожиріння – це усунення суті проблеми, а саме хронічного переїдання. Так діє сибутрамін (препарат Мерідіа). Він призводить до настання швидкого насичення, знижує кількість їжі за рахунок придушення зворотного захоплення норадреналіну і серотоніну в синапсах нейрональних ланцюгів. Сьогодні Меридіа – це єдиний оригінальний препарат, що усуває причину ожиріння.
Принциповою відмінністю сибутраміну є те, що, не викликаючи зниження апетиту, він сприяє більш ранньому настанню відчуття ситості. Людина позбавляється патологічної звички переїдати, результатом чого є поступове та стійке зниження маси тіла. Під впливом сибутраміну споживання їжі знижується приблизно на 20%. Поряд з цим сибутрамін опосередковано впливає на рівень біогенних амінів у крові, які активують адренорецептори жирової тканини та ініціюють ліполіз у адипоцитах, що супроводжується зміною вмісту енергетичних субстратів у крові. Сибутрамін за рахунок активації β2- та β3-адренорецепторів посилює процеси термогенезу та збільшує витрату енергії в організмі.
Клінічна ефективність та безпека сибутраміну (Меридія) були продемонстровані в велику кількістьбагатоцентрових досліджень. Зокрема, у дослідженні STORM (Sibutramine Trial on Obesity Reduction and Maintenance), до якого включили 605 пацієнтів з ожирінням, було показано, що дворічний прийом сибутраміну знижував вагу пацієнтів у 3 рази, а коло талії – у 2 рази більш виражене, ніж плацебо. . Важливо, що протягом двох років досягнуте зниження ваги підтримували 80% пацієнтів порівняно з 16% пацієнтів, які отримували плацебо (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов високої щільностіпідвищився на 21% при зниженні рівнів ліпопротеїдів низької щільності та тригліцеридів.
Позитивна дія зменшення ваги в лікуванні пацієнтів з артеріальною гіпертонією та іншими серцево-судинними захворюваннями може полягати також у тому, що зменшення внутрішньочеревного жиру може знизити механічне здавлення нирок, що може призвести до покращення їх кровопостачання та зниження активності РААС. Зменшення жирової тканини всередині та навколо нирок може призвести до зниження інтерстиціального тиску, компресії тонкої частини петлі Генлі, збільшення кровотоку у vasa recta, зниження канальцевої реабсорбції Na+ та води. Тим самим зниження ваги, зумовлене методами немедикаментозної чи медикаментозної корекції, може зменшувати висоту артеріального тиску.
Однак до останнього часу в реальній клінічній практицісибутрамін застосовували з обережністю, побоюючись його можливого негативного впливуна показники АТ та ЧСС, що, у свою чергу, могло призводити, хоч і у невеликої кількості пацієнтів, але до неприємних суб'єктивним відчуттям. Для вивчення впливу сибутраміну на серцево-судинну систему та докази безпеки препарату у групи пацієнтів з підвищеним ризиком серцево-судинних захворювань було ініційовано великомасштабне багатоцентрове подвійне сліпе плацебо контрольоване міжнародне дослідження SCOUT (Sibutramine Cardiovascular OUTcomes), де спостерігалися мали захворювання серцево-судинної системи, 88 - артеріальну гіпертонію та 84% - цукровий діабет 2 типу. За результатами першого етапу дослідження, що завершився, було встановлено, що призначення сибутраміну призвело до достовірного (р< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Виникає закономірне питання, як співвідноситиметься той чи інший вид антигіпертензивної терапії з лікуванням сибутраміном. Декілька досліджень було проведено для того, щоб отримати відповідь на це питання. Так, наприклад, було показано, що використання комбінованої лікарської форми, що містить верапаміл 180 мг/трандолаприл 2 мг у поєднанні з сибутраміном 10 мг, призводило протягом 6 місяців до більш вираженого зниження артеріального тиску, ніж проведення тільки антигіпертензивної терапії - систолічний АТ знизився, відповідно , на 21,9±8,1 проти 15,9±12,3 мм рт. ст. та діастолічний – на 15,7±8,1 проти 9,1±9,9 мм рт. ст. (P = 0,03). Комбінована терапія призводила до більш вираженого поліпшення антропометричних показників; достовірне (p<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
У проспективному, багатоцентровому, плацебо-контрольованому, подвійному сліпому дослідженні HOS (Hypertension-Obesity-Sibutramine) протягом 16 тижнів було проведено зіставлення різних режимів антигіпертензивної терапії (фелодипін 5 мг/раміприл 5 мг (n = 57), верапа трандолаприл 2 мг (n = 55), метопролол сукцинат 95 мг/гідрохлортіазид 12,5 мг n = 59) при призначенні сибутраміну та плацебо. У цьому дослідженні було підтверджено, що сибутрамін може підвищувати артеріальний тиск. Тому, звичайно, необхідно адекватне проведення антигіпертензивної терапії у період застосування сибутраміну у пацієнтів з артеріальною гіпертонією. Показано також, що при лікуванні комбінацією β-адреноблокатора та гідрохлортіазиду позитивні ефекти сибутраміну щодо зниження ваги, кола талії та впливу на метаболічний профіль були виражені істотно менше, ніж при поєднанні комбінованої терапії ІАПФ та антагоністами кальцію з сибутраміном. Це ще раз підтверджує необхідність ретельного вибору антигіпертензивної терапії у пацієнтів з ожирінням, особливо під час проведення програм, спрямованих на зниження ваги. І насамкінець слід зазначити, що з нашої точки зору однією із значних проблем, що знижують ефективність боротьби з ожирінням, є те, що ні лікарі, ні населення не розглядають ожиріння як значущий фактор ризику. Більше того, пацієнти часто не оцінюють себе як людей, які мають ожиріння. Наприклад, у дослідженні ПОЛОНЕЗ з оцінки лікарів, заснованої на обчисленні ІМТ, ожиріння і в чоловіків, і в жінок реєструвалося втричі частіше, ніж з самооцінки пацієнтів. Таким чином, повинна бути посилена та проводитися роз'яснювальна робота серед населення щодо необхідності попередження збільшення маси тіла, корекція наявного ожиріння та важливості постійної терапії артеріальної гіпертонії. ЛІТЕРАТУРА
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Prevalence and trends in obesity among US adults, 1999-2000. JAMA 2002; 288: 1723-7.
2. Pi-Sunyer F.X. Епідеміологія центральної глибокої розповсюдження в відношенні до disease. Nutr Rev 2004; 62 (7): 120-6.
3. Arbeeny C.M. Addressing unmet medical need for safe and effective weight loss therapies. Obes Res 2004; 12 (8): 1191-6.
4. Stamler J., Rose G., Stamler R., et al. INTERSALT study findings. Public health and medical care implications. Hypertension 1989; 14 (5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Excessive weight and hypertension in the elderly - the results of the community study. Arch Gerontol Geriatr 1991; 13 (1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et al. Зменшення в intra-abdominal visceral fat may reduce blood pressure in obese hypertensive women. Hypertension 1996; 27 (1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et al. American Heart Association; Obesity Committee of Council on Nutrition, Physical Activity, and Metabolism. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Disease from Obesity Committee of Council on Nutrition, Physical Activity. Circulation 2006; 113: 898-918.
8. Alpert M.A. Obesity cardiomyopathy; pathophysiology and evolution of clinical syndrome. Am J Med Sci 2001; 321: 225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hypertension і obesity. Recent Progr Horm Res 2004; 59: 169-205.
10. Engeli S., Sharma AM. Ренін-angiotensin система і натріуретичні пептіди в obesity-associated hypertension. J Mol Med 2001; 79: 21-9.
11. Lafontan M., Moro C., Sengenes C., et al. Несприйняті метаболічні ролі для наступних натріуретичних пептидів: керування ліполісією, ліпідною мобілізацією, і systemic nonesterified fatty acids levels in humans. Arterioscler Thromb Vasc Biol 2005; 25: 2032-42.
12. Hall J.E. Kidney, hypertension and obesity. Hypertension 2003; 41 (3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et al. ACE, angiotensinogen і obesity: a потенційна wayway leading to hypertension. J Hum Hypertens 1997; 11: 107-11.
14. Lu Н., Boustany-Kari C.M., Daugherty A., Cassis L.A. Ангіотензин II підвищує adipose angiotensinogen expresion. Am J Physiol Endocrinol Metab 2007; 292: 1280-7.
15. Engeli S., Negrel R., Sharma A.M. Фізиологія і патофісіологія adipose tissue renin-angiotensin system. Hypertension 2000; 35 (6): 1270-7.
16. Otto T.C., Lane M.D. Adipose development: від stem cell to adipocyte. Crit Rev Biochem Mol Biol 2005; 40: 229-42.
17. Hajer G.R., van Haeften TW, Visseren F.L.J. Пригнічений тиск dysfunction в obesity, diabetes, і vascular diseases. Eur Heart J 2008; 29: 2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A., et al. Adipokines and risk of type 2 diabetes in older men. Diabetes Core 2007; 30: 1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et al. Plasma insulin, leptin, і soluble TNF receptoirs рівнів у відношенні до obesity-related atherogenic and thrombogenic cardiovascular disease risk factors among men. Atheroslerosis 2001; 157: 495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Relationship між adipocyte size and adipokine expression and secretion. J Clin Endocrinol Metab 2007; 6 (92): 1023-33.
21. Ran J., Hirano T, Fukui T., et al. Angiotensin II infusion decreases plasma adiponektin level via its type 1 receptor in rats: an implication for hypertension related insulin resistance. Metabolism 2006; 55: 478-88.
22. Considine RV, Sinha MK, Heiman ML, et al. Serum імунореакційно-leptin концентрація в normal-weight і obese людини. N Engl J Med 1996; 334: 292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et al. Central nervous system control of food intake. Nature 2000; 404 (6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanocortin neurons є direct targets для leptrin в hypothalamus. Endocrinology 1997; 138; 4489-92.
25. Long Y.C., Zierath J.R. AMP-activated protein kinase signaling в metabolic regulation. J Clin Invest 2006; 116: 1776-83.
26. Saladin R. De Vos P. Guerre-Millo M. et al. Transient increase in obese gene expression після food intake or insulin administration. Nature 1995; 377: 527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Tumor necrosis factor-alpha exerts dual effects на huuman adipose leptin synthesis and release. Mol Cell Endocrinol 2000; 159: 79-88.
28. Lindsay RS, Funahashi T., Hanson RL, et al. Адіпонектін і розвиток типу 2 diabetes в Pima Indian population. Lancet 2002; 360: 57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek JK, et al. Низькі plasma рівні adiponectin є поєднані з низьким ризиком для майбутніх cardiovascular Events в пацієнтів з клінічним очевидним vascular disease. Am Heart J 2007; 154 (750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D., et al. Adipose angiotensinogen is involved in adipose tissue growth and blood pressure regulation. FASEB J 2001; 15: 2727-9.
31. Paul M., Mehr A.P., Kreutz R. Physiology of local renin-angiotensin systems. Physiol Rev 2006; 86: 747-803.
32. Karlsson C., Lindell K., Ottosson M., et al. Human adipose tissue expresses angiotensinogen і enzymes потрібні для його конвертації до angiotensin II. J Clin Endocrinol Metab 1998; 83: 3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Hormonal regulation of human adipose-tissue renin-angiotensin system: відносини до obesity і hypertension. J Hypertens 2002; 20: 965-73.
34. Engeli S., Gorzelniak K., Kreutz R., et al. Co-expression of renin-angiotensin system genes в human adipose tissue. J Hypertens 1999; 17: 555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., та інші. Renin receptor expression in human adipose tissue. Am J Physiol Regul Integr Comp Physiol 2007; 292: 274-82.
36. Сарзані Р., Саві Ф., Dessi-Fulgheri P., Rappelli A. Renin-angiotensin система, натрійні пиптиди, тяжкість, metabolic syndrome, і hypertension: integrated view in human. J Hypertens 2008; 26: 831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et al. Angiotensin II receptors in human preadipocytes: role in cell cycle regulation. Endocrinology 1999; 140: 154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G., et al. Angiotensin II як trophic factor white adipose tissue: stimulation of adipose cell formation. Endocrinology 2001; 142: 487-92.
39. Watanabe G., Lee RJ, Albanese C., et al. Angiotensin II activation cyclin D1-dependent kinase activity. J Biol Chem 1996; 271: 22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Differentiation of preadipose cells: paracrine role prostacyclin upon stimulation of adipose cells by angiotensin-II. Endocrinology 1994; 135: 2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotensin II збільшують ліпогенезіс в 3T3-L1 і людські adipose cells. Endocrinology 1997; 138: 1512-9.
42. Wake DJ, Walker B.R. Усунення 11beta-hydroxysteroid dehydrogenase type 1 in obesity. Endocrine 2006; 29: 101-8.
43. Engeli S., Bohnke J., Feldpausch M., et al. Regulation of 11beta-HSD генів в людській adipose tissue: influence of central obesity and weight loss. Obes Res 2004; 12: 9-17.
44. Kim S., Whelan J., Claycombe K., et al. Angiotensin II збільшує leptin secretion за 3T3-L1 і людськими освітами через простадландіно-незалежний механізм. J Nutr 2002; 132: 1135-40.
45. Cassis L.A., English V.L., Bharadwaj K., Boustany C.M. Різні ефекти місцевих versus systemic angiotensin II в регулюванні leptin release from adipocytes. Endocrinology 2004; 145: 169-74.
46. Mancia G., Bousquet P., Elghozi JL, et al. Симпатетична нервова система і metabolic syndrome. J Hypertens 2007; 25: 909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Sympathetic system activity в obesity and metabolic syndrome. Ann N Y Acad Sci 2006; 1083: 129-52.
48. Landsberg L., Troisi R., Parker D., et al. Obesity, blood pressure, і симпатична нервова система. Ann Epidemiol 1991; 1: 295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Human adipose angiotensinogen геном expression and secretion є стимульований cyclic AMP via increased DNA cyclic AMP responsive element binding activity. Endocrine 2004; 25: 97-104.
50. Cassis L.A. Роль angiotensin II в brown adipose thermogenesis при cold acclimation. Am J Physiol Endocrinol Metab 1993; 265: 860-5.
51. Cassis L.A., Dwoskin L.P. Presynaptic modulation neurotransmitter release by endogenous angiotensin II в brown adipose tissue. J Neural Transm 1991; 34: 129-37.
52. Reisin E., Weir M., Falkner B., et al. Lisinopril versus hydrochlorothiazide в обісі hypertensive пацієнтів: a multi-center placebo-controlled trial. Treatment in Obese Patients With Hypertension (TROPHY) Study Group. Hypertension 1997; 30 (1): 2140-5.
53. Neutel JM, Saunders E., Bakris G.L., et al. Діяльність і захист low-і high-dose fixed combinations of irbesartan/hydrochlorothiazide у пацієнтів з неконтрольованим systolic blood pressure on monotherapy: INCLUSIVE trial. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Бєлєнков Ю.М., Чазова І.Є., Мичка В.Б. від імені дослідницької групи "ЕКО". Багатоцентрове рандомізоване відкрите дослідження з вивчення ефективності зміни способу життя та терапії інгібіторами АПФ (квінаприлом) у хворих на ожиріння та артеріальну гіпертонію (ЕКЗ). Артеріальна гіпертензія 2003; 9 (6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Antihypertensive therapy and insulin sensitivity: Яким чином, щоб змінити роль бета-блокування agents? Am J Hypertens 1998; 11 (10): 1258-65.
56. Kaaja R. Kujala S. Manhem K. et al. Діяльність симптоматичної терапіі на інсуліну чутливість до інфекцій в hypertensive postmenopausal women. Int J Clin Pharmacol Ther 2007; 45 (7): 394-401.
57. Куперштейн R., Sasson Z. Діяльність антигіпертенсивної терапіі на glucose і insulin metabolism і на лівій вентрикулярній масі: randomized, double-blind, контрольована студія 21 obese hypertensives. Circulation 2000; 102 (15): 1802-6.
58. Halperin A.K., Cubeddu L.X. Роль calcium channel blockers в treatment of hypertension. Am Heart J 1986; 111 (2): 363-82.
59. McAllister R.G. Jr. Clinical pharmacology of slow channel blocking agents. Prog Cardiovasc Dis 1982; 25 (2): 83-102.
60. Binggeli C., Corti R., Sudano I., et al. Ефекти хронічного calcium channel blockade on sympathetic nerve activity in hypertension. Hypertension 2002; 39 (4): 892-6.
61. Lefrandt JD, Heitmann J., Sevre K., et al. Ефекти диhydropyridine і phenylalkylamine calcium antagonist classes на autonomical function in hypertension: the VAMPHYRE study. Am J Hypertens 2001; 14 (11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Compliance patterns patients treated with 2 separate antihypertensive agents versus fixed-dose combination therapy Am J Hypertens 2004; 175: 223.
63. Dezii C.M. A retrospective study of persistence with single-pill combination therapy vs. поточні два пилки терапія в пацієнтів з гіпертензією. Manag Care. 2000; 9 (9): 2-6.
64. Gerbino P.P., Shoheiber O. Adherence patterns серед пацієнтів treated with fixed-dose combination versus separate antihypertensive agents. Am J Health Syst Pharm 2007; 64 (12): 1279-83.
65. Jackson K. Відносність fixed versus free combination with valsartan and HCTZ for patients with hypertension. Value Health Suppl 2006; 9: 363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Cardiovascular effects of trandolapril/verapamil комбінація у пацієнтів з мілдою до модеративної тяжкої hypertension. Am J Cardiol 1997; 79 (6): 826-8.
67. Reynolds N.A., Wagstaff AJ, Keam SJ. Trandolapril/verapamil sustained release. Drugs 2005; 65 (13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Managing hypertension in diabetic patients - focus on trandolapril/verapamil combination. Vasc Health Risk Manag 2007; 3 (4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et al. Відмінності в glucose tolerance між fixed-dose antihypertensive drug combinations in people with metabolic syndrome. Diabetes Care 2006; 29 (12): 2592-7.
70. Bakris G., Molitch M., Чжу Q., et al. Відповідь про дисертаційно-асоційовану незрівнянну glucose tolerance і нову-онетову алергію: результати STAR-LET study. J Cardiometab Syndr 2008; 3 (1): 18-25.
71. Bailey CJ, Day C. Нові фармакологічні засоби до obesity. Obesity Practice 2005; 1: 2-5.
72. Yanovski S.Z., Yanovski J.A.Y. Obesity. N Engl J Med 2002; 346 (8): 591-602.
73. Day C., Bailey C.J. Sibutramine update. Br J Diabet Vasc Dis 2002; 2: 392-7.
74. James W.P., Astrup A., Finer N., et al. Діяльність сибутраміну на тривалість майновості після тривалої втрати: randomised trial. STORM Study Group. Sibutramine Trial of Obesity Reduction and Maintenance. Lancet 2000; 356: 2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W., et al. Кардіосакулярні відповіді на жорсткий менеджмент і сибутрамін в високому ризику: analysis from the SCOUT trial. Eur Heart J 2007; 28(23): 2915-23.
76. Sharma AM, Caterson I.D., Coutinho W., et al. Кількість pressure зміни, пов'язані з sibutramine and weight management - analysis from the 6-week lead-in period of sibutramine cardiovascular outcomes trial (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et al. Ефекти сибутраміну plus verapamil sustained release/trandolapril combination на blood pressure і metabolic variables в obese hypertensive patients. Expert Opin Pharmacother 2008; 9 (10): 1629-39.
78. Scholze J. Grimm E. Herrmann D. et al. Optimal treatment of obesity-related hypertension: the Hypertension-Obesity-Sibutramine (HOS) study. Circulation 2007; 115 (15): 1991-8.
79. Глезер М.Г. Результати російського дослідження ПОЛОНЕЗ (Ефективність і безпека енаренаЛу у пацієнтів з артеріальною гіпертензією). Терапевтичний архів 2006; 4: 44-50.
Для цитування:Леонова М.В. Нові та перспективні лікарські препарати, що блокують ренін-ангіотензин-альдостеронову систему // РМЗ. Медичний огляд. 2013. №17. С. 886
Роль ренін-ангіотензин-альдостеронової системи (РААС) у розвитку артеріальної гіпертонії (АГ) та інших серцево-судинних захворювань нині вважається чільною. У кардіоваскулярному континуумі артеріальна гіпертензія знаходиться серед факторів ризику, а головним патофізіологічним механізмом ураження серцево-судинної системи є ангіотензин II (АТII). АТII є ключовим компонентом РААС – ефектором, який реалізує вазоконстрикцію, затримку натрію, активацію симпатичної нервової системи, клітинну проліферацію та гіпертрофію, розвиток оксидативного стресу та процесів запалення судинної стінки.
В даний час вже отримали розвиток і широке клінічне застосування два класи препаратів, що блокують РААС, - інгібітори АПФ та блокатори АТII рецепторів. Фармакологічні та клінічні ефекти цих класів мають відмінності. АПФ є пептидазою з групи цинк-металопротеїназ, яка метаболізує АТІ, АТ1-7, брадикінін, субстанцію Р та багато інших пептидів. Механізм дії інгібіторів АПФ головним чином пов'язаний із запобіганням утворення АТII, що сприяє вазодилатації, натрійурезу та усуває прозапальний, проліферативний та інші ефекти АТII. Крім того, інгібітори АПФ перешкоджають деградації брадикініну та підвищують його рівень. Брадикінін – потужний вазодилататор, він потенціює натрійурез, а головне – має кардіопротективну (запобігає гіпертрофії, зменшує ішемічне пошкодження міокарда, покращує коронарне кровопостачання) та вазопротективну дію, покращуючи ендотеліальну функцію. Водночас високий рівень брадикініну – причина розвитку ангіоневротичного набряку, що є одним із серйозних недоліків інгібіторів АПФ, які значно підвищують рівень кінінів.
Інгібіторам АПФ не завжди вдається повністю блокувати утворення АТІІ у тканинах. В даний час встановлено, що в його перетворенні в тканинах можуть брати участь інші ферменти, не пов'язані з АПФ, насамперед ендопептидази, на які дія інгібіторів АПФ не поширюється. В результаті інгібітори АПФ не можуть повністю усунути ефекти АТІІ, що може бути причиною недостатньої ефективності.
Вирішенню цієї проблеми сприяло відкриття рецепторів АТІІ та першого класу препаратів, що селективно блокують АТ1-рецептори. Через АТ1-рецептори реалізуються несприятливі ефекти АТII: вазоконстрикція, секреція альдостерону, вазопресину, норадреналіну, затримка рідини, проліферація гладких клітин і кардіоміоцитів, активація САС, а також механізм негативного «зворотного зв'язку» - утворення реніну. АТ2-рецептори виконують «корисні» функції, такі як вазодилатація, процеси репарації та регенерації, антипроліферативна дія, диференціювання та розвиток ембріональних тканин. Клінічні ефекти блокаторів рецепторів АТІІ опосередковані через усунення «шкідливих» ефектів АТІІ на рівні АТ1-рецепторів, що забезпечує більш повне блокування несприятливих ефектів АТІІ та посилення впливу АТІІ на АТ2-рецептори, що доповнює вазодилатуючий та антипроліферативний ефекти. Блокатори рецепторів АТII мають специфічну дію на РААС, не втручаючись у кінінову систему. Відсутність впливу на активність кінінової системи, з одного боку, зменшує небажані ефекти (кашель, ангіоневротичний набряк), але, з іншого, позбавляє блокатори рецепторів АТII важливої антиішемічної та вазопротективної дії, що відрізняє їх від інгібіторів АПФ. Тому показання до застосування блокаторів рецепторів АТII в більшості повторюють показання до призначення інгібіторів АПФ, роблять їх альтернативними препаратами.
Незважаючи на впровадження блокаторів РААС у широку практику лікування АГ, проблеми покращення результатів та прогнозу залишаються. До них відносяться: можливість поліпшення контролю артеріального тиску в популяції, ефективність лікування резистентної артеріальної гіпертензії, можливості подальшого зниження ризику серцево-судинних захворювань.
Пошук нових шляхів на РААС активно триває; вивчаються інші тісно взаємодіючі системи та створюються препарати з множинним механізмом дії, такі як інгібітори АПФ та нейтральній ендопептидази (НЕП), інгібітори ендотелін-перетворюючого ферменту (ЕПФ) та НЕП, інгібітори АПФ/НЕП/ЕПФ.
Інгібітори вазопептидаз
До вазопептидаз крім відомого АПФ відносяться ще 2 інших цинк-металопротеїнази - неприлізин (нейтральна ендопептидаза, НЕП) і ендотелін-перетворюючий фермент, які також можуть бути мішенями для фармакологічного впливу.
Неприлізин - фермент, що виробляється ендотелією судин та бере участь у деградації натрійуретичного пептиду, а також брадикініну.
Система натрійуретичного пептиду представлена трьома різними ізоформами: передсердним натрій-уретичним пептидом (А-тип), мозковим натрійуретичним пептидом (В-тип), які синтезуються в передсерді та міокарді, та ендотеліальним С-пептидом, які за своїми біологічними та ендотеліну-1 (табл. 1) . Кардіоваскулярні та ренальні ефекти натрійуретичного пептиду полягають у зниженні АТ через вплив на судинний тонус та водноелектролітний баланс, а також в антипроліферативній та антифібротичній дії на органи-мішені. За останніми даними, система натрійуретичного пептиду бере участь у метаболічній регуляції: окисленні ліпідів, утворенні та диференціації адипоцитів, активації адипонектину, секреції інсуліну та толерантності до вуглеводів, що може забезпечувати захист від розвитку метаболічного синдрому.
Наразі стало відомо, що розвиток серцево-судинних захворювань асоціюється з дизрегуляцією системи натрійуретичного пептиду. Так, при АГ спостерігається дефіцит натрійуретичного пептиду, що призводить до солечутливості та порушення натрійурезу; при хронічній серцевій недостатності (ХСН) і натомість дефіциту спостерігається аномалія функціонування гормонів системи натрійуретичного пептиду.
Тому для потенціювання системи натрійуретичного пептиду з метою досягнення додаткового гіпотензивного та протективних кардіоренальних ефектів можливе застосування інгібіторів НЕП. Інгібування неприлізину призводить до потенціювання натрійуретичного, діуретичного та вазодилатуючого ефектів ендогенного натрійуретичного пептиду та в результаті – до зниження АТ. Однак НЕП бере участь у деградації та інших вазоактивних пептидів, зокрема АТІ, АТІІ та ендотеліну-1. Тому баланс ефектів на судинний тонус інгібіторів НЕП варіабельний і залежить від переважання констрикторних і дилатирующих впливів. При тривалому застосуванні антигіпертензивна дія інгібіторів неприлізину виражена слабко внаслідок компенсаторної активації утворення АТІІ та ендотеліну-1.
У зв'язку з цим поєднання ефектів інгібіторів АПФ та інгібіторів НЕП може суттєво потенціювати гемодинамічні та антипроліферативні ефекти в результаті комплементарного механізму дії, що призвело до створення препаратів з подвійним механізмом дії, об'єднаних назвою – інгібітори вазопептидаз (табл. 2, табл. 2).
Відомі інгібітори вазопептидаз характеризуються різним ступенем селективності до НЕП/АПФ: омапатрилат – 8,9:0,5; фазідоприлат – 5,1:9,8; сампатрілат - 8,0:1,2. В результаті інгібітори вазопептидаз отримали набагато більші можливості у досягненні гіпотензивного ефекту незалежно від активності РААС та рівня затримки натрію та в органопротекції (регрес гіпертрофії, альбумінурії, жорсткості судин). Найбільш вивченим у клінічних дослідженнях був омапатрилат, який показав більш високу гіпотензивну ефективність порівняно з інгібіторами АПФ, а у пацієнтів з ХСН призводив до збільшення фракції викиду та покращення клінічних результатів (дослідження IMPRESS, OVERTURE), але без переваг перед інгібіторами АПФ.
Однак у великих клінічних дослідженнях із застосуванням омапатрилату було встановлено більш високу частоту розвитку ангіоневротичного набряку порівняно з інгібіторами АПФ. Відомо, що частота розвитку ангіоневротичного набряку при використанні інгібіторів АПФ становить від 0,1 до 0,5% у популяції, з них 20% випадків є життєзагрозливими, що пов'язане з багаторазовим підвищенням концентрацій брадикініну та його метаболітів. Результати великого багатоцентрового дослідження OCTAVE (n=25302), яке було спеціально сплановано для вивчення частоти розвитку ангіоневротичного набряку, показало, що частота розвитку цього побічного ефекту на фоні лікування омапатрилатом перевищує таку в групі еналаприлу - 2,17% проти 0,68%. (Відносний ризик 3,4). Це пояснювалося посиленням впливу на рівень кінінів при синергічному пригніченні АПФ і НЕП, пов'язаним з пригніченням амінопептидази Р, що бере участь у деградації брадикініну.
Новий подвійний інгібітор вазопептидаз, що блокує АПФ/НЕП, - ілепатрил, який має більш високу афінність до АПФ порівняно з НЕП. При вивченні фармакодинамічних ефектів ілепатрилу за впливом на активність РААС та натрійуретичного пептиду у здорових добровольців було встановлено, що препарат дозозалежно (у дозах 5 та 25 мг) та значуще (більше 88%) пригнічує АПФ у плазмі крові тривалістю більше 4 . Одночасно препарат значно підвищував активність реніну плазми протягом 48 годин і зменшував рівень альдостерону. Ці результати показали виражене і більш тривале пригнічення РААС на відміну від інгібітора АПФ раміприлу в дозі 10 мг, що пояснювалося більш значущою тканинною дією ілепатрилу на АПФ і більшою афінністю до АПФ, і порівнянний ступінь блокади РААС 0 мг раміприлу. На відміну від дії на РААС, ефект ілепатрилу на натрійуретичний пептид виявлявся короткочасним збільшенням рівня його екскреції в період 4-8 годин після прийому дози 25 мг, що свідчить про меншу та слабку афінність до НЕП та відрізняє його від омапатрилату. Причому за рівнем екскреції електролітів додаткової натрійуретичної дії порівняно з раміприлом або ірбесартаном препарат не має, як втім, і інших інгібіторів вазопептидаз. Максимальна гіпотензивна дія розвивається через 6-12 годин після прийому препарату, і зниження середнього артеріального тиску становить 5±5 та 10±4 мм рт.ст. при низькій і високій солечутливості відповідно. За фармакокінетичними характеристиками ілепатрил є проліками з активним метаболітом, який швидко утворюється з досягненням максимальної концентрації через 1-1,5 год і повільно елімінує. В даний час проводяться клінічні дослідження ІІІ фази.
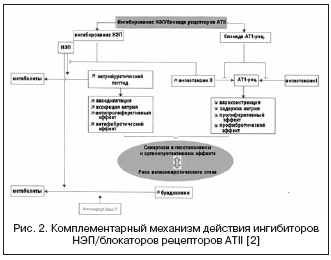
Альтернативний шлях до подвійного придушення РААС та НЕП представлений поєднанням блокади рецепторів АТII та НЕП (рис. 2). Блокатори рецепторів АТII не впливають на метаболізм кінінів, на відміну від інгібіторів АПФ, тому потенційно мають менший ризик розвитку ангіоневротичних ускладнень. В даний час проходить фазу III клінічних досліджень перший препарат – блокатор рецепторів АТІІ з ефектом інгібування НЕП у співвідношенні 1:1 – LCZ696. Об'єднана молекула препарату містить валсартан та інгібітор НЕП (AHU377) у формі проліків. У великому дослідженні у хворих з артеріальною гіпертензією (n=1328) препарат LCZ696 у дозах 200-400 мг показав перевагу в гіпотензивному ефекті перед валсартаном у дозах 160-320 мг у вигляді додаткового зниження АТ на 5/3 та 6/3 мм рт.ст. . . Гіпотензивний ефект LCZ696 супроводжувався більш вираженим зниженням пульсового АТ: на 2,25 та 3,32 мм рт.ст. відповідно в дозах 200 і 400 мг, що в даний час розглядається як позитивний прогностичний фактор впливу на жорсткість судинної стінки та серцево-судинні наслідки. При цьому вивчення нейрогуморальних біомаркерів на фоні лікування LCZ696 показало збільшення рівня натрійуретичного пептиду за порівнянним ступенем збільшення рівня реніну та альдостерону в порівнянні з валсартаном. Переносимість у хворих з артеріальною гіпертензією була хорошою, і випадків ангіоневротичного набряку не було відзначено. На даний час завершено дослідження PARAMOUMT у 685 пацієнтів з ХСН та непорушеною ФВ. Результати дослідження показали, що LCZ696 швидше і вираженіше знижує рівень NT-proBNP (первинна кінцева точка - маркер підвищення активності натрій-уретичного пептиду та несприятливого прогнозу при ХСН) у порівнянні з валсартаном, а також зменшує розміри лівого передсердя, що свідчить про рег . Дослідження у пацієнтів з ХСН та зниженою ФВ триває нині (дослідження PARADIGM-HF).
Інгібітори системи ендотеліну
Система ендотеліну відіграє важливу роль у регуляції судинного тонусу та регіонального кровотоку. Серед трьох відомих ізоформ ендотелін-1 є найактивнішим. Крім відомих вазоконстрикторних ефектів ендотелін стимулює проліферацію та синтез міжклітинного матриксу, а також внаслідок прямого впливу на тонус ниркових судин бере участь у регуляції водно-електролітного гомеостазу. Ефекти ендотеліну реалізуються через взаємодію зі специфічними рецепторами А-типу та В-типу, функції яких взаємопротилежні: через А-тип рецепторів відбувається вазоконстрикція, а через В-тип – вазодилатація. Останніми роками встановлено, що рецептори В-типу відіграють велику роль кліренсі эндотелина-1, тобто. при блокаді цих рецепторів порушується рецепторзалежний кліренс ендотеліну-1 і збільшується його концентрація. Крім того, рецептори В-типу беруть участь у регуляції ниркових ефектів ендотеліну-1 та підтримці водно-електролітного гомеостазу, що має важливе значення.
Нині роль ендотеліну доведено у розвитку низки захворювань, зокрема. АГ, ХСН, легеневої гіпертензії, хронічних захворювань нирок; показано тісний зв'язок між рівнем ендотеліну та метаболічним синдромом, дисфункцією ендотелію та атерогенезом. З 1990-х років. ведеться пошук антагоністів рецепторів ендотеліну, придатних для клінічного застосування; вже відомо 10 препаратів («сентани») з різним ступенем селективності до А/B-типу рецепторів. Перший неселективний антагоніст рецепторів ендотеліну – бозентан – у клінічному дослідженні у хворих з АГ показав гіпотензивну ефективність, порівнянну з такою інгібітором АПФ еналаприлу. Подальші дослідження ефективності застосування антагоністів ендотеліну при артеріальній гіпертензії показали їх клінічну значущість у лікуванні резистентної артеріальної гіпертензії та при високому серцево-судинному ризику. Ці дані були отримані у двох великих клінічних дослідженнях DORADO (n=379) та DORADO-АС (n=849), у яких пацієнтам з резистентною АГ додавався дарсентан до потрійної комбінованої терапії. У дослідженні DORADO у пацієнтів резистентна артеріальна гіпертензія поєднувалася з хронічною хворобою нирок і протеїнурією, в результаті додавання дарусентану спостерігалося не тільки значне зниження артеріального тиску, але й зменшення екскреції білка. Антипротеїнуричний ефект антагоністів рецепторів ендотеліну був у подальшому підтверджений у дослідженні у пацієнтів з діабетичною нефропатією при використанні авосентану. Однак у дослідженні DORADO-АС переваг у додатковому зниженні АТ перед препаратами порівняння та плацебо не було виявлено, що спричинило припинення подальших досліджень. Крім того, у 4 великих дослідженнях антагоністів ендотеліну (бозентану, дарусентану, енрасентану) у пацієнтів з ХСН були отримані суперечливі результати, що пояснювалося збільшенням концентрації ендотеліну-1. Подальше вивчення антагоністів рецепторів ендотеліну було припинено через небажані ефекти, пов'язані із затримкою рідини (периферичні набряки, перевантаження об'ємом). Розвиток цих ефектів пов'язують із впливом антагоністів ендотеліну на В-тип рецепторів, що змінило пошук препаратів, що впливають на систему ендотеліну через інші шляхи; а антагоністи рецепторів ендотеліну нині мають лише одне показання – лікування легеневої гіпертензії.
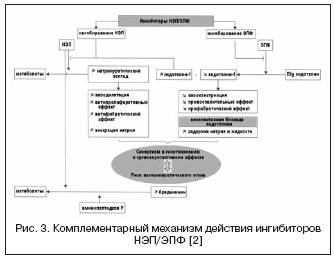
З урахуванням високої значущості системи ендотеліну у регуляції судинного тонусу ведеться пошук іншого механізму впливу через вазопептидазу – ЕПФ, що бере участь у освіті активного ендотеліну-1 (рис. 3). Блокування ЕПФ та поєднання з інгібуванням НЕП дозволяють ефективно пригнічувати утворення ендотеліну-1 та потенціювати ефекти натрій-уретичного пептиду. Переваги подвійного механізму дії полягають, з одного боку, у попередженні недоліків інгібіторів НЕП, пов'язаних з можливою вазоконстрикцією, опосередкованою активацією ендотеліну, з іншого, натрійуретична активність інгібіторів НЕП дозволяє компенсувати затримку рідини, пов'язану з неселективною блокад. Даглутрил є подвійним інгібітором НЕП та ЕПФ, який знаходиться у II фазі клінічних досліджень. У дослідженнях показані виражені кардіопротективні ефекти препарату завдяки зменшенню ремоделювання серця та судин, регресу гіпертрофії та фіброзу.
Прямі інгібітори реніну
Відомо, що інгібітори АПФ і блокатори АТII рецепторів за механізмом зворотного зв'язку підвищують активність реніну, що є причиною вислизання ефективності блокаторів РААС. Ренін є найпершим етапом каскаду РААС; він виробляється юкстагломерулярними клітинами нирок. Ренін через ангіотензиноген сприяє утворенню АТII, вазоконстрикції та секреції альдостерону, а також регулює механізми зворотного зв'язку. Тому інгібування реніну дозволяє досягти повнішої блокади системи РААС. Пошук інгібіторів реніна ведеться з 1970-х рр.; довгий час не вдавалося отримати пероральну форму інгібіторів реніну через їх низьку біодоступність в ШКТ (менше 2%). Перший прямий інгібітор реніну, придатний для перорального застосування – аліскірен – був зареєстрований у 2007 р. Аліскірен має низьку біодоступність (2,6%), великий період напіввиведення (24-40 год), позанирковий шлях елімінації. Фармакодинаміка аліскірену пов'язана з 80% зменшенням рівня АТІІ. У клінічних дослідженнях у пацієнтів з артеріальною гіпертензією аліскірен у дозах 150-300 мг/добу призводив до зниження САТ на 8,7-13 та 14,1-15,8 мм рт.ст. відповідно і ДАТ - на 7,8-10,3 та 10,3-12,3 мм рт.ст. . Гіпотензивний ефект аліскірену спостерігався у різних підгрупах пацієнтів, включаючи хворих з метаболічним синдромом, ожирінням; за виразністю він був порівнянний з ефектом інгібіторів АПФ, блокаторів рецепторів АТII, а також відзначений адитивний ефект у комбінації з валсартаном, гідрохлортіазидом та амлодипіном. У ряді клінічних досліджень були показані органопротективні ефекти препарату: антипротеїнуричний ефект у пацієнтів з діабетичною нефропатією (дослідження AVOID, n=599), регрес гіпертрофії лівого шлуночка у пацієнтів з артеріальною гіпертензією (дослідження ALLAY, n=465). Так, у дослідженні AVOID після 3-місячного лікування лозартаном у дозі 100 мг на добу та досягнення цільового рівня АТ (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Крім того, проводиться серія клінічних досліджень аліскірену при лікуванні інших серцево-судинних захворювань з оцінкою впливу на прогноз хворих: дослідження ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пацієнтів із ХСН, дослідження ALTITUDE у пацієнтів з цукровим діабетом та високим серцево-судинним ризиком, дослідження ASPIRE у пацієнтів з постінфарктним ремоделюванням.
Висновок
Для вирішення проблем попередження серцево-судинних захворювань продовжується створення нових лікарських препаратів зі складним множинним механізмом дії, що дозволяють забезпечувати повнішу блокаду РААС через каскад механізмів гемодинамічної та нейрогуморальної регуляції. Потенційні ефекти таких препаратів дозволяють не лише забезпечувати додатковий гіпотензивний ефект, але й досягати контролю рівня артеріального тиску у пацієнтів високого ризику, включаючи резистентну форму артеріальної гіпертензії. Лікарські препарати з множинним механізмом дії демонструють переваги у більш вираженій органопротективній дії, що дозволить запобігати подальшому ураженню серцево-судинної системи. Вивчення переваг нових препаратів, що блокують РААС, потребує подальших досліджень та оцінки їхнього впливу на прогноз хворих з АГ та іншими серцево-судинними захворюваннями.


Література
1. Campbell DJ. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. Нові процедури, процедури і пристрої для hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett JC, Rouleau J.L. та ін. Vasopeptidase inhibitors: як новий терапієтичний поняття в cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. та ін. Neutral endopeptidase inhibition і натріуретичний peptide system: evolving strategy in cardiovascular terapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. та ін. Comparison of vasopeptidase inhibitor, omapatrilat, і lisinopril на exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. та ін. Comparison of omapatrilat і enalapril у пацієнтів з хронічними нестерпними помилками: Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. та ін. Omapatrilat і enalapril у пацієнтів з hypertension:Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. та ін. Фармакокінетики і фармакодинаміки з vasopeptidase inhibitor AVE7688 в людях // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. та ін. Фармакокінетики і фармакодинаміки LCZ696, як гігієнічна дію angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. та ін. Bloodpressure reduction with LCZ696, novel duualacting inhibitor angiotensin II receptor and neprilysin: randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. та ін. Angiotensin receptor neprilysin inhibitor LCZ696 в серцевому значенні з обмеженою ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380 (9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. та ін. Роль endothelin-1 в клінічній hypertension: 20 років на // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper RJ, Lacourciere Y. et al. Ефект від ендотелін-рецептора антагоніста, Босентан, на крові pressure в пацієнтів з сильним hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. та ін. Селективний ендотелін-рецептор антагоніст до зменшення blood pressure в пацієнтів з зміною-резистентом hypertension: randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. та ін. Різні результати використання клініки і ambulatory blood pressures: report of darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann JF, Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. та ін. Ендотелінконverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J. Wuerzner G. Jensen C. et al. Angiotensin II suppression in humans the theorall active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin і cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren і дворазова терапія в type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503–2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (для ALLAY Investigators). Сприйняття альдостерон-медіат регресування лівої вентрікулярної hypertrophy в пацієнтів з hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly DJ, Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, є renoprotective в моделі з розширеною diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.


