الألدوستيرون في البشر هو الممثل الرئيسي لهرمونات القشرانيات المعدنية ومشتقات الكوليسترول.
توليف
يتم تنفيذه في المنطقة الكبيبية لقشرة الغدة الكظرية. يخضع البروجسترون، المتكون من الكوليسترول، لأكسدة متتابعة في طريقه إلى الألدوستيرون. 21-هيدروكسيلاز، 11-هيدروكسيلاز و18-هيدروكسيلاز. في نهاية المطاف، يتم تشكيل الألدوستيرون.

مخطط تخليق الهرمونات الستيرويدية (مخطط كامل)
تنظيم التوليف والإفراز
تفعيل:
- أنجيوتنسين الثاني، يتم إطلاقه عند تنشيط نظام الرينين أنجيوتنسين،
- زيادة التركيز أيونات البوتاسيومفي الدم (يرتبط بإزالة الاستقطاب الغشائي وفتح قنوات الكالسيوم وتنشيط محلقة الأدينيلات).
تفعيل نظام الرينين أنجيوتنسين
- لتفعيل هذا النظام هناك نقطتان للانطلاق:
- انخفاض في الضغطفي الشرايين الواردة من الكلى، والتي يتم تحديدها مستقبلات الضغطخلايا الجهاز المجاور للكبيبات. قد يكون السبب في ذلك أي انتهاك لتدفق الدم الكلوي - تصلب الشرايين الشرايين الكلوية، زيادة لزوجة الدم، الجفاف، فقدان الدم، الخ.
- انخفاض في تركيز أيونات Na +في البول الأولي في الأنابيب البعيدة للكلى، والذي يتم تحديده بواسطة المستقبلات التناضحية لخلايا الجهاز المجاور للكبيبات. يحدث نتيجة اتباع نظام غذائي خالي من الملح، مع استخدام مدرات البول على المدى الطويل.
يتم الحفاظ على إفراز الرينين (القاعدي) بشكل ثابت ومستقل عن تدفق الدم الكلوي عن طريق الجهاز العصبي الودي.
- عند تنفيذ إحدى نقطتي الخلية أو كلتيهما الجهاز المجاور للكبيباتيتم تنشيطها ومنها يتم إفراز الإنزيم في بلازما الدم الرينين.
- بالنسبة للرينين، يوجد في البلازما ركيزة - بروتين من جزء α2-الجلوبيولين أنجيوتنسينوجين. نتيجة للتحلل البروتيني، يتم استدعاء ديكاببتيد أنجيوتنسين آي. بعد ذلك، أنجيوتنسين الأول مع المشاركة الأنجيوتنسين المحول للإنزيم(APF) يتحول إلى أنجيوتنسين الثاني.
- الأهداف الرئيسية للأنجيوتنسين II هي الخلايا العضلية الملساء الأوعية الدمويةو القشرة الكبيبية للمنطقةالغدد الكظرية:
- تحفيز الأوعية الدموية يسبب تشنجها وترميمها ضغط الدم.
- تفرز من الغدد الكظرية بعد التحفيز الألدوستيرون، يعمل على الأنابيب البعيدة من الكلى.
عندما يعمل الألدوستيرون على الأنابيب الكلوية، يزداد معدل إعادة الامتصاص أيونات الصوديوم+يتبع الصوديوم ماء. ونتيجة لذلك، يتم استعادة الضغط في الدورة الدموية ويزيد تركيز أيونات الصوديوم في بلازما الدم، وبالتالي في البول الأولي، مما يقلل من نشاط RAAS.

تفعيل نظام الرينين أنجيوتنسين-الألدوستيرون
آلية العمل
عصاري خلوي.
الأهداف والآثار
يؤثر الغدد اللعابيةعلى الأنابيب البعيدة والقنوات الجامعة في الكلى. يقوي في الكلى إعادة امتصاص أيونات الصوديوموفقدان أيونات البوتاسيوم من خلال التأثيرات التالية:
- يزيد من كمية Na + ,K + -ATPase بمقدار غشاء الطابق السفليالخلايا الظهارية،
- يحفز تخليق بروتينات الميتوكوندريا وزيادة كمية الطاقة المتولدة في الخلية لعمل Na + ,K + -ATPase،
- يحفز تكوين قنوات Na على الغشاء القمي للخلايا الظهارية الكلوية.
علم الأمراض
فرط الوظيفة
متلازمة كون (الألدوستيرونية الأولية) – يحدث مع الأورام الغدية في المنطقة الكبيبية. ويتميز بثلاثة أعراض: ارتفاع ضغط الدم، فرط صوديوم الدم، القلاء.
ثانويفرط الألدوستيرونية - تضخم وفرط وظيفة الخلايا المجاورة للكبيبات والإفراز المفرط للرينين والأنجيوتنسين II. هناك زيادة في ضغط الدم وظهور الوذمة.
نظام الرينين-أنجيوتنسين-الألدوستيرون عبارة عن مجموعة معقدة من الإنزيمات والهرمونات التي تحافظ على التوازن. ينظم توازن الأملاح والماء في الجسم ومستويات ضغط الدم.
آلية العمل
تنشأ فسيولوجيا نظام الرينين أنجيوتنسين-الألدوستيرون على حدود القشرة وحيث توجد خلايا مجاورة للكبيبات تنتج الببتيداز (الإنزيم) - الرينين.
الرينين هو هرمون والرابط الأولي لـ RAAS.
الحالات التي يتم فيها إطلاق الرينين في الدم
هناك عدة حالات يدخل فيها الهرمون إلى مجرى الدم:
- انخفاض تدفق الدم في أنسجة الكلى - أثناء العمليات الالتهابية (التهاب كبيبات الكلى، وما إلى ذلك)، مع اعتلال الكلية السكريأورام الكلى.
- انخفاض (مع النزيف والقيء المتكرر والإسهال والحروق).
- انخفاض مستويات ضغط الدم. تحتوي شرايين الكلى على مستقبلات الضغط التي تستجيب للتغيرات في الضغط النظامي.
- التغير في تركيز أيون الصوديوم. توجد في جسم الإنسان مجموعات من الخلايا تستجيب للتغيرات في التركيب الأيوني للدم عن طريق تحفيز إنتاج الرينين. يتم فقدان الملح عندما التعرق الغزيروكذلك مع القيء.
- التوتر، والضغط النفسي والعاطفي. يتم تعصيب الكلى عن طريق الأعصاب الودية، والتي يتم تنشيطها عن طريق التأثيرات النفسية السلبية.
في الدم، يلتقي الرينين مع بروتين أنجيوتنسين، الذي تنتجه خلايا الكبد ويأخذ جزءًا منه. يتم تكوين أنجيوتنسين I، وهو مصدر عمل الإنزيم المحول للأنجيوتنسين (ACE). والنتيجة هي أنجيوتنسين 2، الذي يعمل بمثابة الرابط الثاني وهو مضيق قوي للأوعية النظام الشرياني(يضيق الأوعية الدموية).
آثار أنجيوتنسين الثاني
الهدف: الزيادة الضغط الشرياني.
- يعزز تخليق الألدوستيرون في المنطقة الكبيبية لقشرة الغدة الكظرية.
- فهو يؤثر على مركز الجوع والعطش في الدماغ، فيسبب شهية “الملح”. ويصبح سلوك الإنسان دافعاً للبحث عن الماء والطعام المالح.
- يؤثر الأعصاب الودية، يعزز إطلاق النورإبينفرين، وهو أيضًا مضيق للأوعية، ولكنه أقل ضعفًا في العمل.
- يؤثر على الأوعية الدموية، مما يسبب تشنجها.
- يشارك في تطور قصور القلب المزمن: يعزز تكاثر وتليف الأوعية الدموية وعضلة القلب.
- يقلل
- يمنع إنتاج البراديكينين.

الألدوستيرون هو المكون الثالث الذي يعمل على الأنابيب الطرفية للكلى ويعزز إطلاق أيونات البوتاسيوم والمغنيسيوم من الجسم وإعادة امتصاص (إعادة امتصاص) الصوديوم والكلور والماء. ونتيجة لهذا، يزداد حجم السائل المنتشر، ويرتفع ضغط الدم، ويزداد تدفق الدم الكلوي. توجد مستقبلات الألدوستيرون ليس فقط في الكلى، ولكن أيضًا في القلب والأوعية الدموية.
عندما يصل الجسم إلى التوازن، يبدأ إنتاج موسعات الأوعية الدموية (المواد التي تمدد الأوعية الدموية) - البراديكينين والكاليدين. ويتم تدمير مكونات RAAS في الكبد.
رسم تخطيطي لنظام الرينين أنجيوتنسين-الألدوستيرون

مثل أي نظام، يمكن أن يفشل RAAS. تتجلى الفيزيولوجيا المرضية لنظام الرينين أنجيوتنسين-الألدوستيرون في الحالات التالية:
- تلف قشرة الغدة الكظرية (العدوى والنزيف والصدمات). تتطور حالة نقص الألدوستيرون، ويبدأ الجسم بفقد الصوديوم والكلور والماء، مما يؤدي إلى انخفاض حجم السائل في الدورة الدموية وانخفاض ضغط الدم. يتم تعويض الشرط عن طريق إدخال المحاليل الملحيةومحفزات مستقبلات الألدوستيرون.
- يؤدي وجود ورم في قشرة الغدة الكظرية إلى زيادة هرمون الألدوستيرون، مما يؤدي إلى تأثيره ويؤدي إلى ارتفاع ضغط الدم. كما يتم تنشيط عمليات انقسام الخلايا، ويحدث تضخم وتليف عضلة القلب، ويتطور فشل القلب.
- أمراض الكبد، عندما يتعطل تدمير الألدوستيرون ويحدث تراكمه. يتم علاج المرض باستخدام حاصرات مستقبلات الألدوستيرون.
- أمراض الكلى الالتهابية.

أهمية RAAS للحياة والطب
نظام الرينين-أنجيوتنسين-الألدوستيرون ودوره في الجسم:
- يقبل المشاركة الفعالةفي الحفاظ على ضغط الدم الطبيعي.
- يضمن توازن الماء والأملاح في الجسم؛
- يحافظ على التوازن الحمضي القاعدي في الدم.
قد يفشل النظام. ومن خلال التأثير على مكوناته يمكنك محاربة ارتفاع ضغط الدم. ترتبط آلية ارتفاع ضغط الدم الكلوي أيضًا ارتباطًا وثيقًا بـ RAAS.
مجموعات فعالة للغاية من الأدوية التي تم تصنيعها من خلال دراسة RAAS
- "بريلي". APF. أنجيوتنسين I لا يتحول إلى أنجيوتنسين II. لا يوجد انقباض للأوعية الدموية - لا زيادة في ضغط الدم. الأدوية: أمبريلان، إنالابريل، كابتوبريل، إلخ. تعمل مثبطات الإنزيم المحول للأنجيوتنسين على تحسين نوعية حياة مرضى السكري بشكل كبير، مما يضمن الوقاية من الفشل الكلوي. يتم تناول الأدوية بجرعة بسيطة، والتي لا تسبب انخفاضًا في الضغط، ولكنها تعمل فقط على تحسين تدفق الدم المحلي والترشيح الكبيبي. أدوية الفشل الكلوي لا غنى عنها مرض مزمنالقلب وتكون بمثابة إحدى وسائل علاج ارتفاع ضغط الدم (إذا لم تكن هناك موانع).
- "السارتان". حاصرات مستقبلات الأنجيوتنسين II. الأوعية لا تتفاعل معها ولا تنقبض. الأدوية: اللوسارتان، الإبروسارتان، إلخ.

عكس نظام الرينين-أنجيوتنسين-الألدوستيرون هو نظام الكينين. لذلك، يؤدي حظر RAAS إلى زيادة مكونات نظام الكينين (براديكينين، وما إلى ذلك) في الدم، مما له تأثير مفيد على أنسجة القلب وجدران الأوعية الدموية. لا تعاني عضلة القلب من المجاعة، لأن البراديكينين يزيد من تدفق الدم المحلي ويحفز إنتاج موسعات الأوعية الدموية الطبيعية في خلايا النخاع الكلوي والخلايا الصغيرة في قنوات التجميع - البروستاجلاندين E و I2. أنها تحييد تأثير الضغط للأنجيوتنسين II. لا يتم تشنج الأوعية الدموية، مما يضمن وصول الدم الكافي إلى أعضاء وأنسجة الجسم، ولا يتم الاحتفاظ بالدم وتقليل تكوين لويحات تصلب الشرايين والجلطات الدموية. الكينين له تأثير مفيد على الكلى ويزيد من إدرار البول (إنتاج البول اليومي).
رينين
– إنزيم يتم تصنيعه بواسطة الخلايا المجاورة للكبيبات من الشرينات الكلوية الواردة، مع قدرة تبلغ حوالي 40 كيلو دالتون. يحدث تكوين الرينين بشكل مكثف بشكل خاص أثناء نقص تروية الكلى. موقع الخلايا المجاورة للكبيبات يجعلها حساسة بشكل خاص للتغيرات في ضغط الدم، فضلا عن تركيز أيونات Na + و K + في السائل الذي يتدفق عبر الأنابيب الكلوية. بسبب هذه الخصائص، فإن أي مجموعة من العوامل تسبب انخفاضًا في حجم السوائل (الجفاف، انخفاض ضغط الدم، فقدان الدم، إلخ) أو نقصانه. تركيز كلوريد الصوديوميحفز إفراز الرينين.
وفي الوقت نفسه، تعمل معظم منظمات تخليق الرينين مستقبلات الضغط الكلوية.يتأثر إطلاق الرينين بحالة الجهاز العصبي المركزي، فضلاً عن التغيرات في وضع الجسم في الفضاء. على وجه الخصوص، عند الانتقال من وضعية الاستلقاء إلى وضعية الجلوس أو الوقوف (اختبار كلينوستاتيك)، يزداد إفراز الرينين. يحدث رد الفعل المنعكس هذا بسبب زيادة نبرة الجزء المتعاطف من الجهاز اللاإرادي الجهاز العصبي، ينقل النبضات إلى المستقبلات الأدرينالية ب للخلايا المجاورة للكبيبات.
الركيزة الرئيسية التي تتأثر بالرينين هي أنجيوتنسينوجين– بروتين يدخل في جزء من الجلوبيولين 2 وينتجه الكبد. تحت تأثير الجلايكورتيكويدات والإستروجين، يزداد تخليق الأنجيوتنسين بشكل ملحوظ. نتيجة لعمل الرينين، يتحول مولد الأنجيوتنسين إلى ديكاببتيد أنجيوتنسينأنا.وهذا المركب له تأثير ضعيف للغاية وليس له تأثير كبير على مستويات ضغط الدم.
في أثناء أنجيوتنسينأناتحت تأثير ما يسمى الإنزيم المحول للأنجيوتنسين (ACE)يتحول إلى عامل مضيق للأوعية قوي - أنجيوتنسينثانيا. APF(ثنائي الببتيد كربوكسي ببتيداز) هو بروتين متكامل يقع بشكل أساسي على غشاء الخلايا البطانية، والظهارة، والخلايا وحيدة النواة، والنهايات العصبية، وخلايا الأعضاء التناسلية، وما إلى ذلك. الشكل القابل للذوبان من الإنزيم المحول للأنجيوتنسين موجود في جميع سوائل الجسم تقريبًا.
من المعتاد التمييز بين شكلين إسويين من ACE. حصل أولهم على الاسم التقليدي "الجسدي". يحتوي هذا الشكل الإسوي على MW تبلغ 170 كيلو دالتون ويتضمن نطاقات C و N متماثلة. تم العثور على الشكل الثاني من ACE ("التكاثري") في السائل المنوي، وله MW حوالي 100 كيلو دالتون ويتوافق مع المجال C للشكل الإسوي الأول من ACE. يحتوي كل مجال من النطاقين المشار إليهما على بقايا الأحماض الأمينية التي يمكن أن تشارك في تكوين رابطة مع ذرة الزنك. تعد هذه الهياكل Zn 2+ نموذجية للعديد من البروتينات المعدنية وهي المواقع الرئيسية لتفاعل الإنزيم مع كل من الركيزة ومثبطات الإنزيم المحول للأنجيوتنسين.
تجدر الإشارة إلى أن ACE لا يؤدي فقط إلى التكوين أنجيوتنسين الثاني،ولكن يدمر أيضا البراديكينين –اتصال التوسع الأوعية الدموية. ولذلك، فإن الزيادة في ضغط الدم عند التعرض للإنزيم المحول للأنجيوتنسين ترتبط بكل من تكوين الأنجيوتنسين II وانهيار البراديكينين (الشكل 32).
يلعب التركيب الأيوني دورًا مهمًا لعمل ACE، وعلى وجه الخصوص، محتوى أيونات الكلور. وهكذا، عند تركيزات عالية من الكلور، يقوم المجال C من ACE بتحليل كل من البراديكينين والأنجيوتنسين I بشكل أسرع من المجال N. في المناطق خارج الخلية، حيث يكون تركيز أنيونات الكلوريد مرتفعًا، يكون المجال N مسؤولًا بشكل أساسي عن تحويل الأنجيوتنسين-I. ومع ذلك، داخل الخلايا، حيث يكون تركيز Cl منخفضًا، يمكن أن يشارك المجال N في التحلل المائي للمواد الببتيدية الأخرى.
خلف السنوات الاخيرةلقد ثبت أن الإنزيم المحول للأنجيوتنسين يلعب دورًا مهمًا في تكون الدم، لأنه تحت تأثيره يتم تكوين الببتيد المكونة للدم، تثبيط تكوين الخلايا المكونة للدم في نخاع العظام.
تم الكشف عن دور الإنزيم المحول للأنجيوتنسين في الجسم لدى الفئران التي تفتقر إلى جين الإنزيم المحول للأنجيوتنسين. أظهرت هذه الحيوانات انخفاضًا في ضغط الدم، واختلالات مختلفة في الأوعية الدموية، واختلالًا في بنية ووظيفة الكلى، والعقم عند الذكور.
أنجيوتنسينثانيا
يزيد من ضغط الدم عن طريق التسبب في انقباض الشرايين وهو أقوى عامل فعال في الأوعية الدموية. بالإضافة إلى ذلك، من خلال آلية التغذية المرتدة، فإنه يمنع تكوين وإطلاق الرينين بواسطة الخلايا المجاورة للكبيبات في الكلى، والتي ينبغي في النهاية استعادة مستويات ضغط الدم الطبيعية. تحت النفوذ أنجيوتنسينثانياإنتاج القشرانيات المعدنية الرئيسية يزيد بشكل حاد - الألدوستيرون.على الرغم من أن هذا الإجراء مباشر، إلا أن الأنجيوتنسين 2 لا يؤثر على إنتاج الكورتيزول. الغرض الرئيسي من الألدوستيرون هو الاحتفاظ بـ Na + (من خلال تعزيز إعادة امتصاصه في الأنابيب الكلوية) وإطلاق K + و H + (بشكل رئيسي من خلال الكلى). يتم تنفيذ ردود الفعل هذه على النحو التالي.
الألدوستيرون
يخترق السائل خارج الخلية إلى السيتوبلازم في الخلية ويتصل هناك بمستقبل معين، وبعد ذلك يخترق المركب الناتج (مستقبل الألدوستيرون +) النواة. يحفز الألدوستيرون أيضًا فتح قنوات Na+، مما يسمح لأيونات Na+ بدخول الخلية عبر الغشاء القمي من تجويف النبيب.
ترجع الزيادة في إفراز K + تحت تأثير الألدوستيرون إلى زيادة نفاذية الغشاء القمي بالنسبة لهذه الأيونات، مما يؤدي إلى دخول K + إلى تجويف النبيب من الخلية.
يساهم احتباس Na+ في الجسم، مثل الأنجيوتنسين II، في زيادة ضغط الدم.
أنجيوتنسينثانياقادر على الارتباط بمستقبلات معينة من الخلايا الكبيبية للغدة الكظرية. يعتمد محتوى هذه المستقبلات إلى حد كبير على تركيز أيونات K +. وبالتالي، إذا زاد مستوى K +، فإن عدد مستقبلات الأنجيوتنسين II في الخلايا الكبيبية يزداد. عندما ينخفض تركيز أيونات K +، لوحظ التأثير المعاكس. ولذلك، تلعب أيونات K + دورًا رئيسيًا في عمل الأنجيوتنسين II على الغدد الكظرية.
خلف مؤخراقررت ذلك أنجيوتنسينثانياقادر على تنشيط البلاعم، وبالتالي زيادة تراكم الصفائح الدموية وتسريع تخثر الدم. وفي نفس الوقت يتم تحريره المانع المنشط البلازمينوجين-أنا (IAP-1)،والتي قد تكون مصحوبة باكتئاب انحلال الفيبرين. أ نجيوتنسينثانياهو أحد العوامل التي تساهم في تطور تصلب الشرايين، وتثبيط موت الخلايا المبرمج وزيادة الإجهاد التأكسدي في الأنسجة، مما يؤدي إلى تراكم الصفائح الدموية وتكوين الخثرة.
أنجيوتنسينثانياقادر على تعزيز وظيفة عضلة القلب، ويشارك في التخليق الحيوي للنورادرينالين وغيرها من المواد الفعالة من الناحية الفسيولوجية. وفي الوقت نفسه، يمكن أن يكون بمثابة عامل نمو، مما يؤدي إلى تضخم الأوعية الدموية والقلب.
في بعض الحيوانات وفي البشر أنجيوتنسينثانياتحت تأثير الانزيم أمينوببتيدازيتحول إلى سباعي الببتيد أنجيوتنسينثالثا.في البشر، يكون مستوى الأنجيوتنسين II أعلى بحوالي 4 مرات من مستوى الأنجيوتنسين III. يؤثر كلا هذين المركبين على ضغط الدم وإنتاج الألدوستيرون ويتم تفكيكهما بسرعة كبيرة بواسطة الإنزيمات أنجيوتنسيناز.
في أمراض الكلى الحادة المصحوبة بنقص التروية، بسبب زيادة تكوين وإفراز الرينين، لوحظ زيادة مستمرة في ضغط الدم ( ارتفاع ضغط الدم الكلوي). يؤدي استخدام مثبطات الإنزيم المحول للأنجيوتنسين في هذه الظروف إلى التطبيع السريع لضغط الدم.
في الختام، يجب التأكيد مرة أخرى على أن نظام أنجيوتنسين-رينين-الألدوستيرون يرتبط ارتباطًا وثيقًا بوظيفة نظام كاليكريين-كينين، حيث يتم تكوين الأنجيوتنسين II وتدمير البراديكينين تحت تأثير نفس الشيء. انزيم - ACE.
Catad_theme ارتفاع ضغط الدم الشرياني- مقالات
Catad_tema السمنة - مقالات
السمنة وارتفاع ضغط الدم الشرياني
نشرت في المجلة:مشاكل صحة المرأة العدد 4، المجلد 3، 2008
E. I. أستاشكين، إم جي جليزر
أكاديمية موسكو الطبية سميت باسم. آي إم سيشينوفا
ملخص
تحلل المراجعة دور السمنة في تطور ارتفاع ضغط الدم الشرياني و أمراض القلب والأوعية الدمويةوالآليات الفيزيولوجية المرضية لهذا الصدد، والدور المهيمن لنظام الرينين أنجيوتنسين-الألدوستيرون (RAAS). تمت مناقشة قضايا التصحيح الدوائي لارتفاع ضغط الدم لدى المرضى الذين يعانون من السمنة المفرطة باستخدام مجموعة ثابتة من الأدوية التي تمنع RAAS والفيراباميل. يتم تقديم تحليل لفعالية وسلامة استخدام سيبوترامين لفقدان الوزن لدى المرضى الذين يعانون من ارتفاع ضغط الدم.
الكلمات الدالة:السمنة، ارتفاع ضغط الدم الشرياني، العلاج.
خلاصة
قام الباحثون بتحليل دور السمنة في تطور ارتفاع ضغط الدم الشرياني وأمراض القلب والأوعية الدموية، والآليات الفيزيولوجية المرضية لهذه العلاقة، والدور المهيمن لنظام الرينين أنجيوتنسين-الألدوستيرون (RAAS). وقد تبين أن التصحيح الدوائي لارتفاع ضغط الدم لدى المرضى الذين يعانون من السمنة مع مزيج ثابت من حاصرات RAAS والفيراباميل فعال. يتم تقديم تحليل فعالية وسلامة سيبوترامين لفقدان الوزن لدى المرضى الذين يعانون من ارتفاع ضغط الدم.
الكلمات الدالة:السمنة، ارتفاع ضغط الدم الشرياني، العلاج.
ترجع أهمية الموضوع قيد النظر إلى حقيقة أنه في جميع أنحاء العالم حدثت في السنوات الأخيرة زيادة كبيرة في عدد الأشخاص الذين يعانون من السمنة المفرطة. تعتبر السمنة حاليًا أحد العوامل الرئيسية التي تساهم في تطور الأمراض التي تعد الأسباب الرئيسية للوفيات بين البالغين. أولاً نحن نتحدث عنحول تطور مرض السكري من النوع 2، وكذلك القلب والأوعية الدموية و أمراض الأورام. وزيادة الوزن بمقدار 1 كجم تزيد من خطر الإصابة بأمراض القلب والأوعية الدموية بنسبة 3.1% والسكري بنسبة 4.5-9%.
ومن المعروف أنه مع السمنة، فإن خطر الإصابة بارتفاع ضغط الدم الشرياني، وهو عامل يؤثر أيضًا بشكل كبير على حدوث أمراض القلب والأوعية الدموية مثل النوبات القلبية والسكتات الدماغية، يتضاعف ثلاث مرات مقارنة بالأشخاص ذوي الوزن الطبيعي. كما هو موضح في دراسة INTERSALT، مقابل كل 4.5 كجم من زيادة الوزن، يرتفع ضغط الدم الانقباضي (BP) بمقدار 4.5 ملم زئبق. فن. .
السمنة كعامل خطر لدى النساء ارتفاع ضغط الدم الشرياني، وخاصة في كبار السن، ويحدث في كثير من الأحيان أكثر من الرجال. أحد أسباب ذلك هو نقص هرمون الاستروجين، والذي يحدث خلال فترة ما بعد انقطاع الطمث. ويلاحظ بعض ملامح انتشار السمنة في أنواع مختلفة من ارتفاع ضغط الدم الشرياني. وبالتالي، فإن السمنة ليست شائعة بين النساء الأكبر سناً المصابات بارتفاع ضغط الدم الانقباضي المعزول، ولا توجد بيانات حول تأثير فقدان الوزن على هذه الفئة من المرضى. عند النساء المصابات بالسمنة في منطقة البطن وأشكال الانقباض الانبساطي من ارتفاع ضغط الدم الشرياني، يكون فقدان الوزن نقطة مهمةفي مكافحة الأمراض.
مع السمنة، يحدث عدد من التغيرات في الدورة الدموية، على وجه الخصوص، زيادة في حجم الدم المتداول وحجم السكتة الدماغية والنتاج القلبي مع مقاومة الأوعية الدموية الطبيعية نسبيا. ويعتقد أن ارتفاع ضغط الدم لدى المرضى الذين يعانون من السمنة المفرطة يرجع بشكل رئيسي إلى زيادة النتاج القلبي مع المقاومة المحيطية "غير الطبيعية".
هذه الحالة الديناميكية الدموية لها تأثير محفز على نظامين تنظيميين متعارضين يتحكمان في حجم الدم و المقاومة الطرفية- نظام الرينين أنجيوتنسين-الألدوستيرون (RAAS) ونظام الببتيد القلبي الناتريوتريك. قد يفسر خلل التنظيم إلى حد كبير ارتفاع الناتج القلبي لدى مرضى ارتفاع ضغط الدم الذين يعانون من السمنة المفرطة. علاوة على ذلك، تشارك هذه الأنظمة التنظيمية للقلب والأوعية الدموية في التغيرات الأيضية المرتبطة بزيادة وزن الجسم في أمراض القلب والأوعية الدموية.
لذلك، في حالة السمنة، تلعب ثلاث آليات رئيسية دورًا مهمًا في التسبب في ارتفاع ضغط الدم الشرياني:
يظهر الشكل 1 التسبب في تطور ارتفاع ضغط الدم الشرياني وأمراض القلب والأوعية الدموية في السمنة.
الشكل 1. مخطط التسبب في ارتفاع ضغط الدم الشرياني وأمراض القلب والأوعية الدموية في السمنة
نظام الرينين-أنجيوتنسين-الألدوستيرون الجهازي والنسيجي وتغيراته في السمنة
يشتمل RAAS على مولد الأنجيوتنسين والرينين والأنجيوتنسين I والإنزيم المحول للأنجيوتنسين (ACE) والأنجيوتنسين II (AT II). AT II له تأثير متنوع على الخلايا المختلفة التي لها مستقبلات محددة.
وفقًا للمفاهيم الكلاسيكية، يتشكل مولد الأنجيوتنسين في الكبد، وتحت تأثير الرينين، يتم تصنيعه في الخلايا المحيطة بالكبيبات في الكلى (الخلايا المجاورة للكبيبات)، ويتم تحويل مولد الأنجيوتنسين في الدم إلى أنجيوتنسين I. الإنزيم المحول للأنجيوتنسين هو المسؤول عن انقسام AT. I، مما يؤدي إلى تشكيل AT II.
من المهم أن نلاحظ أنه في السمنة هناك خلل في الآليات التي تنظم عمل RAAS. في ظل الظروف الفسيولوجية، زيادة نشاط RAAS يؤدي إلى زيادة المقاومة الأوعية الطرفيةوبالتالي زيادة في ضغط الدم. وفقًا لمبدأ التغذية الراجعة، فإن زيادة ضغط الدم يجب أن تسبب انخفاضًا في إفراز الرينين، وانخفاضًا في مستويات AT II وانخفاضًا في مستويات الألدوستيرون. وهذا بدوره يقلل من احتباس السوائل والصوديوم ويحافظ على ضغط الدم عند مستوياته الطبيعية.
ومع ذلك، في المرضى الذين يعانون من السمنة الحشوية، يكون تنظيم مستوى مكونات الدورة الدموية الجهازية لـ RAAS ضعيفًا. على الرغم من ارتفاع ضغط الدم واحتباس الصوديوم والسوائل، فضلاً عن زيادة حجم الدم في الدورة الدموية، يظل نشاط الرينين والألدوستيرون في البلازما طبيعيًا أو حتى مرتفعًا قليلاً. قد يكون هذا الخلل في تنظيم RAAS في السمنة نتيجة لزيادة تكوين مكونات RAAS و/أو زيادة ثانوية في تركيزها بسبب عيوب في نظام الببتيد الناتريوتريك.
وقد وجد أنه بالإضافة إلى RAAS الدم، هناك نسيج أو ما يسمى RAAS المحلي، والذي تم تحديده في عدد من الأنسجة والأعضاء، بما في ذلك الدماغ، القلب، الأوعية الدموية، الكلى، الخصيتين، الأنسجة الدهنية ، إلخ.
كما هو معروف، هناك عاملان يلعبان دورًا رئيسيًا في تكوين AT II: نشاط الرينين وتركيز مولد الأنجيوتنسين. تخليق وإفراز مولد الأنجيوتنسين في الخلايا أنواع مختلفةلا يحدد فقط زيادة في التركيز المحلي لـ AT II، بل يزيد أيضًا من النشاط النظامي لـ RAAS. كان التسريب المزمن لـ AT II في الفئران مصحوبًا بزيادة كبيرة في محتوى مرنا مولد الأنجيوتنسين في الخلايا الشحمية. تشير هذه النتائج إلى وجود ردود فعل إيجابية بين AT II ومولد الأنجيوتنسين، حيث أن الزيادة في مستوى أحد العوامل تحفز تكوين العامل الثاني. في السمنة، وخاصة من النوع الحشوي، يظل نشاط الرينين في البلازما، كما سبقت الإشارة إليه، طبيعيًا أو قليلاً مستوى مرتفعوترتفع مستويات الأنجيوتنسينوجين وAT II.
الهيكل والخصائص الفسيولوجية للأنسجة الدهنية
تحتوي الأنسجة الدهنية على أنواع مختلفة من الخلايا، بما في ذلك الخلايا الشحمية والبلاعم والخلايا الليفية والخلايا البطانية الوعائية والخلايا الشحمية (الخلايا الشحمية). النوع الأخير من الخلايا يأتي من الخلايا الجذعية للأديم المتوسط متعددة القدرات. تتشكل الخلايا الشحمية المتمايزة الجديدة ("الصغيرة") من الخلايا الشحمية في جسم الإنسان البالغ. يزداد حجم هذه الخلايا الشحمية ("الخلايا الشحمية الكبيرة") بسبب زيادة المدخول الغذائي الأحماض الدهنية. تدخل الأحماض الدهنية طويلة السلسلة إلى الخلايا الشحمية من الدم وتترسب على شكل ثلاثي الجلسرين المحايد. الأنسجة الدهنية مسؤولة عن تخزين وإفراز الأحماض الدهنية طويلة السلسلة، والتي تعمل كأحد ركائز الطاقة الرئيسية للعديد من الأعضاء والأنسجة، على سبيل المثال، عضلات القلب والهيكل العظمي. تفرز الخلايا الشحمية "الأكبر" كمية أكبر بكثير من الأحماض الدهنية المشبعة. يحدث التحلل المائي للدهون الثلاثية وإطلاق الأحماض الدهنية تحت تأثير الليباز الحساس للهرمونات داخل الخلايا، والذي يتم التحكم في نشاطه بواسطة الكاتيكولامينات (تنظيم إيجابي) والأنسولين (تنظيم سلبي).
نشاط الغدد الصماء من الأنسجة الدهنية
على عكس الدهون تحت الجلدوالتي تمثل عادةً 75% من إجمالي الأنسجة الدهنية في الجسم وهي موقع التخزين الرئيسي للدهون، وتعتبر الدهون الحشوية حاليًا نسيجًا نشطًا منتجًا للهرمونات.
تنتج الخلايا الشحمية مدى واسعالهرمونات والسيتوكينات المشاركة في استقلاب الجلوكوز (أديبونيكتين، ريزيستين، وما إلى ذلك)، والدهون (بروتين نقل استر الكوليسترول)، والالتهاب (TNF-α، إنترلوكين-6)، والتخثر (مثبط منشط البلازمينوجين -1)، وتنظيم ضغط الدم ( أنجيوتنسينوجين، AT II)، سلوك الأكل(اللبتين)، كما يؤثر على عملية التمثيل الغذائي والنشاط الوظيفي لمختلف الأعضاء والأنسجة، بما في ذلك العضلات والكبد والدماغ والأوعية الدموية (انظر الجدول).
طاولة. وظيفة الغدد الصماءالخلايا الشحمية: الشحمية
| الشحمية | آثار الشحمية |
| اللبتين | امتصاص الغذاء، كتلة الدهون |
| أديبونيكتين | |
| مقاومة | مقاومة الأنسولين، والالتهابات |
| فيسفاتين | مقاومة الأنسولين |
| أومينتين | مقاومة الأنسولين |
| السيربين المنطلق من الأنسجة الدهنية الحشوية (فاسبين) | مقاومة الأنسولين |
| أبلين | توسع الأوعية الدموية |
| بروتين نقل استر الكولسترول (CETP) | التمثيل الغذائي للدهون |
| الليباز البروتين الدهني (LPL) | التمثيل الغذائي للدهون |
| هرمون الليباز الحساس (HSL) | التمثيل الغذائي للدهون |
| البروتين المرتبط بالأحماض الدهنية الدهنية -4 (A-FABP-4 (aP2)) | التمثيل الغذائي للدهون |
| بيرليبين | التمثيل الغذائي للدهون |
| بروتين ربط الرينيتول (RBP) | التمثيل الغذائي للدهون |
| البروتين المحفز للأسيلة (ASP) | التمثيل الغذائي للدهون |
| أنجيوتنسين 2 (AT II) | الضغط الشرياني |
| الإنزيم المحول للأنجيوتنسين (ACE) | الضغط الشرياني |
| أنجيوتنسينوجين (AGT) | الضغط الشرياني |
| عامل نخر الورم ألفا (TNF-a) | اشتعال |
| إنترلوكين، 6 (IL-6) | اشتعال |
| بروتين سي التفاعلي (CRP) | اشتعال |
| الخلايا الشحمية-التربسين/العامل المكمل D (الأديبسين) | اشتعال |
| البروتين الجاذب الكيميائي البلاعم -1 (MCP-1) | جاذبة للبلاعم |
| جزيء الالتصاق بين الخلايا -1 (ICAM-1) | تفعيل البلاعم |
| مثبط منشط البلازمينوجين -1 (PAI-1) | انحلال الفيبرين |
من المهم التأكيد على أنه حتى زيادة صغيرة في الحجم الدهون الحشويةيلعب دورًا مهمًا في الاضطرابات الأيضية وتنظيم توازن الماء والكهارل وأمراض القلب والأوعية الدموية.
مع زيادة كتلة الأنسجة الدهنية، يزداد محتوى جميع الأديبوكينات تقريبًا في الدم. والاستثناء هو الأديبونيكتين، الذي يقع مستواه في ظل هذه الظروف. يعتبر اللبتين والأديبونيكتين من أكثر الأديبوكينات التي تمت دراستها في الوقت الحاضر.
اللبتين.يحدث إنتاج اللبتين بشكل رئيسي في الخلايا الشحمية "الكبيرة". غالبًا ما يُنظر إلى اللبتين على أنه جزيء إشارة يتوسط العلاقة بين محتوى العناصر الغذائية التي تدخل الجسم وحالة الأنسجة الدهنية والجهاز العصبي المركزي (ما تحت المهاد). يزيد اللبتين من أكسدة الدهون في الكبد، وكذلك تحلل الدهون في الخلايا الشحمية والخلايا الشحمية العضلات الهيكلية. الأنسولين يحفز تكوين اللبتين. تتأثر مستويات اللبتين أيضًا بالأحماض الدهنية الحرة وTNF-α والإستروجين وهرمون النمو.
أديبونيكتين.يحدث إنتاج الأديبونيكتين حصريًا في الخلايا الشحمية. للأديبونيكتين مجموعة متنوعة من التأثيرات البيولوجية - فهو له تأثير مضاد للتصلب، ويزيد من حساسية الخلايا للأنسولين، ويمنع تخليق الجلوكوز في الكبد، ويعزز نقله إلى العضلات، ويزيد من أكسدة الأحماض الدهنية. تنخفض مستويات الأديبونيكتين في السمنة ومقاومة الأنسولين ومرض السكري من النوع الثاني.
الأنسجة الدهنية ونشاط RAAS
اتضح أن الأنسجة الدهنية تحتل المرتبة الثانية بعد الكبد في تكوين مولد الأنجيوتنسين. على سبيل المثال، تبلغ كمية مرنا مولد الأنجيوتنسين في الخلايا الشحمية حوالي 70% من مستواها في الكبد. لقد تم إثبات العلاقة بين مستويات مولد الأنجيوتنسين والسمنة وارتفاع ضغط الدم الشرياني بوضوح في التجارب التي أجريت على الفئران المعدلة وراثيا والتي تعبر عن كميات زائدة من مولد الأنجيوتنسين في الأنسجة الدهنية. تعاني هذه الفئران من السمنة الحشوية وارتفاع ضغط الدم. خلايا بريدية ومتباينة الخلايا الدهنيةتحتوي على مجموعة كاملة من المكونات اللازمة للتوليف المحلي لـ AT II، بالإضافة إلى مستقبل AT 1 لـ AT II، والذي يضمن النقل داخل الخلايا لإشارات التنشيط الناتجة عن AT II. في السمنة، يزيد حجم الخلايا الشحمية المتمايزة الحشوية بنسبة 20-30 مرة. تتميز السمنة بخلل في الخلايا الشحمية، والذي يُفهم على أنه زيادة في تكوين وإفراز مختلف الأديبوكينات والسيتوكينات، بالإضافة إلى زيادة في محتوى مكونات RAAS، خاصة في الدهون الحشوية.
بتلخيص البيانات من الدراسات المختلفة، يمكننا القول أنه مع السمنة هناك زيادة في نشاط RAAS، وهو ما ينعكس في الحقائق التالية:
نشاط عالييؤدي RAAS بدوره إلى زيادة كتلة الأنسجة الدهنية. على وجه التحديد، أظهرت الفئران المعدلة وراثيا التي تزيد من إنتاج الأنجيوتنسين في الخلايا الدهنية فقط زيادة في مستويات الأنجيوتنسين في الدم، وتطور ارتفاع ضغط الدم، وزيادة كتلة الأنسجة الدهنية. يعمل النسيج AT II بشكل أساسي كعامل نمو للخلايا الشحمية. AT II، نتيجة لتأثيره على مستقبلات AT 1، يسبب زيادة في بروتين cyclin D 1، الذي يشارك في تنظيم نمو وانقسام الخلايا الدهنية. لقد ثبت أن AT II يستحث مرور المرحلة G 1 دورة الخليةفي الخلايا الشحمية البشرية. ارتبط هذا التأثير بالتأثير على مستقبلات AT1 والتنشيط اللاحق للكيناز المعتمد على السيكلين D1.
لقد ثبت أن AT II يسبب تمايز الخلايا الشحمية، وينشط الإنزيمات الرئيسية لتكوين الدهون (تكوين الدهون) ويزيد من تراكم الدهون الثلاثية في الخلايا الشحمية.
تترافق السمنة الحشوية مع زيادة في نشاط 11-بيتا هيدروكسيستيرويد ديهيدروجينيز النوع 1، مما يؤدي إلى تكوين الكورتيزول، وهو هرمون رئيسي في تمايز الخلايا الشحمية إلى خلايا شحمية.
يرتبط نشاط أنسجة RAS ارتباطًا وثيقًا بإنتاج الأديبوكينات بواسطة الأنسجة الدهنية. على سبيل المثال، تبين أن AT II يحفز تعبير الليبتين في الخلايا الشحمية. وقد اقترح أن هذا النشاط هو سمة من سمات AT II المُصنّعة محليًا فقط، على عكس AT II النظامية.
السمنة ونشاط الجهاز العصبي الودي
مع السمنة، خاصة مع البديل البطني، غالبا ما يتم ملاحظة تنشيط الجهاز العصبي الودي. وجدت دراسة NAS (دراسة الشيخوخة الطبيعية) زيادة في النورإبينفرين البولي بما يتناسب مع مؤشر كتلة الجسم. مع فقدان الوزن، ينخفض نشاط الجهاز العصبي الودي.
يتم تسهيل زيادة نشاط الجهاز العصبي الودي في السمنة من خلال وجود فرط أنسولين الدم ومقاومة الأنسولين. قد يزيد الأنسولين من نشاط الجهاز الودي الكظري من تلقاء نفسه، ولكن قد يرجع ذلك جزئيًا إلى عمل اللبتين. ومن المعروف أنه مع زيادة درجة السمنة، يزداد مستوى الليبتين الذي تفرزه الخلايا الشحمية. يزيد اللبتين من نشاط الجهاز العصبي الودي، وخاصة في الكلى. وهذا يؤدي، من ناحية، إلى زيادة النتاج وزيادة معدل ضربات القلب، ومن ناحية أخرى، إلى زيادة إعادة امتصاص الصوديوم وزيادة حجم الدم داخل الأوعية.
تم إنشاء علاقة بين RAAS والجهاز العصبي الودي. يرتبط تنشيط الجهاز العصبي الودي بزيادة إفراز الرينين في الكلى، ويحدث هذا بغض النظر عن وجوده داخل الكلى. الجهاز الحسيتنظيم إفراز الرينين عن طريق الكلى. علاوة على ذلك، فإن زيادة أحادي فوسفات الأدينوزين الحلقي تحت تأثير الكاتيكولامينات يحفز التعبير عن مولد الأنجيوتنسين في الخلايا الشحمية البشرية. زيادة مستويات AT II تزيد من نشاط الجهاز العصبي الودي لدى البشر. لقد ثبت أن AT II ينشط الجهاز العصبي الودي المحلي، والذي يشارك في زيادة درجة حرارة الجسم (توليد الحرارة). يؤدي العلاج البارد إلى زيادة محتوى AT II في الخلايا الشحمية دون تغيير مصاحب في مستويات AT II في البلازما.
وبالتالي، فإن خلل تنظيم RAAS في السمنة يمكن أن يحفز أيضًا نشاط الجهاز العصبي الودي.
طرق التصحيح الدوائي لارتفاع ضغط الدم لدى السمنة
قد تكون مساهمة الآليات المسببة للأمراض المختلفة في الحفاظ على ارتفاع ضغط الدم لدى السمنة مختلفة. لذلك، فإن الأدوية الخافضة للضغط ذات آليات عمل مختلفة جدًا قد يكون لها تأثير مفيد في هذه الحالة.
وفقا للتوصيات الحديثة لعلاج ارتفاع ضغط الدم الشرياني، فإن مفتاح نجاح الانخفاض الكبير في ضغط الدم هو استخدام العلاج المركب. بالنسبة للمرضى الذين يعانون من السمنة المفرطة، أولا وقبل كل شيء، يجب أن تحتوي المكونات الرئيسية لهذا العلاج على مجموعة من الأدوية التي تقلل من نشاط RAAS (مثبطات الإنزيم المحول للأنجيوتنسين والسارتان)، مع الأدوية التي تقلل من نشاط الجهاز العصبي الودي (حاصرات بيتا و مضادات الكالسيوم غير ديهيدروبيريدين)، ومدرات البول. كفاءة عاليةلقد ظهر استخدام الأدوية التي تمنع RAAS في السمنة في العديد من الدراسات. فيما يتعلق باستخدام حاصرات بيتا، فإن البيانات متناقضة للغاية، أولاً وقبل كل شيء، بشكل عام بسبب الشكوك حول فائدتها في علاج المرضى الذين يعانون من ارتفاع ضغط الدم الشرياني غير المعقد، وثانيًا، بسبب حقيقة أن حاصرات بيتا، على الأقل الكلاسيكية، يمكن أن تزيد من وزن المرضى وتزيد من مقاومة الأنسولين. لذلك، إذا اخترنا حاصرات بيتا لعلاج المرضى الذين يعانون من السمنة أو متلازمة التمثيل الغذائي، فيجب أن تكون هذه أدوية ذات خصائص خاصة، على وجه الخصوص، كارفيديلول ونيبيفولول.
في الوقت نفسه، وجد أن فيراباميل، مضاد الكالسيوم غير ثنائي هيدروبيريدين، لا يمكنه خفض ضغط الدم بشكل كبير فحسب، بل يقلل أيضًا من نشاط الجهاز العصبي الودي.
وبالتالي، في حالة السمنة، يمكن استخدام مجموعة من الأدوية التي تمنع RAAS والفيراباميل لعلاج ارتفاع ضغط الدم الشرياني.
وينبغي التأكيد على أن هذا النوع من الجمع الأدويةموجود في شكل مجتمعة جاهزة شكل جرعات- عقار Tarka الذي يحتوي على ACEI القابل للذوبان في الدهون - تراندولابريل وفيراباميل بطيء الإطلاق (فيراباميل SR). يعد هذا النهج مهمًا جدًا للعلاج الفعال، نظرًا لأن استخدام أشكال الجرعات الجاهزة يحسن التزام المريض بالعلاج.
هناك أدلة على أن Tarka، إلى حد أكبر من كل مكون من مكوناته، يخفض ضغط الدم، وله قدرة واضحة على تقليل تضخم البطين الأيسر، ويساعد على تطبيع وظيفة بطانة الأوعية الدموية، وهو محايد أيضيًا، حتى في المرضى الذين يعانون من داء السكري.
الحركة المزدوجة- انخفاض نشاط RAAS تحت تأثير تراندولابريل والجهاز العصبي الودي بسبب تأثير فيراباميل المطول - له تأثير مهم على الآليات المسببة للأمراضتطور ارتفاع ضغط الدم الشرياني في السمنة والآليات التي تثير تلف الأعضاء المستهدفة في هذا النوع من ارتفاع ضغط الدم.
ينبغي إيلاء اهتمام خاص عند مناقشة علاج ارتفاع ضغط الدم في السمنة إلى حقيقة أن العلاج القائم على مزيج من تراندالابريل مع فيراباميل طويل المفعول يمكن أن يقلل من خطر الإصابة بداء السكري مقارنة باستخدام أسلوب علاج آخر - مزيج دواء سارتان بجرعة منخفضة من مدر البول الثيازيدي. تظهر دراسة STAR بوضوح أنه عند استخدام Tarka لمدة عام واحد، يتطور عدد أقل من الأشخاص الذين يعانون من متلازمة التمثيل الغذائي، حيث تكون السمنة في البطن حالة سائدة. السكري(الصورة 2) .
الشكل 2. تطور حالات جديدة من داء السكري (مستوى الجلوكوز أثناء الصيام > 126 ملغم/ديسيلتر أو اختبار تحمل الجلوكوز لمدة ساعتين > 200 ملغم/ديسيلتر) حسب نوع العلاج الخافض لضغط الدم لدى الأشخاص الذين يعانون من متلازمة التمثيل الغذائي في دراسة STAR

بالإضافة إلى ذلك، وفقا لدراسة STAR-LET، حتى عندما يحدث داء السكري في الخلفية علاج بالعقاقيرإن نقل هؤلاء المرضى لتناول عقار تاركا سمح لنصف المرضى بالتطبيع التمثيل الغذائي للكربوهيدرات.
نتائج هذه الدراسات تجبرنا على إعادة النظر في التوصيات المتعلقة بها علاج بالعقاقيرارتفاع ضغط الدم الشرياني لدى الأشخاص الذين يعانون من متلازمة التمثيل الغذائي وبدء العلاج بمزيج يحتوي على مثبط الإنزيم المحول للأنجيوتنسين (أو السارتان) ومضاد الكالسيوم، أو نقل المرضى إلى علاج مماثل.
كما ذكرنا عدة مرات، لعلاج ارتفاع ضغط الدم الشرياني، يلعب تقليل وزن المرضى ودرجة السمنة في منطقة البطن دورًا مهمًا. وبطبيعة الحال، فإن تقليل وزن الجسم بطريقة أو بأخرى يمكن أن يكون له تأثير كبير في تقليل الإصابة بأمراض القلب والأوعية الدموية. حاليًا، هناك طرق مختلفة للعلاج الدوائي للسمنة. اول واحد هو علاج الأعراضأي تقليل عدد السعرات الحرارية المستهلكة، وذلك عن طريق تقليل امتصاص الدهون من الطعام. يمكن أن يسمى هذا النهج التعويضي. في الواقع، مع هذا العلاج لا يتم القضاء على المرض (نظرًا لأن المريض يستمر في تناول وجبة دسمة)، ولكن يتم تعويضه مؤقتًا فقط بواسطة الدواء. هناك نهج آخر لعلاج زيادة الوزن والسمنة وهو معالجة جذور المشكلة، وهي الإفراط المزمن في تناول الطعام. هذه هي الطريقة التي يعمل بها سيبوترامين (ميريديا). إنه يؤدي إلى الشبع السريع ويقلل من كمية الطعام المستهلكة عن طريق تثبيط إعادة امتصاص النوربينفرين والسيروتونين في نقاط الاشتباك العصبي للدوائر العصبية. اليوم ميريديا هي الوحيدة الدواء الأصلي، القضاء على سبب السمنة.
والفرق الأساسي بين سيبوترامين هو أنه، دون التسبب في انخفاض الشهية، فإنه يعزز بداية مبكرة للشعور بالشبع. يتخلص الإنسان من العادة المرضية المتمثلة في الإفراط في تناول الطعام، والتي تؤدي إلى انخفاض تدريجي ومستدام في وزن الجسم. تحت تأثير سيبوترامين، يتم تقليل استهلاك الغذاء بحوالي 20٪. جنبا إلى جنب مع هذا، سيبوترامين يؤثر بشكل غير مباشر على مستوى الأمينات الحيوية في الدم، والتي تنشط المستقبلات الأدرينالية في الأنسجة الدهنية وتبدأ تحلل الدهون في الخلايا الشحمية، والذي يصاحبه تغيير في محتوى ركائز الطاقة في الدم. سيبوترامين، بسبب تنشيط المستقبلات الأدرينالية β 2 و β 3، يعزز عمليات التوليد الحراري ويزيد من استهلاك الطاقة في الجسم.
تم إثبات الفعالية السريرية والسلامة للسيبوترامين (ميريديا). كميات كبيرةدراسات متعددة المراكز. على وجه الخصوص، في دراسة STORM (تجربة سيبوترامين للحد من السمنة والحفاظ عليها)، والتي شملت 605 مريضًا يعانون من السمنة المفرطة، تبين أن استخدام سيبوترامين لمدة عامين قلل من وزن المرضى بمقدار 3 مرات، ومحيط الخصر - مرتين أكثر وضوحًا من الدواء الوهمي.. والأهم من ذلك، أن 80% من المرضى حافظوا على فقدان الوزن على مدار عامين، مقارنة بـ 16% من المرضى الذين تلقوا العلاج الوهمي (ص).< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов كثافة عاليةارتفع بنسبة 21% مع انخفاض مستويات البروتين الدهني منخفض الكثافة والدهون الثلاثية.
قد يكمن التأثير المفيد لفقدان الوزن في علاج المرضى الذين يعانون من ارتفاع ضغط الدم الشرياني وأمراض القلب والأوعية الدموية الأخرى في حقيقة أن انخفاض الدهون داخل البطن قد يقلل من الضغط الميكانيكي للكلى، مما قد يؤدي إلى تحسين تدفق الدم إلى الكلى. وانخفاض في نشاط RAAS. يمكن أن يؤدي انخفاض الأنسجة الدهنية داخل الكلى وحولها إلى انخفاض الضغط الخلالي، وضغط الجزء الرقيق من حلقة هينلي، وزيادة تدفق الدم في الأوعية المستقيمية، وانخفاض إعادة الامتصاص الأنبوبي لـ Na + والماء. وبالتالي، فإن فقدان الوزن بسبب طرق التصحيح غير الدوائية أو الدوائية يمكن أن يقلل من ضغط الدم.
ومع ذلك، حتى وقت قريب، في الواقع الممارسة السريريةتم استخدام سيبوترامين بحذر خوفا من احتمال حدوثه التأثير السلبيعلى ضغط الدم ومعدل ضربات القلب، الأمر الذي بدوره يمكن أن يؤدي، وإن كان ذلك في عدد قليل من المرضى، إلى حالة غير سارة مشاعر ذاتية. لدراسة تأثير سيبوترامين على نظام القلب والأوعية الدموية وإثبات سلامة الدواء في مجموعة من المرضى الذين يعانون من زيادة خطر الإصابة بأمراض القلب والأوعية الدموية، تم إجراء تجربة دولية واسعة النطاق متعددة المراكز، مزدوجة التعمية، خاضعة للتحكم الوهمي، SCOUT (سيبوترامين القلب والأوعية الدموية النتائج)، حيث تمت ملاحظة 10,742 مريضًا، 97% منهم مصابون بأمراض من نظام القلب والأوعية الدموية 88 - ارتفاع ضغط الدم الشرياني و 84٪ - داء السكري من النوع الثاني. وبناء على نتائج المرحلة الأولى المكتملة من الدراسة وجد أن إعطاء السيبوترامين أدى إلى زيادة معنوية (p).< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
يطرح سؤال طبيعي حول كيفية ارتباط هذا النوع أو ذاك من العلاج الخافض لضغط الدم بالعلاج باستخدام سيبوترامين. تم إجراء العديد من الدراسات للإجابة على هذا السؤال. على سبيل المثال، تبين أن استخدام شكل جرعات مشترك يحتوي على فيراباميل 180 ملغ/تراندولابريل 2 ملغ مع سيبوترامين 10 ملغ أدى على مدى 6 أشهر إلى انخفاض أكثر وضوحًا في ضغط الدم مقارنة بالعلاج الخافضة للضغط وحده - انخفض ضغط الدم الانقباضي. وعليه بنسبة 21.9 ± 8.1 مقابل 15.9 ± 12.3 ملم زئبق. فن. والانبساطي - بمقدار 15.7 ± 8.1 مقابل 9.1 ± 9.9 ملم زئبق. فن. (ع = 0.03). أدى العلاج المركب أيضًا إلى تحسن أكثر وضوحًا في معايير القياسات البشرية. موثوق (ص<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
كانت دراسة HOS (ارتفاع ضغط الدم والسمنة والسيبوترامين) عبارة عن دراسة محتملة ومتعددة المراكز ومضبوطة بالعلاج الوهمي ومزدوجة التعمية مدتها 16 أسبوعًا تقارن بين أنظمة علاج ارتفاع ضغط الدم المختلفة (فيلوديبين 5 مجم/راميبريل 5 مجم (ن = 57)، فيراباميل 180 مجم/ تراندولابريل 2 ملغ (ن = 55)، ميتوبرولول سكسينات 95 ملغ/هيدروكلوروثيازيد 12.5 ملغ ن = 59) عندما يوصف سيبوترامين وهمي. وأكدت هذه الدراسة أن سيبوترامين يمكن أن يزيد من ضغط الدم. لذلك، بالطبع، العلاج المناسب لارتفاع ضغط الدم ضروري خلال فترة استخدام سيبوترامين في المرضى الذين يعانون من ارتفاع ضغط الدم الشرياني. وقد تبين أيضًا أنه عند العلاج بمزيج من حاصرات بيتا وهيدروكلوروثيازيد، كانت التأثيرات الإيجابية للسيبوترامين من حيث فقدان الوزن ومحيط الخصر والتأثير على المظهر الأيضي أقل وضوحًا بشكل ملحوظ مما كانت عليه عند دمجها مع العلاج المركب للإنزيم المحول للأنجيوتنسين. مثبطات ومضادات الكالسيوم مع سيبوترامين. وهذا يؤكد مرة أخرى الحاجة إلى الاختيار الدقيق للعلاج الخافضة للضغط لدى المرضى الذين يعانون من السمنة المفرطة، وخاصة عند إجراء البرامج التي تهدف إلى فقدان الوزن. وفي الختام، تجدر الإشارة إلى أنه من وجهة نظرنا، فإن إحدى المشاكل المهمة التي تقلل من فعالية مكافحة السمنة هي أن لا الأطباء ولا السكان يعتبرون السمنة عامل خطر كبير. علاوة على ذلك، فإن المرضى في كثير من الأحيان لا يعتبرون أنفسهم يعانون من السمنة المفرطة. على سبيل المثال، في الدراسة البولندية، وفقا لتقييم الأطباء على أساس حسابات مؤشر كتلة الجسم، تم تسجيل السمنة لدى كل من الرجال والنساء ثلاث مرات أكثر من التقييم الذاتي للمرضى. وبالتالي، ينبغي تعزيز أعمال التوعية وتنفيذها بين السكان حول الحاجة إلى منع زيادة الوزن، وتصحيح السمنة الموجودة وأهمية العلاج المستمر لارتفاع ضغط الدم الشرياني. الأدب
1. فليجال كيه إم، كارول إم دي، أوغدن سي كيه، جونسون سي إل انتشار واتجاهات السمنة بين البالغين في الولايات المتحدة، 1999-2000. جاما 2002؛ 288:1723-7.
2. بي-سونير إف إكس. وبائيات توزيع الدهون المركزية وعلاقتها بالمرض. نوتر ريف 2004؛ 62(7): 120-6.
3. أربيني سي. إم. معالجة الاحتياجات الطبية غير الملباة لعلاجات فقدان الوزن الآمنة والفعالة. أوبيس ريس 2004؛ 12(8): 1191-6.
4. ستاملر جيه، روز جي، ستاملر آر، وآخرون. نتائج دراسة إنترسالت. الآثار المترتبة على الصحة العامة والرعاية الطبية. ارتفاع ضغط الدم 1989؛ 14(5): 570-7.
5. Jedrychowski W.، Mroz E.، Bojanczyk M.، Jedrychowska I. الوزن الزائد وارتفاع ضغط الدم لدى كبار السن - نتائج الدراسة المجتمعية. آرتش جيرونتول جيرياتر 1991؛ 13(1): 61-9.
6. كاناي إتش، توكوناجا كيه، فوجيوكا إس، وآخرون. انخفاض الدهون الحشوية داخل البطن قد يقلل من ضغط الدم لدى النساء المصابات بارتفاع ضغط الدم البدينات. ارتفاع ضغط الدم 1996; 27(1): 125-9.
7. بويرير بي، جايلز تي دي، براي جي إيه، وآخرون. جمعية القلب الأمريكية. لجنة السمنة التابعة لمجلس التغذية والنشاط البدني والتمثيل الغذائي. السمنة وأمراض القلب والأوعية الدموية: الفيزيولوجيا المرضية والتقييم وتأثير فقدان الوزن: تحديث للبيان العلمي لجمعية القلب الأمريكية لعام 1997 حول السمنة وأمراض القلب من لجنة السمنة التابعة لمجلس التغذية والنشاط البدني والتمثيل الغذائي. التوزيع 2006؛ 113: 898-918.
8. ألبرت م.أ. السمنة واعتلال عضلة القلب. الفيزيولوجيا المرضية وتطور المتلازمة السريرية. آم J ميد ساي 2001؛ 321: 225-36.
9. أنيجا أ.، الأتات ف.، ماكفارلين إس.آي.، سويرز جي.آر. ارتفاع ضغط الدم والسمنة. الأخيرة بروغر هورم ريس 2004؛ 59: 169-205.
10. إنجيلي س.، شارما أ.م. نظام الرينين أنجيوتنسين والببتيدات الناتريوتريك في ارتفاع ضغط الدم المرتبط بالسمنة. جي مول ميد 2001؛ 79: 21-9.
11. لافونتان إم، مورو سي، سينجينيس سي، وآخرون. دور أيضي غير متوقع للببتيدات الأذينية الناتريوتريك: التحكم في تحلل الدهون، وتعبئة الدهون، ومستويات الأحماض الدهنية غير المؤسترة الجهازية في البشر. تصلب الشرايين ثرومب فاسك بيول 2005؛ 25: 2032-42.
12. هول جي.إي. الكلى وارتفاع ضغط الدم والسمنة. ارتفاع ضغط الدم 2003; 41(3): 625-33.
13. كوبر آر، ماكفارلين أندرسون إن، بينيت إف آي، وآخرون. ACE والأنجيوتنسين والسمنة: مسار محتمل يؤدي إلى ارتفاع ضغط الدم. جي هوم هايبرتنز 1997؛ 11: 107-11.
14. لو ن.، بستاني-كاري سي.إم، دوجيرتي أ.، كاسيس إل.إيه. يزيد الأنجيوتنسين II من التعبير الدهني للأنجيوتنسين. آم جي فيسيول إندوكرينول ميتاب 2007؛ 292: 1280-7.
15. إنجيلي إس، نيجريل آر، شارما إيه إم. الفسيولوجيا والفيزيولوجيا المرضية لنظام الرينين أنجيوتنسين في الأنسجة الدهنية. ارتفاع ضغط الدم 2000; 35(6): 1270-7.
16. أوتو تي سي، لين إم دي التطور الدهني: من الخلايا الجذعية إلى الخلايا الشحمية. كريت ريف بيوكيم مول بيول 2005؛ 40: 229-42.
17. هاجر جي آر، فان هيفتن تي دبليو، فيسيرين إف إل جيه. خلل الأنسجة الدهنية في السمنة والسكري وأمراض الأوعية الدموية. يورو هارت J 2008؛ 29: 2959-71.
18. واناثي إس جي، لوي جي دي، روملي أ، وآخرون. الأديبوكينات وخطر الإصابة بمرض السكري من النوع 2 لدى كبار السن من الرجال. مرض السكري الأساسية 2007؛ 30: 1200-5.
19. تشو إن إف، سبيجلمان د، هوتاميسليجيل جي إس، وآخرون. مستويات الأنسولين في البلازما والليبتين ومستقبلات TNF القابلة للذوبان فيما يتعلق بعوامل خطر الإصابة بأمراض القلب والأوعية الدموية المرتبطة بالسمنة وتصلب الشرايين بين الرجال. تصلب الشرايين 2001; 157: 495-503.
20. Skurk T.، Alberti-Huber C.، Herder C.، Hauner H. العلاقة بين حجم الخلايا الشحمية والتعبير والإفراز الدهني. J كلين إندوكرينول ميتاب 2007؛ 6(92):1023-33.
21. ران جي، هيرانو تي، فوكوي تي، وآخرون. يقلل تسريب الأنجيوتنسين II من مستوى أديبونيكتين في البلازما عبر مستقبله من النوع الأول في الجرذان: وهو ما يؤثر على مقاومة الأنسولين المرتبطة بارتفاع ضغط الدم. الأيض 2006; 55: 478-88.
22. كونسيدين آر في، سينها إم كيه، هيمان إم إل، وآخرون. تركيز اللبتين المناعي في الدم لدى الأشخاص ذوي الوزن الطبيعي والسمنة. إن إنجل جي ميد 1996؛ 334:292-5.
23. شوارتز إم دبليو، وودز إس سي، بورت دي جونيور، وآخرون. سيطرة الجهاز العصبي المركزي من تناول الطعام. طبيعة 2000; 404(6778):661-71.
24. تشيونغ سي.سي.، كليفتون دي.ك.، شتاينر آر.إيه. تعتبر الخلايا العصبية البروبيوميلانوكورتين أهدافًا مباشرة لليبترين في منطقة ما تحت المهاد. الغدد الصماء 1997; 138؛ 4489-92.
25. لونج واي سي، زيراث جي آر. إشارات بروتين كيناز المنشط بـ AMP في تنظيم التمثيل الغذائي. جي كلين إنفست 2006؛ 116: 1776-83.
26. صلاح الدين ر.، دي فوس ب.، غيري-ميلو م.، وآخرون. زيادة عابرة في التعبير الجيني للسمنة بعد تناول الطعام أو تناول الأنسولين. طبيعة 1995; 377:527-9.
27. تشانغ إتش إتش، كومار إس، بارنيت إيه إتش، إيغو إم سي. يمارس عامل نخر الورم ألفا تأثيرات مزدوجة على تخليق اللبتين الدهني البشري وإطلاقه. مول سيل إندوكرينول 2000؛ 159: 79-88.
28. ليندساي آر إس، فوناهاشي تي، هانسون آر إل، وآخرون. الأديبونيكتين وتطور مرض السكري من النوع 2 في سكان بيما الهنود. لانسيت 2002؛ 360: 57-8.
29. هاجر جي آر، فان دير جراف واي، أوليجهوك جي كيه، وآخرون. ترتبط المستويات المنخفضة من الأديبونيكتين في البلازما بانخفاض خطر الإصابة بأمراض القلب والأوعية الدموية المستقبلية لدى المرضى الذين يعانون من أمراض الأوعية الدموية السريرية الواضحة. أنا القلب J 2007؛ 154(750): 1-7.
30. ماسيرا ف.، بلوخ-فور م.، سيلر د.، وآخرون. ويشارك الأنجيوتنسين الدهني في نمو الأنسجة الدهنية وتنظيم ضغط الدم. فاسيب ي 2001؛ 15: 2727-9.
31. Paul M., Mehr A.P., Kreutz R. فسيولوجيا أنظمة الرينين أنجيوتنسين المحلية. فيسيول ريف 2006؛ 86: 747-803.
32. كارلسون سي، ليندل كيه، أوتوسون إم، وآخرون. الأنسجة الدهنية البشرية تعبر عن أنجيوتنسينوجين والإنزيمات اللازمة لتحويله إلى أنجيوتنسين II. J كلين إندوكرينول ميتاب 1998؛ 83: 3925-9.
33. جورزيلنياك ك، إنجيلي إس، جانكي جيه، وآخرون. التنظيم الهرموني لنظام الرينين أنجيوتنسين للأنسجة الدهنية البشرية: العلاقة بالسمنة وارتفاع ضغط الدم. جي هايبرتنز 2002؛ 20: 965-73.
34. إنجيلي إس، جورزيلنياك كيه، كروتز آر، وآخرون. التعبير المشترك عن جينات نظام الرينين أنجيوتنسين في الأنسجة الدهنية البشرية. جي هايبرتنز 1999؛ 17: 555-60.
35. أشارد ف.، بولو سيوكا إس.، ديبريير آر، وآخرون. التعبير عن مستقبلات الرينين في الأنسجة الدهنية البشرية. آم جي فيسيول ريجول إنتيجر كومب فيسيول 2007؛ 292: 274-82.
36. Sarzani R.، Savi F.، Dessi-Fulgheri P.، Rappelli A. نظام رينين أنجيوتنسين، الببتيدات الناتريوتريك، السمنة، متلازمة التمثيل الغذائي، وارتفاع ضغط الدم: رؤية متكاملة في الإنسان. جي هايبرتنز 2008؛ 26: 831-43.
37. كراندال دي إل، أرميلينو دي سي، بوسلر دي إي، وآخرون. مستقبلات الأنجيوتنسين II في الخلايا الشحمية البشرية: دور في تنظيم دورة الخلية. الغدد الصماء 1999; 140: 154-8.
38. سان مارك بي، كوزاك إل بي، إيلهاود جي، وآخرون. أنجيوتنسين II كعامل غذائي للأنسجة الدهنية البيضاء: تحفيز تكوين الخلايا الدهنية. الغدد الصماء 2001; 142: 487-92.
39. واتانابي جي، لي آر جيه، ألبانيز سي، وآخرون. تفعيل أنجيوتنسين II لنشاط الكيناز المعتمد على السيكلين D1. جي بيول كيم 1996؛ 271:22570-7.
40. Darimont C.، Vassaux G.، Ailhaud G.، Negrel R. تمايز الخلايا preadipose: دور الباراكرين للبروستاسيكلين عند تحفيز الخلايا الدهنية بواسطة أنجيوتنسين-II. الغدد الصماء 1994; 135:2030-6.
41. Jones B.H.، Standridge M.K.، Moustaid N. Angiotensin II يزيد من تكوين الدهون في 3T3-L1 والخلايا الدهنية البشرية. الغدد الصماء 1997; 138: 1512-9.
42. ويك دي جي، ووكر بي آر. تثبيط 11 بيتا هيدروكسيستيرويد ديهيدروجينيز النوع 1 في السمنة. الغدد الصماء 2006؛ 29: 101-8.
43. إنجيلي إس، بوهنكي جيه، فيلدبوش إم، وآخرون. تنظيم جينات 11 بيتا-HSD في الأنسجة الدهنية البشرية: تأثير السمنة المركزية وفقدان الوزن. أوبيس ريس 2004؛ 12: 9-17.
44. كيم س.، ويلان ج.، كلايكومب ك.، وآخرون. يزيد الأنجيوتنسين II من إفراز هرمون الليبتين بواسطة 3T3-L1 والخلايا الشحمية البشرية عبر آلية مستقلة عن البروستاجلاندين. جي نوتر 2002؛ 132: 1135-40.
45. Cassis L.A., English V.L., Bharadwaj K., Boustany C.M. التأثيرات التفاضلية للأنجيوتنسين II الموضعي مقابل الجهازي في تنظيم إطلاق اللبتين من الخلايا الشحمية. الغدد الصماء 2004; 145: 169-74.
46. مانسيا جي.، بوسكيت بي.، الغوزي جي إل، وآخرون. الجهاز العصبي الودي والمتلازمة الأيضية. جي هايبرتنز 2007؛ 25: 909-20.
47. Tentolouris N.، Liatis S.، Katsilambros N. نشاط الجهاز الودي في السمنة ومتلازمة التمثيل الغذائي. آن نيويورك أكاد العلوم 2006؛ 1083: 129-52.
48. لاندسبيرج إل.، ترويزي آر.، باركر دي، وآخرون. السمنة وضغط الدم والجهاز العصبي الودي. آن إبيديميول 1991؛ 1: 295-303.
49. Serazin V.، Dos Santos E.، Morot M.، Giudicelli Y. يتم تحفيز التعبير الجيني لإفراز الأنجيوتنسين الدهني البشري وإفرازه بواسطة AMP الحلقي عبر زيادة نشاط ربط العنصر المستجيب لـ AMP الدوري DNA. الغدد الصماء 2004؛ 25: 97-104.
50. كاسيس لوس أنجلوس دور أنجيوتنسين II في توليد الحرارة الدهنية البنية أثناء التأقلم البارد. آم J فيسيول إندوكرينول ميتاب 1993؛ 265:860-5.
51. كاسيس إل.إيه، دوسكين إل.بي. التعديل قبل المشبكي لإطلاق الناقل العصبي بواسطة أنجيوتنسين II الداخلي في الأنسجة الدهنية البنية. J العصبية 1991؛ 34: 129-37.
52. رايسين إي، وير إم، فولكنر بي، وآخرون. ليزينوبريل مقابل هيدروكلوروثيازيد في مرضى ارتفاع ضغط الدم الذين يعانون من السمنة المفرطة: تجربة متعددة المراكز تسيطر عليها وهمي. العلاج لدى المرضى الذين يعانون من السمنة المفرطة والذين يعانون من ارتفاع ضغط الدم (TROPHY) مجموعة الدراسة. ارتفاع ضغط الدم 1997; 30(1): 2140-5.
53. نيوتيل جي إم، سوندرز إي، باكريس جي إل، وآخرون. فعالية وسلامة التوليفات الثابتة ذات الجرعات المنخفضة والعالية من الإربيسارتان/هيدروكلوروثيازيد في المرضى الذين يعانون من ضغط الدم الانقباضي غير المنضبط على العلاج الأحادي: التجربة الشاملة. جي كلين هايبرتنز (جرينتش) 2005؛ 7(10): 578-86.
54. بيلينكوف يو.ن.، تشازوفا آي.إي.، ميتشكا ف.ب. نيابة عن مجموعة أبحاث IVF. دراسة عشوائية متعددة المراكز ومفتوحة التسمية تدرس فعالية تغييرات نمط الحياة والعلاج بمثبطات الإنزيم المحول للأنجيوتنسين (كينابريل) في المرضى الذين يعانون من السمنة المفرطة والذين يعانون من ارتفاع ضغط الدم الشرياني (IVF). ارتفاع ضغط الدم الشرياني 2003؛ 9(6): 3-6.
55. جاكوب س.، ريت ك.، هنريكسن إي.ج. العلاج الخافض لضغط الدم وحساسية الأنسولين: هل يتعين علينا إعادة تعريف دور عوامل حجب بيتا؟ آم جي هايبرتنز 1998؛ 11(10): 1258-65.
56. كاجا آر، كوجالا إس، مانهم ك، وآخرون. آثار العلاج الودي على مؤشرات حساسية الأنسولين لدى النساء بعد انقطاع الطمث المصابات بارتفاع ضغط الدم. إنت J كلين فارماكول ثير 2007؛ 45(7): 394-401.
57. Kuperstein R.، Sasson Z. آثار العلاج الخافضة للضغط على استقلاب الجلوكوز والأنسولين وعلى كتلة البطين الأيسر: دراسة عشوائية مزدوجة التعمية خاضعة للرقابة لـ 21 مريضًا يعانون من ارتفاع ضغط الدم يعانون من السمنة المفرطة. تداول 2000؛ 102(15): 1802-6.
58. هالبرين أ.ك.، كوبيدو إل.إكس. دور حاصرات قنوات الكالسيوم في علاج ارتفاع ضغط الدم. أنا القلب J 1986؛ 111(2): 363-82.
59. مكاليستر ر.ج. الابن الصيدلة السريرية لعوامل حجب القنوات البطيئة. بروغ كارديوفاسك ديس 1982؛ 25(2): 83-102.
60. بينججلي سي.، كورتي آر، سودانو آي، وآخرون. آثار الحصار المزمن لقناة الكالسيوم على نشاط العصب الودي في ارتفاع ضغط الدم. ارتفاع ضغط الدم 2002; 39(4): 892-6.
61. ليفراندت جي دي، هيتمان جيه، سيفر ك، وآخرون. آثار فئات مضادات ديهيدروبيريدين وفينيل ألكيلامين الكالسيوم على الوظيفة اللاإرادية في ارتفاع ضغط الدم: دراسة VAMPHYRE. آم جي هايبرتنز 2001؛ 14(11): 1083-9.
62. Wanovich R.، Kerrish P.، Gerbino P.P.، Shoheiber O. أنماط الامتثال للمرضى الذين تم علاجهم بعاملين منفصلين لارتفاع ضغط الدم مقابل العلاج المركب بجرعة ثابتة Am J Hypertens 2004؛ 175:223.
63. ديزي سي.م. دراسة بأثر رجعي للمثابرة مع العلاج المركب بحبوب منع الحمل الواحدة مقابل العلاج المركب. العلاج المتزامن بحبتين في المرضى الذين يعانون من ارتفاع ضغط الدم. إدارة الرعاية. 2000؛ 9(9): 2-6.
64. Gerbino P.P.، Shoheiber O. أنماط الالتزام بين المرضى الذين عولجوا بجرعة ثابتة مقابل عوامل منفصلة لارتفاع ضغط الدم. آم جي هيلث سيست فارم 2007؛ 64(12): 1279-83.
65. جاكسون ك. استمرار التركيبة الثابتة مقابل الحرة مع فالسارتان وHCTZ للمرضى الذين يعانون من ارتفاع ضغط الدم. فاليو هيلث سوبل 2006؛ 9:363.
66. Aepfelbacher F.C.، Messerli F.H.، Nunez E.، Michalewicz L. التأثيرات القلبية الوعائية لمزيج تراندولابريل / فيراباميل في المرضى الذين يعانون من ارتفاع ضغط الدم الأساسي الخفيف إلى المتوسط. آم جي كارديول 1997؛ 79(6): 826-8.
67. رينولدز N.A.، واجستاف A.J.، كيم S.J. تراندولابريل / فيراباميل إطلاق مستدام: مراجعة لاستخدامه في علاج ارتفاع ضغط الدم الأساسي. المخدرات 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. إدارة ارتفاع ضغط الدم لدى مرضى السكري - التركيز على تركيبة تراندولابريل / فيراباميل. إدارة المخاطر الصحية فاسك 2007؛ 3(4): 453-65.
69. باكريس ج.، موليتش م.، هيوكين أ.، وآخرون. الاختلافات في تحمل الجلوكوز بين مجموعات الأدوية الخافضة لضغط الدم ذات الجرعة الثابتة لدى الأشخاص الذين يعانون من متلازمة التمثيل الغذائي. رعاية مرضى السكري 2006؛ 29(12): 2592-7.
70. باكريس جي، موليتش إم، تشو كيو، وآخرون. عكس ضعف تحمل الجلوكوز المرتبط بمدرات البول ومرض السكري الجديد: نتائج دراسة STAR-LET. متلازمة J كارديوميتاب 2008؛ 3(1): 18-25.
71. Bailey C.J.، Day C. أساليب دوائية جديدة للسمنة. ممارسة السمنة 2005؛ 1: 2-5.
72. يانوفسكي إس. زد.، يانوفسكي جي.إيه. بدانة. إن إنجل جي ميد 2002؛ 346(8): 591-602.
73. داي سي، بيلي سي جيه. تحديث سيبوترامين. بر جي ديابت فاسك ديس 2002؛ 2: 392-7.
74. جيمس دبليو بي، أستروب أ، فاينر إن، وآخرون. تأثير سيبوترامين على الحفاظ على الوزن بعد فقدان الوزن: تجربة عشوائية. مجموعة دراسة العاصفة. تجربة سيبوترامين للحد من السمنة والمحافظة عليها. لانسيت 2000؛ 356:2119-25.
75. تورب بيدرسن سي، كاترسون آي، كوتينهو دبليو، وآخرون. استجابات القلب والأوعية الدموية لإدارة الوزن وسيبوترامين في المواضيع عالية الخطورة: تحليل من تجربة SCOUT. يورو هارت J 2007؛ 28(23): 2915-23.
76. شارما إيه إم، كاترسون آي دي، كوتينهو دبليو، وآخرون. تغيرات ضغط الدم المرتبطة بالسيبوترامين وإدارة الوزن - تحليل من فترة 6 أسابيع من تجربة نتائج القلب والأوعية الدموية للسيبوترامين (SCOUT). مرض السكري السمنة ميتاب 2008. دوي 10.1111/J.1463-1326.2008.00930.
77. ناكو إي، فيليباتوس تي دي، ليبروبولوس إي إن، وآخرون. آثار سيبوترامين بالإضافة إلى فيراباميل الإصدار المستدام / تركيبة تراندولابريل على ضغط الدم والمتغيرات الأيضية لدى مرضى ارتفاع ضغط الدم الذين يعانون من السمنة المفرطة. خبير الرأي فارماكوثر 2008؛ 9(10): 1629-39.
78. شولز جيه، جريم إي، هيرمان دي، وآخرون. العلاج الأمثل لارتفاع ضغط الدم المرتبط بالسمنة: دراسة ارتفاع ضغط الدم والسمنة والسيبوترامين (HOS). التوزيع 2007؛ 115(15): 1991-8.
79. جليزر م.ج. نتائج الدراسة الروسية POLONESE (فعالية وسلامة الكلى لدى المرضى الذين يعانون من ارتفاع ضغط الدم الشرياني). الأرشيف العلاجي 2006؛ 4: 44-50.
للحصول على الاقتباس:ليونوفا إم في. أدوية جديدة واعدة تمنع نظام الرينين أنجيوتنسين-الألدوستيرون // سرطان الثدي. المراجعة الطبية. 2013. رقم 17. ص 886
يعتبر دور نظام الرينين أنجيوتنسين-الألدوستيرون (RAAS) في تطور ارتفاع ضغط الدم الشرياني (AH) وأمراض القلب والأوعية الدموية الأخرى هو السائد حاليًا. في سلسلة القلب والأوعية الدموية، يعد ارتفاع ضغط الدم من بين عوامل الخطر، والآلية الفيزيولوجية المرضية الرئيسية للأضرار التي تلحق بنظام القلب والأوعية الدموية هي أنجيوتنسين II (ATII). يعد ATII مكونًا رئيسيًا في RAAS - وهو المستجيب الذي ينفذ تضيق الأوعية، واحتباس الصوديوم، وتنشيط الجهاز العصبي الودي، وتكاثر الخلايا وتضخمها، وتطور الإجهاد التأكسدي والتهاب جدار الأوعية الدموية.
حاليًا، تم تطوير فئتين من الأدوية التي تمنع RAAS وتستخدمان على نطاق واسع سريريًا - مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبلات ATII. تختلف التأثيرات الدوائية والسريرية لهذه الفئات. ACE هو ببتيداز من مجموعة البروتينات المعدنية الزنك التي تستقلب ATI، AT1-7، البراديكينين، المادة P والعديد من الببتيدات الأخرى. ترتبط آلية عمل مثبطات الإنزيم المحول للأنجيوتنسين بشكل أساسي بالوقاية من تكوين ATII، الذي يعزز توسع الأوعية الدموية، وإدرار البول الصوديوم، ويزيل التأثيرات المسببة للالتهابات والتكاثرية وغيرها من تأثيرات ATII. بالإضافة إلى ذلك، تمنع مثبطات الإنزيم المحول للأنجيوتنسين تحلل البراديكينين وتزيد مستوياته. البراديكينين هو موسع للأوعية الدموية قوي، فهو يعزز إدرار البول، والأهم من ذلك، أنه له تأثير وقائي للقلب (يمنع تضخم، ويقلل من الأضرار الإقفارية لعضلة القلب، ويحسن إمدادات الدم التاجية) وتأثيرات وقائية للأوعية، ويحسن وظيفة بطانة الأوعية الدموية. في الوقت نفسه، فإن المستوى العالي من البراديكينين هو سبب تطور الوذمة الوعائية، وهي واحدة من العيوب الخطيرة لمثبطات الإنزيم المحول للأنجيوتنسين، والتي تزيد بشكل كبير من مستوى الأقارب.
مثبطات الإنزيم المحول للأنجيوتنسين ليست قادرة دائمًا على منع تكوين ATII في الأنسجة بشكل كامل. لقد ثبت الآن أن الإنزيمات الأخرى غير المرتبطة بـ ACE قد تشارك أيضًا في تحوله في الأنسجة، وخاصة الإندوببتيداز، التي لا تتأثر بمثبطات الإنزيم المحول للأنجيوتنسين. ونتيجة لذلك، لا تستطيع مثبطات الإنزيم المحول للأنجيوتنسين القضاء تمامًا على تأثيرات ATII، مما قد يكون السبب في عدم فعاليتها.
تم تسهيل حل هذه المشكلة من خلال اكتشاف مستقبلات ATII والطبقة الأولى من الأدوية التي تمنع مستقبلات AT1 بشكل انتقائي. من خلال مستقبلات AT1، يتم تحقيق الآثار الضارة لـ ATII: تضيق الأوعية، وإفراز الألدوستيرون، والفازوبريسين، والنورإبينفرين، واحتباس السوائل، وانتشار خلايا العضلات الملساء والخلايا العضلية القلبية، وتفعيل SAS، بالإضافة إلى آلية التغذية الراجعة السلبية - تكوين الرينين. . تؤدي مستقبلات AT2 وظائف "مفيدة"، مثل توسيع الأوعية وعمليات الإصلاح والتجديد والتأثيرات المضادة للتكاثر والتمايز وتطوير الأنسجة الجنينية. يتم التوسط في التأثيرات السريرية لحاصرات مستقبلات ATII من خلال القضاء على التأثيرات "الضارة" لـ ATII على مستوى مستقبلات AT1، مما يضمن حظرًا أكثر اكتمالاً للتأثيرات الضارة لـ ATII وزيادة تأثير ATII على مستقبلات AT2. ، الذي يكمل التأثيرات الموسعة للأوعية الدموية والمضادة للتكاثر. حاصرات مستقبلات ATII لها تأثير محدد على RAAS دون التدخل في نظام الكينين. إن عدم التأثير على نشاط نظام الكينين، من ناحية، يقلل من شدة الآثار غير المرغوب فيها (السعال، والوذمة الوعائية)، ولكن من ناحية أخرى، يحرم حاصرات مستقبلات ATII من تأثير مهم مضاد لنقص تروية الأوعية الدموية وواقي للأوعية. مما يميزها عن مثبطات الإنزيم المحول للأنجيوتنسين. لهذا السبب، فإن مؤشرات استخدام حاصرات مستقبلات ATII تكرر في الغالب مؤشرات استخدام مثبطات الإنزيم المحول للأنجيوتنسين، مما يجعلها أدوية بديلة.
على الرغم من إدخال حاصرات RAAS في الممارسة واسعة النطاق في علاج ارتفاع ضغط الدم، إلا أن مشاكل تحسين النتائج والتشخيص لا تزال قائمة. وتشمل هذه: إمكانية تحسين التحكم في ضغط الدم لدى السكان، وفعالية علاج ارتفاع ضغط الدم المقاوم، وإمكانية تقليل مخاطر الإصابة بأمراض القلب والأوعية الدموية.
يستمر البحث عن طرق جديدة للتأثير على RAAS بنشاط؛ تتم دراسة أنظمة أخرى تتفاعل بشكل وثيق ويتم إنشاء أدوية ذات آليات عمل متعددة، مثل مثبطات الإنزيم المحول للأنجيوتنسين ومثبطات الإندوببتيداز المحايدة (NEP)، ومثبطات الإنزيم المحول للإندوثيلين (ACE) وNEP، ومثبطات الإنزيم المحول للأنجيوتنسين/NEP/EGT.
مثبطات فازوبيبتيداز
بالإضافة إلى ACE المعروف، تشتمل إنزيمات الأوعية الدموية على اثنين آخرين من بروتينات الزنك المعدنية - النيبريليسين (إندوببتيداز محايد، NEP) والإنزيم المحول للإندوثيلين، والذي يمكن أن يكون أيضًا أهدافًا للعمل الدوائي.
النيبريليسين هو إنزيم تنتجه البطانة الوعائية ويشارك في تحلل الببتيد الناتريوتريك، وكذلك البراديكينين.
يتم تمثيل نظام الببتيد الناتريوتريك بثلاثة أشكال إسوية مختلفة: الببتيد الأذيني الناتريوتريك (النوع A)، والببتيد الدماغي الناتريوتريك (النوع B)، والتي يتم تصنيعها في الأذين وعضلة القلب، والببتيد C البطاني، والذي في وظائفه البيولوجية مثبطات داخلية لـ RAAS وendothelin-1 (الجدول 1). تشمل التأثيرات القلبية الوعائية والكلوية للببتيد الناتريوتريك انخفاضًا في ضغط الدم من خلال تأثيره على توتر الأوعية الدموية وتوازن الماء والكهارل، فضلاً عن التأثيرات المضادة للتكاثر والمضادة للليف على الأعضاء المستهدفة. تشير أحدث الأدلة إلى أن نظام الببتيد الناتريوتريك يشارك في تنظيم التمثيل الغذائي: أكسدة الدهون، وتكوين الخلايا الشحمية وتمايزها، وتنشيط الأديبونيكتين، وإفراز الأنسولين، وتحمل الكربوهيدرات، مما قد يوفر الحماية ضد تطور متلازمة التمثيل الغذائي.
لقد أصبح من المعروف الآن أن تطور أمراض القلب والأوعية الدموية يرتبط بخلل تنظيم نظام الببتيد الناتريوتريك. وهكذا، في ارتفاع ضغط الدم هناك نقص في الببتيد الناتريوتريك، مما يؤدي إلى حساسية الملح وضعف بيلة الصوديوم. في قصور القلب المزمن (CHF)، على خلفية النقص، هناك عمل غير طبيعي لهرمونات نظام الببتيد الناتريوتريك.
لذلك، لتعزيز نظام الببتيد الناتريوتريك من أجل تحقيق تأثيرات قلبية إضافية خافضة لضغط الدم ووقائية، من الممكن استخدام مثبطات NEP. يؤدي تثبيط النيبريليسين إلى تعزيز التأثيرات المدرة للصوديوم والمدر للبول وتوسيع الأوعية الدموية للببتيد الناتريوتريك الداخلي، ونتيجة لذلك، يؤدي إلى انخفاض في ضغط الدم. ومع ذلك، فإن NEP يشارك أيضًا في تحلل الببتيدات الأخرى النشطة في الأوعية، وخاصة ATI وATII وendothelin-1. ولذلك، فإن توازن تأثيرات مثبطات NEP على قوة الأوعية الدموية متغير ويعتمد على غلبة التأثيرات القابضة والموسعة. مع الاستخدام طويل الأمد، يكون التأثير الخافض لضغط الدم لمثبطات النيبريليسين ضعيفًا بسبب التنشيط التعويضي لتشكيل ATII وendothelin-1.
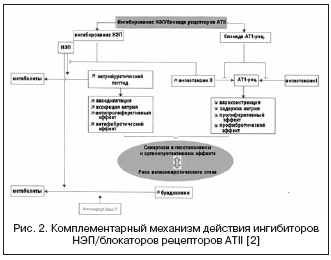
في هذا الصدد، فإن الجمع بين تأثيرات مثبطات الإنزيم المحول للأنجيوتنسين ومثبطات NEP يمكن أن يعزز بشكل كبير تأثيرات الدورة الدموية والتأثيرات المضادة للتكاثر نتيجة لآلية عمل تكميلية، مما أدى إلى إنشاء أدوية ذات آلية عمل مزدوجة، تسمى مجتمعة فاسوببتيداز. مثبطات (الجدول 2، الشكل 1).
تتميز مثبطات فازوبيبتيداز المعروفة بدرجات متفاوتة من الانتقائية لـ NEP/ACE: أوماباتريلات - 8.9:0.5؛ فاسيديبريلات - 5.1:9.8؛ سامباتريلات - 8.0:1.2. ونتيجة لذلك، اكتسبت مثبطات فازوبيبتيداز إمكانات أكبر بكثير لتحقيق تأثير خافض للضغط، بغض النظر عن نشاط RAAS ومستوى احتباس الصوديوم، وفي حماية الأعضاء (تراجع تضخم، بيلة الألبومين، تصلب الأوعية الدموية). أكثر ما تمت دراسته في الدراسات السريرية هو أوماباتريلات، والذي أظهر فعالية أعلى في علاج ارتفاع ضغط الدم مقارنة بمثبطات الإنزيم المحول للأنجيوتنسين، وفي المرضى الذين يعانون من قصور القلب الاحتقاني أدى إلى زيادة في الكسر القذفي وتحسين النتائج السريرية (دراسات IMPRESS، OVERTURE)، ولكن دون مزايا على مثبطات الإنزيم المحول للأنجيوتنسين.
ومع ذلك، في التجارب السريرية الكبيرة التي استخدمت أوماباتريلات، تم العثور على نسبة أعلى من الوذمة الوعائية مقارنة مع مثبطات الإنزيم المحول للأنجيوتنسين. من المعروف أن نسبة الإصابة بالوذمة الوعائية عند استخدام مثبطات الإنزيم المحول للأنجيوتنسين تتراوح من 0.1 إلى 0.5% بين السكان، منها 20% من الحالات تكون مهددة للحياة، وهو ما يرتبط بزيادة متعددة في تركيزات البراديكينين ومستقلباته. أظهرت نتائج دراسة OCTAVE الكبيرة متعددة المراكز (العدد = 25302)، والتي تم تصميمها خصيصًا لدراسة حدوث الوذمة الوعائية، أن حدوث هذا التأثير الجانبي أثناء العلاج باستخدام أوماباتريلات يتجاوز ذلك في مجموعة إنالابريل - 2.17٪ مقابل 0.68٪ ( المخاطر النسبية 3.4). تم تفسير ذلك من خلال التأثير المتزايد على مستويات الكينين مع التثبيط التآزري لـ ACE وNEP، المرتبط بتثبيط أمينوببتيداز P، والذي يشارك في تحلل البراديكينين.
إن مثبط الإنزيم المزدوج للإنزيم الجديد الذي يحجب الإنزيم المحول للأنجيوتنسين/NEP هو ilepatril، الذي يتمتع بقابلية أعلى للإنزيم المحول للأنجيوتنسين مقارنةً بـ NEP. عند دراسة التأثيرات الدوائية للإليباتريل على نشاط RAAS والببتيد الناتريوتريك في متطوعين أصحاء، وجد أن جرعة الدواء تعتمد على جرعة (5 و 25 ملغ) وبشكل ملحوظ (أكثر من 88٪) يثبط الإنزيم المحول للأنجيوتنسين في بلازما الدم لمدة تزيد عن 48 ساعة بغض النظر عن حساسية الملح. وفي الوقت نفسه، أدى الدواء إلى زيادة كبيرة في نشاط الرينين في البلازما خلال 48 ساعة وانخفاض مستويات الألدوستيرون. أظهرت هذه النتائج قمعًا واضحًا وطويل الأمد لـ RAAS على النقيض من مثبط الإنزيم المحول للأنجيوتنسين راميبريل بجرعة 10 ملغ، وهو ما تم تفسيره من خلال التأثير الأكثر أهمية على الأنسجة للإليباتريل على الإنزيم المحول للأنجيوتنسين وزيادة تقارب الإنزيم المحول للأنجيوتنسين، ودرجة مماثلة. من الحصار المفروض على RAAS بالمقارنة مع مزيج من 150 ملغ من إربيسارتان + 10 ملغ من راميبريل. على النقيض من التأثير على RAAS، تجلى تأثير الإليباتريل على الببتيد الناتريوتريك من خلال زيادة قصيرة المدى في مستوى إفرازه في الفترة 4-8 ساعات بعد تناول جرعة قدرها 25 ملغ، مما يدل على انخفاض و تقارب أضعف لـ NEP ويميزه عن omapatrilat. علاوة على ذلك، من حيث مستوى إفراز الإلكتروليت، فإن الدواء ليس له تأثير إضافي مدر للصوديوم مقارنة بالراميبريل أو الإربيسارتان، كما هو الحال مع مثبطات فازوبيبتيداز الأخرى. الحد الأقصى لتأثير انخفاض ضغط الدم يتطور بعد 6-12 ساعة من تناول الدواء، ويكون الانخفاض في متوسط ضغط الدم 5±5 و10±4 مم زئبق. عند حساسية الملح المنخفضة والعالية على التوالي. وفقًا للخصائص الحركية الدوائية، فإن الإليباتريل هو دواء أولي يحتوي على مستقلب نشط، والذي يتشكل بسرعة، ويصل إلى الحد الأقصى للتركيز بعد 1-1.5 ساعة ويتم التخلص منه ببطء. التجارب السريرية للمرحلة الثالثة جارية حاليًا.
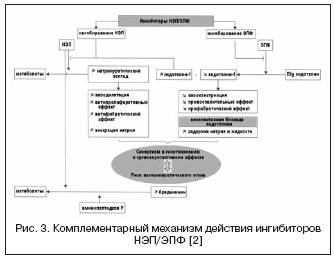
يتم تمثيل طريق بديل للقمع المزدوج لـ RAAS وNEP من خلال مزيج من حصار مستقبلات ATII وNEP (الشكل 2). لا تؤثر حاصرات مستقبلات ATII على استقلاب الأقارب، على عكس مثبطات الإنزيم المحول للأنجيوتنسين، وبالتالي من المحتمل أن تكون أقل عرضة للإصابة بمضاعفات الوذمة الوعائية. حاليًا، الدواء الأول، وهو مانع مستقبل ATII مع تأثير تثبيط NEP بنسبة 1:1، LCZ696، يخضع للتجارب السريرية للمرحلة الثالثة. يحتوي جزيء الدواء المدمج على فالسارتان ومثبط NEP (AHU377) في شكل دواء أولي. في دراسة واسعة النطاق أجريت على مرضى يعانون من ارتفاع ضغط الدم (العدد = 1328)، أظهر LCZ696 بجرعات 200-400 ملغ ميزة في التأثير الخافض لضغط الدم مقارنة بالفالسارتان بجرعات 160-320 ملغ في شكل انخفاض إضافي في ضغط الدم بمقدار 5 مرات. /3 و 6/3 ملم زئبق . . كان التأثير الخافض لضغط الدم لـ LCZ696 مصحوبًا بانخفاض أكثر وضوحًا في ضغط الدم النبضي: بمقدار 2.25 و3.32 ملم زئبق. على التوالي بجرعات 200 و 400 ملغ، والتي تعتبر حاليا عامل إنذار إيجابي للتأثير على تصلب جدار الأوعية الدموية ونتائج القلب والأوعية الدموية. في الوقت نفسه، أظهرت دراسة المؤشرات الحيوية العصبية الهرمونية أثناء العلاج بـ LCZ696 زيادة في مستوى الببتيد الناتريوتريك مع درجة مماثلة من الزيادة في مستوى الرينين والألدوستيرون مقارنة بالفالسارتان. كان التحمل في المرضى الذين يعانون من ارتفاع ضغط الدم جيدًا، ولم تلاحظ أي حالات وذمة وعائية. تم الآن الانتهاء من دراسة PARAMOUMT على 685 مريضًا يعانون من قصور القلب الاحتقاني وEF غير المتضرر. أظهرت نتائج الدراسة أن LCZ696 يقلل بشكل أسرع وبشكل ملحوظ من مستوى NT-proBNP (نقطة النهاية الأولية هي علامة على زيادة نشاط الببتيد المدر للصوديوم وسوء التشخيص في CHF) مقارنةً بالفالسارتان، كما يقلل أيضًا من حجم الجانب الأيسر. الأذين مما يدل على تراجع إعادة تصميمه. تجري حاليًا دراسة على المرضى الذين يعانون من قصور القلب الاحتقاني وانخفاض EF (دراسة PARADIGM-HF).
مثبطات نظام الإندوثيلين
يلعب نظام الإندوثيلين دورًا مهمًا في تنظيم نغمة الأوعية الدموية وتدفق الدم الإقليمي. من بين الأشكال الإسوية الثلاثة المعروفة، يعتبر الإندوثيلين-1 هو الأكثر نشاطًا. بالإضافة إلى تأثيرات مضيق الأوعية المعروفة، يحفز الإندوثيلين تكاثر وتوليف المصفوفة بين الخلايا، وأيضًا بسبب تأثيره المباشر على نغمة الأوعية الكلوية، ويشارك في تنظيم توازن الماء والكهارل. يتم تحقيق تأثيرات الإندوثيلين من خلال التفاعل مع مستقبلات محددة من النوع A والنوع B، والتي تتعارض وظائفها بشكل متبادل: يحدث تضيق الأوعية من خلال مستقبلات من النوع A، ويحدث توسع الأوعية من خلال مستقبلات من النوع B. في السنوات الأخيرة، ثبت أن مستقبلات النوع B تلعب دورًا مهمًا في إزالة الإندوثيلين -1، أي من الخلايا. عندما يتم حظر هذه المستقبلات، يتم تعطيل تصفية الإندوثيلين -1 المعتمدة على المستقبل ويزداد تركيزه. بالإضافة إلى ذلك، تشارك مستقبلات النوع B في تنظيم التأثيرات الكلوية للإندوثيلين-1 والحفاظ على توازن السوائل والكهارل، وهو أمر مهم.
حاليا، تم إثبات دور الإندوثيلين في تطور عدد من الأمراض، بما في ذلك. ارتفاع ضغط الدم، قصور القلب الاحتقاني، ارتفاع ضغط الدم الرئوي، أمراض الكلى المزمنة. وقد ثبت وجود علاقة وثيقة بين مستويات الإندوثيلين ومتلازمة التمثيل الغذائي، والخلل البطاني وتصلب الشرايين. منذ التسعينيات ويجري البحث عن مضادات مستقبلات الإندوثيلين المناسبة للاستخدام السريري؛ 10 أدوية ("sentans") معروفة بالفعل بدرجات متفاوتة من الانتقائية لمستقبلات النوع A/B. أظهر أول مضاد غير انتقائي لمستقبلات الإندوثيلين، بوسنتان، في دراسة سريرية على المرضى الذين يعانون من ارتفاع ضغط الدم فعالية خافضة للضغط مماثلة لتلك الخاصة بمثبط الإنزيم المحول للأنجيوتنسين إنالابريل. أظهرت الدراسات الإضافية حول فعالية استخدام مضادات الإندوثيلين في ارتفاع ضغط الدم أهميتها السريرية في علاج ارتفاع ضغط الدم المقاوم وارتفاع مخاطر القلب والأوعية الدموية. تم الحصول على هذه البيانات من تجربتين سريريتين كبيرتين، DORADO (ن = 379) وDORADO-AC (ن = 849)، حيث تمت إضافة الداروسنتان إلى العلاج المركب الثلاثي في المرضى الذين يعانون من ارتفاع ضغط الدم المقاوم. في دراسة DORADO، تم ملاحظة انخفاض ملحوظ في ضغط الدم لدى المرضى الذين يعانون من ارتفاع ضغط الدم المقاوم مع أمراض الكلى المزمنة والبيلة البروتينية، نتيجة إضافة الداروسنتان، ليس فقط انخفاضًا كبيرًا في ضغط الدم، ولكن أيضًا انخفاضًا في إفراز البروتين. تم تأكيد التأثير المضاد لبروتين البول لمضادات مستقبلات الإندوثيلين لاحقًا في دراسة أجريت على المرضى الذين يعانون من اعتلال الكلية السكري باستخدام أفوسينتان. ومع ذلك، في دراسة DORADO-AS، لم يتم العثور على أي مزايا في خفض ضغط الدم بشكل إضافي مقارنة بالأدوية المقارنة والعلاج الوهمي، وهو ما كان سببًا لإيقاف إجراء المزيد من الدراسات. بالإضافة إلى ذلك، أظهرت 4 دراسات كبيرة لمضادات الإندوثيلين (بوسنتان، داروسنتان، إنراسينتان) في المرضى الذين يعانون من قصور القلب الاحتقاني نتائج متضاربة، وهو ما تم تفسيره بزيادة تركيزات الإندوثيلين -1. تم تعليق المزيد من الدراسة لمضادات مستقبلات الإندوثيلين بسبب الآثار الضارة المرتبطة باحتباس السوائل (الوذمة المحيطية، الحمل الزائد للحجم). ويرتبط تطور هذه التأثيرات بتأثير مضادات الإندوثيلين على مستقبلات النوع B، مما أدى إلى تغيير البحث عن الأدوية التي تؤثر على نظام الإندوثيلين من خلال مسارات أخرى؛ ومضادات مستقبلات الإندوثيلين لديها حاليًا مؤشر واحد فقط - علاج ارتفاع ضغط الدم الرئوي.
مع الأخذ في الاعتبار الأهمية العالية لنظام الإندوثيلين في تنظيم نغمة الأوعية الدموية، يجري البحث عن آلية أخرى للعمل من خلال الفاسوببتيداز - EPF، الذي يشارك في تكوين الإندوثيلين النشط -1 (الشكل 3). إن حجب الإنزيم المحول للأنجيوتنسين ودمجه مع تثبيط NEP يمكن أن يمنع بشكل فعال تكوين الإندوثيلين -1 ويعزز تأثيرات الببتيد الناتريوتريك. تتمثل مزايا آلية العمل المزدوجة، من ناحية، في منع عيوب مثبطات NEP المرتبطة بتضيق الأوعية المحتمل بوساطة تنشيط الإندوثيلين، ومن ناحية أخرى، يسمح النشاط المدر للصوديوم لمثبطات NEP بالتعويض عن احتباس السوائل المرتبط بـ الحصار غير الانتقائي لمستقبلات الإندوثيلين. Daglutril هو مثبط مزدوج NEP وACE وهو في المرحلة الثانية من التجارب السريرية. أظهرت الدراسات تأثيرات وقائية قلبية واضحة للدواء بسبب انخفاض إعادة تشكيل القلب والأوعية الدموية وتراجع التضخم والتليف.
مثبطات الرينين المباشرة
من المعروف أن مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبلات ATII تزيد من نشاط الرينين من خلال آلية التغذية المرتدة، وهذا هو السبب وراء عدم فعالية حاصرات RAAS. يمثل رينين الخطوة الأولى في سلسلة RAAS؛ يتم إنتاجه بواسطة الخلايا المجاورة للكبيبات في الكلى. يعزز الرينين، من خلال مولد الأنجيوتنسين، تكوين ATII، وتضيق الأوعية الدموية وإفراز الألدوستيرون، وينظم أيضًا آليات التغذية الراجعة. ولذلك، فإن تثبيط الرينين يسمح لنا بتحقيق حصار أكثر اكتمالا لنظام RAAS. البحث عن مثبطات الرينين مستمر منذ السبعينيات. لفترة طويلة، لم يكن من الممكن الحصول على شكل فموي من مثبطات الرينين بسبب توافرها البيولوجي المنخفض في الجهاز الهضمي (أقل من 2٪). تم تسجيل أول مثبط مباشر للرينين مناسب للاستخدام عن طريق الفم، أليسكيرين، في عام 2007. يتمتع أليسكيرين بتوافر حيوي منخفض (2.6%)، ونصف عمر طويل (24-40 ساعة)، وطريق للتخلص من خارج الكلى. ترتبط الديناميكيات الدوائية للأليسكيرين بانخفاض قدره 80% في مستويات ATII. في الدراسات السريرية في المرضى الذين يعانون من ارتفاع ضغط الدم، أدى تناول أليسكيرين بجرعات 150-300 ملغ / يوم إلى انخفاض في ضغط الدم الانقباضي بنسبة 8.7-13 و14.1-15.8 ملم زئبقي. على التوالي، وDBP - بنسبة 7.8-10.3 و10.3-12.3 ملم زئبق. . وقد لوحظ تأثير انخفاض ضغط الدم من أليسكيرين في مجموعات فرعية مختلفة من المرضى، بما في ذلك المرضى الذين يعانون من متلازمة التمثيل الغذائي والسمنة. كانت الشدة مماثلة لتأثير مثبطات الإنزيم المحول للأنجيوتنسين وحاصرات مستقبلات ATII، ولوحظ أيضًا تأثير إضافي بالاشتراك مع فالسارتان وهيدروكلوروثيازيد وأملوديبين. أظهر عدد من الدراسات السريرية التأثيرات الوقائية للعضوية للدواء: تأثير مضاد للبروتين في المرضى الذين يعانون من اعتلال الكلية السكري (دراسة AVOID، ن = 599)، وتراجع تضخم البطين الأيسر في المرضى الذين يعانون من ارتفاع ضغط الدم (دراسة ALLAY، ن = 465). وهكذا، في دراسة AVOID، بعد 3 أشهر من العلاج باللوسارتان بجرعة 100 ملغ / يوم وتحقيق مستوى ضغط الدم المستهدف (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
بالإضافة إلى ذلك، يتم إجراء سلسلة من الدراسات السريرية للأليسكيرين في علاج أمراض القلب والأوعية الدموية الأخرى لتقييم التأثير على تشخيص المرضى: ALOFT (ن = 320)، رائد الفضاء (ن = 1639)، الغلاف الجوي (ن = 7000) ) دراسات على المرضى الذين يعانون من قصور القلب الاحتقاني، ودراسة ALTITUDE على المرضى الذين يعانون من داء السكري وارتفاع مخاطر الإصابة بأمراض القلب والأوعية الدموية، ودراسة ASPIRE على المرضى الذين يعانون من إعادة التشكيل بعد الاحتشاء.
خاتمة
لحل مشاكل الوقاية من أمراض القلب والأوعية الدموية، يستمر إنشاء أدوية جديدة ذات آلية عمل متعددة ومعقدة، مما يسمح بحصار أكثر اكتمالاً لـ RAAS من خلال سلسلة من آليات تنظيم الدورة الدموية والعصبية الهرمونية. إن التأثيرات المحتملة لهذه الأدوية تجعل من الممكن ليس فقط توفير تأثير إضافي خافض لضغط الدم، ولكن أيضًا تحقيق التحكم في ضغط الدم لدى المرضى المعرضين لمخاطر عالية، بما في ذلك ارتفاع ضغط الدم المقاوم. تظهر الأدوية ذات آليات العمل المتعددة مزايا في تأثير وقائي عضوي أكثر وضوحًا، مما سيمنع المزيد من الضرر لنظام القلب والأوعية الدموية. تتطلب دراسة فوائد الأدوية الجديدة التي تمنع RAAS إجراء المزيد من البحث وتقييم تأثيرها على تشخيص المرضى الذين يعانون من ارتفاع ضغط الدم وأمراض القلب والأوعية الدموية الأخرى.


الأدب
1. كامبل دي جي. تثبيط فازوبيبتيداز: سيف ذو حدين؟ // ارتفاع ضغط الدم. 2003. المجلد. 41. ص383-389.
2. Laurent S.، Schlaich M.، Esler M. أدوية وإجراءات وأجهزة جديدة لارتفاع ضغط الدم // لانسيت. 2012. المجلد. 380. ص591-600.
3. كورتي آر، بورنيت جي سي، رولو جيه إل. وآخرون. مثبطات Vasopeptidase: مفهوم علاجي جديد في أمراض القلب والأوعية الدموية؟ // الدوران. 2001. المجلد. 104. ص 1856-1862.
4. مانجيافيكو إس.، كوستيلو-بويريجتر إل.سي.، أندرسن آي.إيه. وآخرون. تثبيط الإندوببتيداز المحايد ونظام الببتيد الناتريوتريك: استراتيجية متطورة في علاجات القلب والأوعية الدموية // يورو. القلب ج. 2012، دوى:10.1093/eurheartj/ehs262.
5. رولو جي إل، فيفر إم إيه، ستيوارت دي جي. وآخرون. مقارنة مثبطات فازوبيبتيداز، أوماباتريلات، وليسينوبريل على تحمل التمارين والمراضة لدى المرضى الذين يعانون من قصور القلب: تجربة عشوائية IMPRESS // لانسيت. 2000. المجلد. 356. ص 615-620.
6. باكر إم.، كاليف آر. إم.، كونستام إم. إيه. وآخرون. مقارنة بين أوماباتريلات وإنالابريل في المرضى الذين يعانون من قصور القلب المزمن: تجربة أوماباتريلات مقابل إنالابريل العشوائية للمنفعة في تقليل الأحداث (المقدمة) // الدورة الدموية. 2002. المجلد. 106. ص 920-926.
7. وارنر كيه كيه، فيسكونتي جيه إيه، تشامبل إم إم. حاصرات مستقبلات الأنجيوتنسين II في المرضى الذين يعانون من الوذمة الوعائية الناجمة عن مثبطات الإنزيم المحول للأنجيوتنسين // آن. فارماكوثر. 2000. المجلد. 34. ص526-528.
8. كوستيس جي.بي.، باكر إم.، بلاك إتش.آر. وآخرون. أوماباتريلات وإنالابريل في المرضى الذين يعانون من ارتفاع ضغط الدم: تجربة أوماباتريلات لعلاج القلب والأوعية الدموية مقابل إنالابريل (OCTAVE) // صباحا. J. ارتفاع ضغط الدم. 2004. المجلد. 17. ص103-111.
9. عزيزي م.، بيسري أ.، بيرارد إس وآخرون. الحرائك الدوائية والديناميكا الدوائية لمثبط الأوعية الدموية AVE7688 في البشر // كلين. فارماكول. هناك. 2006. المجلد. 79. ص49-61.
10. غو جيه، نوي أ، شاندرا بي وآخرون. الحرائك الدوائية والديناميكا الدوائية لـ LCZ696، مثبط النيبريليسين لمستقبلات الأنجيوتنسين ثنائي المفعول (ARNi) // J. Clin. فارماكول. 2010. المجلد. 50. ص401-414.
11. رويلوب إل إم، دوكات أ، بوم إم وآخرون. خفض ضغط الدم باستخدام LCZ696، وهو مثبط جديد ثنائي المفعول لمستقبلات الأنجيوتنسين II والنيبريليسين: دراسة مقارنة نشطة عشوائية مزدوجة التعمية ومراقبة بالعلاج الوهمي // لانسيت. 2010. المجلد. 375. ص1255-1266.
12. سولومون إس دي، زيلي إم، بيسكي بي وآخرون. مثبط مستقبلات الأنجيوتنسين النيبريليسين LCZ696 في قصور القلب مع الكسر القذفي المحفوظ: تجربة عشوائية محكومة مزدوجة التعمية من المرحلة الثانية // لانسيت. 2012. المجلد. 380(9851). ص1387-1395.
13. ليفين إ.ر. Endothelins // N. Engl. جيه ميد. 1995. المجلد. 333. ص 356-363.
14. داون إن، جودارد جيه، كوهان دي. وآخرون. دور الإندوثيلين -1 في ارتفاع ضغط الدم السريري: بعد 20 عامًا // ارتفاع ضغط الدم. 2008. المجلد. 52. ص452-459.
15. Burnier M.، Forni V. Endothelin مضادات مستقبلات: مكان في إدارة ارتفاع ضغط الدم الأساسي؟ // نيفرول. يتصل. زرع اعضاء. 2011. 0: 1-4. دوى: 10.1093/ndt/gfr704.
16. كروم إتش، فيسكوبر آر جيه، لاكورسيير واي وآخرون. تأثير مضاد مستقبلات الإندوثيلين، بوسنتان، على ضغط الدم لدى المرضى الذين يعانون من ارتفاع ضغط الدم الأساسي. محققو ارتفاع ضغط الدم في بوسنتان // N. Engl. جيه ميد. 1998. المجلد. 338. ص 784-790.
17. ويبر إم إيه، بلاك إتش، باكريس جي وآخرون. خصم انتقائي لمستقبلات الإندوثيلين لتقليل ضغط الدم لدى المرضى الذين يعانون من ارتفاع ضغط الدم المقاوم للعلاج: تجربة عشوائية مزدوجة التعمية وهمي تسيطر عليها // لانسيت. 2009. المجلد. 374. ص1423-1431.
18. باكريس جي إل، ليندهولم إل إتش، بلاك إتش آر وآخرون. نتائج متباينة باستخدام ضغط الدم السريري والإسعافي: تقرير عن تجربة ارتفاع ضغط الدم المقاوم للداروسنتان // ارتفاع ضغط الدم. 2010. المجلد. 56. ص 824-830.
19. مان ج.ف.، جرين د.، جامرسون ك. وآخرون. Avosentan لاعتلال الكلية السكري العلني // J. Am. شركة نفط الجنوب. نيفرول. 2010. المجلد. 21. ص527-535.
20. كالك بي، شاركوفسكا واي، كاشينا إي وآخرون. يمنع إنزيم تحويل الإندوثيلين / مثبط الإندوببتيداز المحايد SLV338 إعادة تشكيل القلب الناتج عن ارتفاع ضغط الدم بطريقة مستقلة عن ضغط الدم // ارتفاع ضغط الدم. 2011. المجلد. 57. ص755-763.
21. نوسبيرجر جيه، فورتزنر جي، جنسن سي وآخرون. قمع أنجيوتنسين II في البشر عن طريق مثبط الرينين النشط نظريًا أليسكيرين (SPP100): مقارنة مع إنالابريل // ارتفاع ضغط الدم. 2002. المجلد. 39(1). ص.E1-8.
22. ألريجا ج.، جوزيف ج. رينين وأمراض القلب والأوعية الدموية: طريق مهترئ أم اتجاه جديد؟ // العالم جي كارديول. 2011. المجلد. 3(3). ص72-83.
23. إنجلفينجر جي.آر. أليسكيرين والعلاج المزدوج لمرض السكري من النوع 2 // N. Engl. جيه ميد. 2008. المجلد. 358(23). ص 2503-2505.
24. Pouleur A.S.، Uno H.، Prescott M.F.، Desai A. (للمحققين ALLAY). قمع الألدوستيرون يتوسط تراجع تضخم البطين الأيسر في المرضى الذين يعانون من ارتفاع ضغط الدم // J. نظام رينين أنجيوتنسين-ألدوستيرون. 2011. المجلد. 12. ص483-490.
25. كيلي دي جي، تشانغ واي، مو جي وآخرون. أليسكيرين، وهو مثبط جديد للرينين، يعمل على حماية الكلى في نموذج من اعتلال الكلية السكري المتقدم في الفئران // ديابيتول. 2007. المجلد. 50. ص2398-2404.


