Aldosteron je kod ljudi glavni predstavnik mineralokortikoidnih hormona koji potječu od kolesterola.
Sinteza
Provodi se u glomerularnoj zoni kore nadbubrežne žlijezde. Nastao iz kolesterola, progesteron prolazi sekvencijalnu oksidaciju na svom putu do aldosterona. 21-hidroksilaza, 11-hidroksilaze i 18-hidroksilaze. Na kraju se stvara aldosteron.

Shema sinteze steroidnih hormona (potpuna shema)
Regulacija sinteze i sekrecije
Aktivirati:
- angiotenzin II oslobađa se tijekom aktivacije renin-angiotenzinskog sustava,
- povećana koncentracija ioni kalija u krvi (povezano s depolarizacijom membrane, otvaranjem kalcijevih kanala i aktivacijom adenilat ciklaze).
Aktivacija renin-angiotenzinskog sustava
- Postoje dvije početne točke za aktiviranje ovog sustava:
- smanjenje tlaka u aferentnim arteriolama bubrega, što se utvrđuje baroreceptori stanice jukstaglomerularnog aparata. Razlog za to može biti bilo kakvo kršenje bubrežnog protoka krvi - ateroskleroza. bubrežne arterije, povećana viskoznost krvi, dehidracija, gubitak krvi itd.
- smanjenje koncentracije Na + iona u primarnom urinu u distalnim tubulima bubrega, što određuju osmoreceptori stanica jukstaglomerularnog aparata. Javlja se kao posljedica dijete bez soli, s produljenom uporabom diuretika.
Izlučivanje renina (baznog) održava simpatički živčani sustav, konstantno i neovisno o bubrežnom protoku krvi.
- Prilikom izvođenja jedne ili obje stavke ćelije jukstaglomerularni aparat aktiviraju se i iz njih se enzim izlučuje u krvnu plazmu renin.
- U plazmi postoji supstrat za renin - protein frakcije α2-globulina angiotenzinogen. Kao rezultat proteolize nastaje dekapeptid tzv angiotenzin I. Nadalje, angiotenzin I uz sudjelovanje angiotenzin konvertirajući enzim(ACE) pretvara se u angiotenzin II.
- Glavne mete angiotenzina II su glatki miociti. krvne žile I glomerularni korteks nadbubrežne žlijezde:
- stimulacija krvnih žila uzrokuje njihov spazam i oporavak krvni tlak.
- luče nadbubrežne žlijezde nakon stimulacije aldosteron djelujući na distalne tubule bubrega.
Kada su izloženi aldosteronu, tubuli bubrega povećavaju reapsorpciju Na + ioni, prateći natrijeve poteze voda. Kao rezultat toga dolazi do ponovnog uspostavljanja tlaka u krvožilnom sustavu i povećanja koncentracije natrijevih iona u krvnoj plazmi, a samim tim i u primarnom urinu, što smanjuje aktivnost RAAS-a.

Aktivacija renin-angiotenzin-aldosteronskog sustava
Mehanizam djelovanja
Citosolni.
Mete i učinci
Utječe žlijezde slinovnice, na distalnim tubulima i sabirnim kanalićima bubrega. Pojačava u bubrezima reapsorpcija natrijevih iona i gubitak iona kalija kroz sljedeće učinke:
- povećava količinu Na + ,K + -ATPaze za bazalna membrana epitelne stanice,
- potiče sintezu mitohondrijskih proteina i povećanje količine proizvedene energije u stanici za rad Na+, K+-ATPaze,
- potiče stvaranje Na-kanala na apikalnoj membrani epitelnih stanica bubrega.
Patologija
hiperfunkcija
Connov sindrom (primarni aldosteronizam) - javlja se s adenomima glomerularne zone. Karakterizira ga trijas znakova: hipertenzija, hipernatrijemija, alkaloza.
Sekundarna hiperaldosteronizam - hiperplazija i hiperfunkcija jukstaglomerularnih stanica te prekomjerno lučenje renina i angiotenzina II. Postoji povećanje krvnog tlaka i pojava edema.
Sustav renin-angiotenzin-aldosteron je kompleks enzima i hormona koji održavaju homeostazu. Regulira ravnotežu soli i vode u tijelu te razinu krvnog tlaka.
Radni mehanizam
Fiziologija sustava renin-angiotenzin-aldosteron nastaje na granici korteksa i tamo gdje se nalaze jukstaglomerularne stanice koje proizvode peptidazu (enzim) - renin.
Renin je hormon i početna karika RAAS-a.
Situacije u kojima se renin oslobađa u krv
Postoji nekoliko stanja u kojima hormon ulazi u krvotok:
- Smanjeni protok krvi u tkivu bubrega - s upalnim procesima (glomerulonefritis, itd.), s dijabetička nefropatija, tumori bubrega.
- Smanjenje (s krvarenjem, opetovanim povraćanjem, proljevom, opeklinama).
- Pad krvnog tlaka. U arterijama bubrega nalaze se baroreceptori koji reagiraju na promjene u sustavnom tlaku.
- Promjena koncentracije natrijevih iona. U ljudskom tijelu postoje nakupine stanica koje reagiraju na promjene u ionskom sastavu krvi poticanjem proizvodnje renina. Sol se gubi obilno znojenje kao i povraćanje.
- Stres, psiho-emocionalni stres. Bubrege inerviraju simpatički živci, koji se aktiviraju negativnim psihološkim utjecajima.
U krvi se renin susreće s proteinom - angiotenzinogenom, koji proizvode stanice jetre i uzimaju fragment iz njega. Stvara se angiotenzin I, koji je izvor djelovanja angiotenzin-konvertirajućeg enzima (ACE). Rezultat je angiotenzin II, koji služi kao druga veza i snažan je vazokonstriktor. arterijski sustav(sužava krvne žile).
Učinci angiotenzina II
Svrha: povećati arterijski tlak.
- Promiče sintezu aldosterona u glomerularnoj zoni kore nadbubrežne žlijezde.
- Utječe na središte gladi i žeđi u mozgu, izazivajući "slani" apetit. Ljudsko ponašanje postaje motivirano da traži vodu i slanu hranu.
- Utječe simpatički živci, pospješujući oslobađanje norepinefrina, koji je također vazokonstriktor, ali manje slabog djelovanja.
- Utječe na krvne žile, uzrokujući njihov grč.
- Sudjeluje u razvoju kroničnog zatajenja srca: potiče proliferaciju, vaskularnu i miokardijalnu fibrozu.
- Smanjuje
- Inhibira proizvodnju bradikinina.

Aldosteron je treća komponenta koja djeluje na završne tubule bubrega i pospješuje izlučivanje iona kalija i magnezija iz tijela te reapsorpciju (reapsorpciju) natrija, klora i vode. Zbog toga se povećava volumen cirkulirajuće tekućine, krvni tlak se povećava, a bubrežni protok krvi se povećava. Receptori za aldosteron prisutni su ne samo u bubrezima, već iu srcu i krvnim žilama.
Kada tijelo postigne homeostazu, počinju se proizvoditi vazodilatatori (tvari koje šire krvne žile) - bradikinin i kalidin. A komponente RAAS-a uništavaju se u jetri.
Shema renin-angiotenzin-aldosteronskog sustava

Kao i svaki sustav, RAAS može zakazati. Patofiziologija sustava renin-angiotenzin-aldosteron manifestira se u sljedećim uvjetima:
- Oštećenje kore nadbubrežne žlijezde (infekcija, krvarenje i trauma). Razvija se stanje nedostatka aldosterona, a tijelo počinje gubiti natrij, klorid i vodu, što dovodi do smanjenja volumena cirkulirajuće tekućine i pada krvnog tlaka. Stanje se nadoknađuje uvodom slane otopine i stimulanse aldosteronskih receptora.
- Tumor kore nadbubrežne žlijezde dovodi do viška aldosterona, koji ostvaruje svoje učinke i povećava krvni tlak. Aktiviraju se i procesi diobe stanica, dolazi do hipertrofije i fibroze miokarda, razvija se zatajenje srca.
- Patologija jetre, kada je uništavanje aldosterona poremećeno i dolazi do njegove akumulacije. Patologija se liječi blokatorima aldosteronskih receptora.
- Upalne bolesti bubrega.

Značenje RAAS-a za život i medicinu
Renin-angiotenzin-aldosteronski sustav i njegova uloga u tijelu:
- prihvaća Aktivno sudjelovanje u održavanju normalnog pokazatelja krvnog tlaka;
- osigurava ravnotežu vode i soli u tijelu;
- održava acidobaznu ravnotežu krvi.
Sustav se može srušiti. Djelujući na njegove komponente, možete se boriti protiv hipertenzije. Mehanizam nastanka bubrežne hipertenzije također je usko povezan s RAAS-om.
Visoko učinkovite skupine lijekova koje su sintetizirane zahvaljujući proučavanju RAAS-a
- "Prily". AS. Angiotenzin I se ne pretvara u angiotenzin II. Nema vazokonstrikcije - nema povećanja krvnog tlaka. Pripreme: Amprilan, Enalapril, Captopril itd. ACE inhibitori značajno poboljšavaju kvalitetu života dijabetičara, osiguravajući prevenciju zatajenja bubrega. Lijekovi se uzimaju u minimalnim dozama, što ne uzrokuje smanjenje tlaka, već samo poboljšava lokalni protok krvi i glomerularnu filtraciju. Lijekovi su neophodni kod zatajenja bubrega, kronične bolesti srca i služe kao jedno od sredstava za liječenje hipertenzije (ako nema kontraindikacija).
- "Sartani". Blokatori receptora angiotenzina II. Žile ne reagiraju na njega i ne skupljaju se. Lijekovi: Losartan, Eprosartan itd.

Suprotnost renin-angiotenzin-aldosteronskom sustavu je kininski sustav. Stoga blokiranje RAAS-a dovodi do povećanja krvnih komponenti kininskog sustava (bradikinin, itd.), Što povoljno utječe na tkiva srca i krvnih žila. Miokard ne doživljava gladovanje, jer bradikinin pojačava lokalni protok krvi, stimulira proizvodnju prirodnih vazodilatatora u stanicama bubrežne srži i mikrocitima sabirnih kanalića - prostaglandina E i I2. Oni neutraliziraju presorsko djelovanje angiotenzina II. Žile nisu spazmodične, što osigurava odgovarajuću opskrbu krvlju organa i tkiva tijela, krv se ne zadržava i smanjuje se stvaranje aterosklerotskih plakova i krvnih ugrušaka. Kinini povoljno djeluju na bubrege, pojačavaju diurezu (dnevno izlučivanje urina).
Renin
- enzim koji sintetiziraju jukstaglomerularne stanice bubrežnih aferentnih arteriola, s MM od oko 40 kDa. Osobito intenzivno stvaranje renina događa se tijekom ishemije bubrega. Lokalizacija jukstaglomerularnih stanica čini ih posebno osjetljivima na promjene krvnog tlaka, kao i koncentracije Na+ i K+ iona u tekućini koja teče kroz bubrežne tubule. Zbog ovih svojstava svaka kombinacija čimbenika koja uzrokuje smanjenje volumena tekućine (dehidracija, pad krvnog tlaka, gubitak krvi itd.) ili smanjenje koncentracija NaCl stimulira oslobađanje renina.
Istodobno, većina regulatora sinteze renina djeluje putem bubrežnih baroreceptora. Na otpuštanje renina utječe stanje središnjeg živčanog sustava, kao i promjena položaja tijela u prostoru. Osobito kod prelaska iz ležećeg u sjedeći ili stojeći položaj (klinostatički test) povećava se lučenje renina. Ova refleksna reakcija nastaje zbog povećanja tonusa simpatičkog dijela autonomnog živčanog sustava živčani sustav, koji prenosi impulse do b-adrenergičkih receptora jukstaglomerularnih stanica.
Glavni supstrat na koji renin djeluje je angiotenzinogen- protein koji je dio a 2 -globulinske frakcije, a stvara ga jetra. Pod utjecajem glukokortikoida i estrogena značajno se povećava sinteza angiotenzinogena. Kao rezultat djelovanja renina, angiotenzinogen se pretvara u dekapeptid angiotenzinja Ovaj spoj ima izrazito slab učinak i nema značajan utjecaj na razinu krvnog tlaka.
U međuvremenu angiotenzinja pod utjecajem tzv angiotenzin konvertirajući enzim (ACE) pretvara se u snažan vazokonstriktorni faktor - angiotenzinII. AS(dipeptidecarboxypeptidase) je integralni protein smješten uglavnom na membrani endotelnih stanica, epitela, mononuklearnih stanica, živčanih završetaka, stanica reproduktivnih organa itd. Topljivi oblik ACE prisutan je u gotovo svim tjelesnim tekućinama.
Uobičajeno je razlikovati dvije izoforme ACE. Prvi od njih dobio je kodni naziv "somatski". Ova izoforma ima MM od 170 kDa i uključuje homologne C i N domene. Drugi oblik ACE ("reproduktivni") nalazi se u sjemenoj tekućini, ima MM od oko 100 kDa i odgovara C-domeni prve izoforme ACE. Svaka od 2 navedene domene sadrži aminokiselinske ostatke koji mogu sudjelovati u stvaranju veze s atomom cinka. Takve Zn 2+ strukture tipične su za mnoge metaloproteinaze i glavna su mjesta interakcije enzima sa supstratom i ACE inhibitorima.
Treba napomenuti da ACE ne dovodi samo do formiranja angiotenzin II, ali i uništava bradikinin - veza koja se širi krvne žile. Stoga je povišenje krvnog tlaka pod utjecajem ACE povezano i sa stvaranjem angiotenzina II i s razgradnjom bradikinina (slika 32).
Važnu ulogu za djelovanje ACE igra ionski sastav, a posebno sadržaj kloridnih iona. Dakle, pri visokoj koncentraciji Cl - C-domena ACE hidrolizira i bradikinin i angiotenzin-I brže nego N-domena. U izvanstaničnim regijama, gdje je koncentracija kloridnih aniona visoka, N-domena je pretežno odgovorna za konverziju angiotenzina-I. Međutim, intracelularno, gdje je koncentracija Cl niska, N-domena može sudjelovati u hidrolizi drugih peptidnih tvari.
Iza posljednjih godina utvrđeno je da ACE igra važnu ulogu u hematopoezi, jer pod njegovim utjecajem dolazi do stvaranja hematopoetski peptid inhibirajući stvaranje hematopoetskih stanica u koštanoj srži.
Uloga ACE-a u tijelu identificirana je kod miševa kojima nedostaje ACE gen. Kod takvih životinja zabilježen je nizak krvni tlak, razne vaskularne disfunkcije, oštećena struktura i funkcija bubrega te neplodnost mužjaka.
AngiotenzinII
povećava krvni tlak uzrokujući suženje arteriola i najjače je poznato vazoaktivno sredstvo. Osim toga, inhibira stvaranje i otpuštanje renina iz jukstaglomerularnih stanica bubrega mehanizmom povratne sprege, što bi u konačnici trebalo vratiti normalne razine krvnog tlaka. Pod utjecajem angiotenzinII proizvodnja glavnog mineralokortikoida naglo se povećava - aldosteron. Iako je ovo djelovanje izravno, angiotenzin II ne utječe na proizvodnju kortizola. Glavna svrha aldosterona je zadržavanje Na + (povećavanjem njegove reapsorpcije u bubrežnim tubulima) i otpuštanje K + i H + (uglavnom kroz bubrege). Ove reakcije se izvode na sljedeći način.
Aldosteron
prodire iz izvanstanične tekućine u citoplazmu stanice i tamo se spaja sa specifičnim receptorom, nakon čega nastali kompleks (aldosteron + receptor) prodire u jezgru. Aldosteron također potiče otvaranje Na + kanala, zbog čega ioni Na + ulaze u stanicu kroz apikalnu membranu iz lumena tubula.
Povećanje lučenja K+ pod utjecajem aldosterona nastaje zbog povećanja propusnosti apikalne membrane u odnosu na te ione, zbog čega K+ ulazi iz stanice u lumen tubula.
Zadržavanje Na + u tijelu, poput angiotenzina II, doprinosi povećanju krvnog tlaka.
AngiotenzinII mogu se vezati na specifične receptore na glomerularnim stanicama nadbubrežne žlijezde. Sadržaj ovih receptora uvelike ovisi o koncentraciji K + iona. Dakle, ako se razina K + povećava, tada se povećava broj receptora za angiotenzin II u glomerularnim stanicama. Sa smanjenjem koncentracije K + iona, bilježi se suprotan učinak. Stoga ioni K + igraju glavnu ulogu u djelovanju angiotenzina II na nadbubrežne žlijezde.
Iza U zadnje vrijeme odredio da angiotenzinII sposobni aktivirati makrofage, čime se povećava agregacija trombocita i ubrzava zgrušavanje krvi. Istovremeno, oslobađa inhibitor aktivatora plazminogen-ja (IAP-1),što može biti praćeno depresijom fibrinolize. A ngiotenzinII jedan je od čimbenika koji pridonose razvoju aterogeneze, inhibiciji apoptoze i povećanom oksidativnom stresu u tkivima, čime izazivaju agregaciju trombocita i trombozu.
AngiotenzinII je u stanju poboljšati funkciju miokarda, uključen je u biosintezu norepinefrina i drugih fiziološki aktivnih tvari. Istodobno, može djelovati kao faktor rasta, što dovodi do vaskularne i srčane hipertrofije.
Neke životinje i ljudi angiotenzinII pod utjecajem enzima aminopeptidaze pretvara u heptapeptid angiotenzinIII. U ljudi je razina angiotenzina II približno 4 puta viša od razine angiotenzina III. Oba ova spoja utječu na krvni tlak i proizvodnju aldosterona, a enzimi ih prilično brzo razgrađuju. angiotenzinaza.
Kod teških bolesti bubrega praćenih njihovom ishemijom, zbog povećanog stvaranja i izlučivanja renina, opaža se trajno povišenje krvnog tlaka ( bubrežna hipertenzija). Primjena ACE inhibitora u ovim stanjima dovodi do brze normalizacije krvnog tlaka.
Zaključno, treba još jednom naglasiti da je angiotenzin-renino-aldosteronski sustav usko povezan s funkcijom kalikrein-kinin sustava, jer se stvaranje angiotenzina II i razgradnja bradikinina odvija pod utjecajem istog. enzim - ACE.
Catad_theme Arterijska hipertenzija- članci
Catad_tema Pretilost - Članci
Pretilost i arterijska hipertenzija
Objavljeno u časopisu:PROBLEMI ZDRAVLJA ŽENA № 4, svezak 3, 2008.
E.I.Astaškin, M.G.Glezer
Moskovska medicinska akademija. I. M. Sechenov
SAŽETAK
U pregledu se analizira uloga pretilosti u razvoju arterijske hipertenzije i kardiovaskularne bolesti, patofiziološki mehanizmi ovog odnosa, dominantna uloga renin-angiotenzin-aldosteronskog sustava (RAAS). Raspravlja se o farmakološkoj korekciji visokog krvnog tlaka u pretilih bolesnika primjenom fiksne kombinacije blokatora RAAS i verapamila. Prikazana je analiza učinkovitosti i sigurnosti primjene sibutramina za mršavljenje u bolesnika s povišenim krvnim tlakom.
Ključne riječi: pretilost, arterijska hipertenzija, liječenje.
SAŽETAK
Autori su analizirali ulogu pretilosti u razvoju arterijske hipertenzije i kardiovaskularnih bolesti, patofiziološke mehanizme te povezanosti, te dominantnu ulogu renin-angiotenzin-aldosteronskog sustava (RAAS). Pokazalo se da je farmakološka korekcija visokog krvnog tlaka u bolesnika s pretilošću fiksnom kombinacijom blokatora RAAS i verapamila učinkovita. Prikazana je analiza učinkovitosti i sigurnosti sibutramina za mršavljenje u bolesnika s povišenim krvnim tlakom.
ključne riječi: pretilost, arterijska hipertenzija, liječenje.
Relevantnost teme koja se razmatra je zbog činjenice da je u cijelom svijetu posljednjih godina došlo do značajnog porasta broja pretilih ljudi. Pretilost se danas smatra jednim od glavnih čimbenika koji pridonose razvoju bolesti, koje su glavni uzroci u strukturi smrtnosti odrasle populacije. Kao prvo pričamo o razvoju dijabetes melitusa tipa 2, kao i kardiovaskularnih i onkološke bolesti. Povećanje tjelesne težine za 1 kg povećava rizik od kardiovaskularnih bolesti za 3,1% i dijabetesa za 4,5-9%.
Poznato je da je kod pretilosti rizik od razvoja arterijske hipertenzije - faktora koji značajno utječe i na pojavu kardiovaskularnih bolesti poput srčanog i moždanog udara - tri puta veći nego kod osoba s normalnom tjelesnom težinom. Kao što je pokazalo istraživanje INTERSALT, za svakih 4,5 kg povećanja tjelesne težine, sistolički krvni tlak (BP) raste za 4,5 mm Hg. Umjetnost. .
Pretilost kao faktor rizika kod žena s arterijska hipertenzija, osobito u starijoj dobi, češći je nego u muškaraca. Jedan od razloga tome je hipoestrogenizam koji se javlja u razdoblju postmenopauze. Uočene su neke značajke prevalencije pretilosti u različitim vrstama arterijske hipertenzije. Dakle, među starijim ženama s izoliranom sistoličkom hipertenzijom pretilost nije tako česta, a nema podataka o učinku gubitka težine na ovu kategoriju bolesnika. U žena s abdominalnom pretilošću, sa sistoličko-dijastoličkim oblicima arterijske hipertenzije, gubitak težine je važna točka u kontroli bolesti.
Kod pretilosti dolazi do niza hemodinamskih promjena, posebice povećanja volumena cirkulirajuće krvi, udarnog volumena i minutnog volumena srca uz relativno normalan vaskularni otpor. Vjeruje se da je visok krvni tlak u pretilih pacijenata uglavnom posljedica povećanog minutnog volumena srca s "nedovoljno normalnim" perifernim otporom.
Ovo hemodinamsko stanje stimulira dva antagonistička regulatorna sustava koji kontroliraju volumen krvi i periferni otpor- sustav renin-angiotenzin-aldosteron (RAAS) i sustav natriuretskih peptida srca. Njihova disregulacija može uvelike objasniti visoki minutni volumen kod pretilih hipertenzivnih pacijenata. Štoviše, ovi kardiovaskularni regulatorni sustavi uključeni su u metaboličke promjene povezane s prekomjernom tjelesnom težinom kod kardiovaskularnih bolesti.
Dakle, kod pretilosti u patogenezi arterijske hipertenzije tri glavna mehanizma igraju značajnu ulogu:
Patogeneza razvoja arterijske hipertenzije i kardiovaskularnih bolesti u pretilosti shematski je prikazana na slici 1.
Slika 1. Shema patogeneze arterijske hipertenzije i kardiovaskularnih bolesti u pretilosti
Sistemski i tkivni renin-angiotenzin-aldosteronski sustav i njegove promjene u pretilosti
Sastav RAAS uključuje angiotenzinogen, renin, angiotenzin I, angiotenzin-konvertirajući enzim (ACE) i angiotenzin II (AT II). AT II ima različit učinak na različite stanice koje imaju specifične receptore.
Prema klasičnim pojmovima, angiotenzinogen nastaje u jetri i pod utjecajem renina sintetiziranog u periglomerularnim stanicama bubrega (jukstaglomerularne stanice), angiotenzinogen se u krvi pretvara u angiotenzin I. ACE je odgovoran za razgradnju AT I, što rezultira stvaranjem AT II.
Važno je napomenuti da kod pretilosti postoji kršenje mehanizama regulacije RAAS. U fiziološkim uvjetima, povećanje aktivnosti RAAS dovodi do povećanja otpora periferne žile i, posljedično, povećanje krvnog tlaka. Prema principu povratne sprege, povećanje krvnog tlaka trebalo bi uzrokovati smanjenje lučenja renina, smanjenje razine AT II i smanjenje sadržaja aldosterona. To zauzvrat smanjuje zadržavanje tekućine i natrija i održava krvni tlak na normalnoj razini.
Međutim, u bolesnika s visceralnom pretilošću poremećena je regulacija razine sistemskih cirkulirajućih komponenti RAAS-a. Unatoč povećanom krvnom tlaku, zadržavanju natrija i tekućine te povećanju volumena cirkulirajuće krvi, aktivnost renina i aldosterona u plazmi ostaje normalna ili čak blago povišena. Takva disregulacija RAAS-a kod pretilosti može biti posljedica povećanja stvaranja komponenti RAAS-a i/ili sekundarnog povećanja njihove koncentracije zbog defekata u sustavu natriuretskih peptida.
Utvrđeno je da osim krvnog RAAS-a postoji i tkivni, odnosno tzv. lokalni RAAS, koji je otkriven u nizu tkiva i organa, uključujući mozak, srce, krvne žile, bubrege, testise, masno tkivo itd. .
Kao što je poznato, dva čimbenika imaju ključnu ulogu u stvaranju AT II: aktivnost renina i koncentracija angiotenzinogena. Sinteza i izlučivanje angiotenzinogena u stanicama drugačiji tip ne samo da određuje povećanje lokalne koncentracije AT II, već i povećava sustavnu aktivnost RAAS-a. Kronična infuzija AT II miševima bila je popraćena značajnim povećanjem sadržaja mRNA angiotenzinogena u adipocitima. Ovi rezultati ukazuju na prisutnost pozitivne povratne veze između AT II i angiotenzinogena, kada povećanje razine jednog agensa stimulira stvaranje drugog. Kod pretilosti, osobito visceralnog tipa, aktivnost renina u plazmi ostaje, kao što je već spomenuto, na normalnoj ili donekle povišena razina, a razine angiotenzinogena i AT II su povećane.
Građa i fiziološka svojstva masnog tkiva
Masno tkivo se sastoji od različitih vrsta stanica, uključujući adipocite, makrofage, fibroblaste, vaskularne endotelne stanice i preadipocite (adipoblaste). Potonji tip stanica potječe od pluripotentnih matičnih stanica mezoderma. Iz preadipocita u tijelu odraslog čovjeka nastaju novi diferencirani ("mali") adipociti. Ti se adipociti povećavaju ("veliki" adipociti) zbog povećanog unosa hranom. masne kiseline. Dugolančane masne kiseline ulaze u adipocite iz krvi i talože se kao neutralni triacilgliceroli. Masno tkivo odgovorno je za skladištenje i izlučivanje dugolančanih masnih kiselina, koje djeluju kao jedan od glavnih energetskih supstrata za mnoge organe i tkiva, poput srčanih i skeletnih mišića. "Veliki" adipociti izlučuju znatno više zasićenih masnih kiselina. Hidroliza triglicerida i oslobađanje masnih kiselina odvija se pod utjecajem intracelularne hormon-senzitivne lipaze, čiju aktivnost kontroliraju kateholamini (pozitivna regulacija) i inzulin (negativna regulacija).
Endokrina aktivnost masnog tkiva
Za razliku od potkožnog masnog tkiva, koje obično čini 75% ukupnog masnog tkiva u tijelu i glavno je skladište lipida, visceralna mast trenutno se smatra aktivnim tkivom koje proizvodi hormone.
Adipociti proizvode širok raspon hormoni i citokini uključeni u metabolizam glukoze (adiponektin, rezistin itd.), lipide (protein za prijenos estera kolesterola), upalu (TNF-α, interleukin-6), koagulaciju (inhibitor aktivatora plazminogena-1), regulaciju krvnog tlaka (angiotenzinogen, AT II), prehrambeno ponašanje(leptin), kao i utjecaj na metabolizam i funkcionalnu aktivnost raznih organa i tkiva, uključujući mišiće, jetru, mozak i krvne žile (vidi tablicu).
Stol. endokrina funkcija adipociti: adipocitokini
| Adipocitokini | Učinci adipocitokina |
| Leptin | Apsorpcija hrane, masna masa |
| Adiponektin | |
| oduprijeti se | Inzulinska rezistencija, upala |
| Visfatin | inzulinska rezistencija |
| omentin | inzulinska rezistencija |
| Serpin oslobođen iz masnog visceralnog tkiva (Vaspin) | inzulinska rezistencija |
| Apelin | Vazodilatacija |
| Protein za prijenos estera kolesterola (CETP) | metabolizam lipida |
| Lipoproteinska lipaza (LPL) | metabolizam lipida |
| Hormon osjetljiva lipaza (HSL) | metabolizam lipida |
| Masne kiseline koje se vežu za proteine u adipocitima-4 (A-FABP-4 (aP2)) | metabolizam lipida |
| Perlipin | metabolizam lipida |
| Protein koji veže renitol (RBP) | metabolizam lipida |
| Acilacija koja stimulira proteine (ASP) | metabolizam lipida |
| Angiotenzin II (AT II) | Arterijski tlak |
| Angiotenzin konvertirajući enzim (ACE) | Arterijski tlak |
| angiotenzinogen (AGT) | Arterijski tlak |
| Faktor nekroze tumora alfa (TNF-a) | Upala |
| Interleukin, 6 (IL-6) | Upala |
| C-reaktivni protein (CRP) | Upala |
| Adipocitni tripsin/faktor komplementa D (Adipsin) | Upala |
| Makrofagni kemoatraktantni protein-1 (MCP-1) | Atraktant za makrofage |
| Međustanična adhezijska molekula-1 (ICAM-1) | Aktivacija makrofaga |
| Inhibitor aktivatora plazminogena-1 (PAI-1) | fibrinoliza |
Važno je naglasiti da čak i malo povećanje volumena visceralna mast ima značajnu ulogu u metaboličkim poremećajima, regulaciji ravnoteže vode i elektrolita te kardiovaskularnim bolestima.
S povećanjem mase masnog tkiva povećava se sadržaj gotovo svih adipokina u krvi. Iznimka je adiponektin, čija razina pada pod ovim uvjetima. Leptin i adiponektin trenutno su najviše proučavani adipokini.
Leptin. Proizvodnja leptina odvija se uglavnom u "velikim" adipocitima. Na leptin se često gleda kao na signalnu molekulu koja posreduje u odnosu između unosa hranjivih tvari, masnog tkiva i središnjeg živčanog sustava (hipotalamus). Leptin povećava oksidaciju lipida u jetri kao i lipolizu u adipocitima i skeletni mišići. Inzulin potiče stvaranje leptina. Na razinu leptina također utječu slobodne masne kiseline, TNF-α, estrogeni i hormon rasta.
Adiponektin. Stvaranje adiponektina odvija se isključivo u adipocitima. Adiponektin ima niz bioloških učinaka - djeluje antiaterogeno, povećava osjetljivost stanica na inzulin, inhibira sintezu glukoze u jetri, pospješuje njezin transport do mišića, pojačava oksidaciju masnih kiselina. Razine adiponektina smanjene su kod pretilosti, inzulinske rezistencije i dijabetes melitusa tipa 2.
Masno tkivo i aktivnost RAAS
Pokazalo se da je masno tkivo na drugom mjestu nakon jetre u stvaranju angiotenzinogena. Na primjer, količina mRNA angiotenzinogena u adipocitima je oko 70% one u jetri. Odnos između razine angiotenzinogena, pretilosti i arterijske hipertenzije jasno je pokazan pokusima na modelu transgenih miševa koji eksprimiraju prekomjerne količine angiotenzinogena u masnom tkivu. Ovi miševi imaju visceralnu pretilost i hipertenziju. Preadipociti i diferencirani masne stanice imaju kompletan skup komponenti potrebnih za lokalnu sintezu AT II, kao i AT 1 receptor za AT II, koji osigurava unutarstanični prijenos aktivacijskih signala potaknutih AT II. Uz pretilost, volumen visceralnih diferenciranih adipocita povećava se 20-30 puta. Pretilost je karakterizirana disfunkcijom adipocita, što se podrazumijeva kao povećanje stvaranja i lučenja različitih adipokina, citokina, kao i povećanje sadržaja komponenti RAAS, prvenstveno u visceralnoj masnoći.
Sumirajući podatke različitih studija, može se reći da kod pretilosti dolazi do povećanja aktivnosti RAAS-a, što se očituje u sljedećim činjenicama:
visoka aktivnost RAAS pak dovodi do povećanja mase masnog tkiva. Konkretno, pokazalo se da transgeni miševi koji prekomjerno izražavaju angiotenzinogen samo u masnim stanicama povećavaju razine angiotenzinogena u krvi, razvijaju hipertenziju i povećavaju masu masnog tkiva. Tkivo AT II u biti funkcionira kao faktor rasta adipocita. AT II djelujući na AT 1 receptore uzrokuje povećanje proteina ciklina D 1 koji je uključen u regulaciju rasta i diobe masnih stanica. Pokazalo se da AT II inducira prolaz G 1 faze staničnog ciklusa u ljudskim preadipocitima. Taj je učinak bio povezan s učinkom na AT1 receptore i naknadnom aktivacijom ciklin D1-ovisne kinaze.
Utvrđeno je da AT II uzrokuje diferencijaciju preadipocita, aktivira ključne enzime stvaranja lipida (lipogeneza) i povećava nakupljanje triglicerida u adipocitima.
Visceralnu pretilost prati povećanje aktivnosti 11-beta-hidroksisteroid dehidrogenaze tipa 1, što dovodi do stvaranja kortizola, ključnog hormona u diferencijaciji preadipocita u adipocite.
Aktivnost tkivnog RAS-a usko je povezana s proizvodnjom adipokina u masnom tkivu. Na primjer, pokazalo se da AT II inducira ekspresiju leptina u adipocitima. Pretpostavlja se da je takva aktivnost karakteristična samo za lokalno sintetizirani AT II, za razliku od sistemskog AT II.
Pretilost i aktivnost simpatičkog živčanog sustava
Kod pretilosti, osobito u njenoj abdominalnoj varijanti, vrlo često se uočava aktivacija simpatičkog živčanog sustava. Studija Normotesive Aging Study (NAS) otkrila je povećanje norepinefrina u mokraći proporcionalno indeksu tjelesne mase. S gubitkom težine smanjuje se aktivnost simpatičkog živčanog sustava.
Povećana aktivnost simpatičkog živčanog sustava kod pretilosti doprinosi prisutnosti hiperinzulinemije i inzulinske rezistencije. Inzulin može sam po sebi povećati aktivnost simpatoadrenalnog sustava, ali to djelomično može biti posljedica djelovanja leptina. Poznato je da s povećanjem stupnja pretilosti natašte raste i razina leptina kojeg luče adipociti. Leptin povećava aktivnost simpatičkog živčanog sustava, posebno u bubrezima. To dovodi, s jedne strane, do visokog učinka i povećanja srčanog ritma, as druge strane, do povećanja reapsorpcije natrija i povećanja intravaskularnog volumena krvi.
Utvrđena je povezanost između RAAS i simpatičkog živčanog sustava. Povećanje lučenja renina u bubrezima povezano je s aktivacijom simpatičkog živčanog sustava, a to se događa neovisno o intrarenalnom osjetilni sustav reguliranje lučenja renina putem bubrega. Štoviše, povećanje cikličkog adenozin monofosfata pod utjecajem kateholamina stimulira ekspresiju angiotenzinogena u ljudskim adipocitima. Povećanje razine AT II povećava aktivnost simpatičkog živčanog sustava kod ljudi. Utvrđeno je da AT II aktivira lokalni simpatički živčani sustav koji je uključen u povećanje tjelesne temperature (termogeneza). Tretman hladnoćom dovodi do povećanja sadržaja AT II u adipocitima bez popratne promjene razine AT II u plazmi.
Stoga, disregulacija RAAS-a kod pretilosti također može stimulirati aktivnost simpatičkog živčanog sustava.
Metode farmakološke korekcije povišenog krvnog tlaka u pretilosti
Doprinos različitih patogenetskih mehanizama održavanju visokog krvnog tlaka kod pretilosti može biti različit. Stoga u ovoj situaciji antihipertenzivi s različitim mehanizmima djelovanja mogu imati povoljan učinak.
Sukladno aktualnim preporukama za liječenje arterijske hipertenzije, ključ uspjeha značajnog sniženja krvnog tlaka je primjena kombinirane terapije. Za bolesnike s pretilošću, prije svega, glavne komponente takve terapije trebaju sadržavati kombinaciju lijekova koji smanjuju aktivnost RAAS (ACE inhibitori i sartani), lijekova koji smanjuju aktivnost simpatičkog živčanog sustava (β-blokatori i nedihidropiridinski antagonisti kalcija) i diuretici. Visoka efikasnost Primjena lijekova koji blokiraju RAAS kod pretilosti prikazana je u mnogim studijama. Što se tiče primjene β-blokatora, podaci su vrlo kontradiktorni, prvenstveno zbog sumnje u njihovu korisnost za liječenje bolesnika s nekompliciranom arterijskom hipertenzijom, a drugo, zbog činjenice da β-blokatori, barem oni klasični, mogu povećati težine bolesnika i povećati otpornost na inzulin. Stoga, ako se za liječenje bolesnika s pretilošću ili metaboličkim sindromom izaberu β-blokatori, to bi trebali biti lijekovi s posebnim svojstvima, posebice karvedilol i nebivolol.
Istodobno je utvrđeno da ne-dihidropiridinski antagonist kalcija verapamil može ne samo značajno smanjiti krvni tlak, već i smanjiti aktivnost simpatičkog živčanog sustava.
Tako se u slučaju pretilosti za liječenje arterijske hipertenzije može koristiti kombinacija RAAS-blokatora i verapamila.
Treba naglasiti da ova vrsta kombinacije lijekovi postoji u obliku gotove kombinirane oblik doziranja- lijek Tarka, koji u svom sastavu sadrži ACE inhibitor topljiv u mastima - trandolapril i verapamil sa sporim otpuštanjem (verapamil SR). Ovakav pristup vrlo je važan za učinkovitu terapiju, budući da se primjenom gotovih oblika lijeka poboljšava adherencija bolesnika na liječenje.
Postoje dokazi da Tarka snižava krvni tlak u većoj mjeri nego bilo koja od njezinih sastavnih komponenti, ima izraženu sposobnost smanjenja hipertrofije lijeve klijetke, pridonosi normalizaciji funkcije endotela, te je metabolički neutralna, čak i kod bolesnika sa šećernom bolešću.
dvostruko djelovanje- smanjenje aktivnosti RAAS pod utjecajem trandolaprila i simpatičkog živčanog sustava zbog produljenog djelovanja verapamila - imaju važan učinak na patogenih mehanizama razvoj arterijske hipertenzije u pretilosti i mehanizmi koji izazivaju oštećenje ciljnih organa kod ovog tipa hipertenzije.
Posebnu pozornost, kada se govori o liječenju hipertenzije kod pretilosti, treba obratiti na činjenicu da terapija koja se temelji na kombinaciji trandalaprila i dugodjelujućeg verapamila može smanjiti rizik od razvoja dijabetes melitusa u usporedbi s korištenjem druge taktike liječenja - kombinacije sartana. s niskom dozom tiazidnog diuretika. Rezultati studije STAR jasno pokazuju da kada se Tarka koristi godinu dana, razvija se manje ljudi s metaboličkim sindromom, u kojem se abdominalnoj pretilosti daje dominantna uloga. dijabetes(slika 2).
Slika 2. Razvoj novih slučajeva dijabetes melitusa (glukoza natašte > 126 mg/dl ili 2-satni test tolerancije glukoze > 200 mg/dl) prema vrsti antihipertenzivne terapije u osoba s metaboličkim sindromom u studiji STAR

Osim toga, prema studiji STAR-LET, čak i ako se dijabetes melitus javlja u pozadini terapija lijekovima Prijenos ovih pacijenata na prijem lijeka Tarka omogućio je normalizaciju polovice pacijenata metabolizam ugljikohidrata.
Rezultati ovih studija zahtijevaju preispitivanje preporuka za terapija lijekovima hipertenziju u osoba s metaboličkim sindromom i započeti terapiju kombinacijom koja sadrži ACE inhibitor (ili sartan) i antagonist kalcija ili prebaciti bolesnika na takvu terapiju.
Kao što je više puta spomenuto, za liječenje arterijske hipertenzije važnu ulogu ima smanjenje tjelesne težine bolesnika i stupnja abdominalne pretilosti. Naravno, gubitak težine na ovaj ili onaj način može značajno utjecati na smanjenje učestalosti kardiovaskularnih bolesti. Trenutno postoje različiti pristupi medikamentoznoj terapiji pretilosti. Prvi je simptomatsko liječenje, naime, smanjenje broja unesenih kalorija smanjenjem apsorpcije masti iz hrane. Takav se pristup može nazvati kompenzacijskim. Doista, takvom terapijom bolest se ne eliminira (budući da se bolesnik i dalje prejeda), već se samo privremeno nadoknađuje lijekom. Drugi pristup liječenju prekomjerne težine i pretilosti je rješavanje korijena problema, naime kroničnog prejedanja. Tako djeluje sibutramin (Meridijin lijek). Dovodi do početka brzog zasićenja, smanjuje količinu konzumirane hrane potiskujući ponovnu pohranu norepinefrina i serotonina u sinapsama neuronskih krugova. Danas je Meridia jedina originalni lijek otklanjanje uzroka pretilosti.
Temeljna razlika između sibutramina je u tome što, ne uzrokujući smanjenje apetita, pridonosi ranijem početku osjećaja sitosti. Osoba se rješava patološke navike prejedanja, što rezultira postupnim i postojanim smanjenjem tjelesne težine. Pod utjecajem sibutramina smanjuje se unos hrane za oko 20%. Uz to, sibutramin neizravno utječe na razinu biogenih amina u krvi, koji aktiviraju adrenoreceptore u masnom tkivu i pokreću lipolizu u adipocitima, što je popraćeno promjenom sadržaja energetskih supstrata u krvi. Sibutramin, zbog aktivacije β 2 - i β 3 -adrenergičkih receptora, pospješuje procese termogeneze i povećava potrošnju energije u tijelu.
Klinička učinkovitost i sigurnost sibutramina (Meridia) dokazana je u u velikom broju multicentrične studije. Konkretno, u studiji STORM (Sibutramine Trial on Obesity Reduction and Maintenance), koja je uključivala 605 pretilih pacijenata, pokazano je da je dvogodišnji unos sibutramina smanjio težinu pacijenata za 3 puta, a opseg struka - 2 puta više. izraženiji od placeba.. Važno je da je 80% pacijenata održalo gubitak težine tijekom dvije godine u usporedbi sa 16% pacijenata koji su primali placebo (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов visoka gustoća povećan za 21% uz smanjenje razine lipoproteina niske gustoće i triglicerida.
Pozitivan učinak smanjenja tjelesne težine u liječenju bolesnika s arterijskom hipertenzijom i drugim kardiovaskularnim bolestima može biti i to što smanjenje intraabdominalne masnoće može smanjiti mehaničku kompresiju bubrega, što može dovesti do poboljšanja njihove prokrvljenosti i smanjenje aktivnosti RAAS-a. Smanjenje masnog tkiva u i oko bubrega može dovesti do smanjenja intersticijalnog tlaka, kompresije tankog dijela Henleyeve petlje, povećanja protoka krvi u vasa recta i smanjenja tubularne reapsorpcije Na+ i vode. Dakle, gubitak težine uzrokovan metodama korekcije bez lijekova ili lijekova može smanjiti visinu krvnog tlaka.
Međutim, donedavno, u stvarnom klinička praksa sibutramin je korišten s oprezom, strahujući od mogućeg negativan utjecaj na krvni tlak i broj otkucaja srca, što bi, pak, moglo dovesti, iako kod manjeg broja pacijenata, do neugodnih subjektivni osjećaji. Kako bi se proučio učinak sibutramina na kardiovaskularni sustav i dokazala sigurnost lijeka u skupini bolesnika s povećanim rizikom od kardiovaskularnih bolesti, provedena je velika multicentrična, dvostruko slijepa, placebom kontrolirana međunarodna studija SCOUT (Sibutramine Cardiovascular OUTcomes), gdje je promatrano 10.742 pacijenata, od kojih je 97% imalo bolesti kardio-vaskularnog sustava, 88 - arterijska hipertenzija i 84% - dijabetes melitus tipa 2. Prema rezultatima prve završene faze studije, utvrđeno je da je imenovanje sibutramina dovelo do značajnog (p< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Postavlja se prirodno pitanje kako će ova ili ona vrsta antihipertenzivne terapije korelirati s liječenjem sibutraminom. Provedeno je nekoliko studija kako bi se odgovorilo na ovo pitanje. Na primjer, pokazalo se da je primjena kombiniranog oblika doziranja koji sadrži verapamil 180 mg / trandolapril 2 mg u kombinaciji sa sibutraminom 10 mg dovela do izraženijeg sniženja krvnog tlaka tijekom 6 mjeseci od same antihipertenzivne terapije - sistolički krvni tlak se smanjio, , za 21,9 ± 8,1 naspram 15,9 ± 12,3 mm Hg. Umjetnost. i dijastolički - za 15,7 ± 8,1 u odnosu na 9,1 ± 9,9 mm Hg. Umjetnost. (p = 0,03). Kombinirana terapija također je dovela do izraženijeg poboljšanja antropometrijskih parametara; pouzdan (str<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
U prospektivnoj, multicentričnoj, placebom kontroliranoj, dvostruko slijepoj HOS studiji (hipertenzija-pretilost-sibutramin) tijekom 16 tjedana, napravljena je usporedba učinkovitosti različitih antihipertenzivnih režima (felodipin 5 mg / ramipril 5 mg (n = 57) , verapamil 180 mg / dan).trandolapril 2 mg (n = 55), metoprolol sukcinat 95 mg/hidroklorotiazid 12,5 mg n = 59) sa sibutraminom i placebom. U ovoj studiji je potvrđeno da sibutramin može povećati krvni tlak. Stoga je, naravno, potrebno adekvatno provoditi antihipertenzivnu terapiju tijekom razdoblja primjene sibutramina u bolesnika s arterijskom hipertenzijom. Također se pokazalo da su u liječenju kombinacijom β-blokatora i hidroklorotiazida pozitivni učinci sibutramina na smanjenje tjelesne težine, opseg struka i učinak na metabolički profil bili značajno manje izraženi nego kod kombinacije kombinirane terapije s ACE. inhibitore i antagoniste kalcija sa sibutraminom. Ovo još jednom potvrđuje potrebu pažljivog odabira antihipertenzivne terapije u bolesnika s pretilošću, posebice pri provođenju programa usmjerenih na smanjenje tjelesne težine. Zaključno treba istaknuti da je s našeg gledišta jedan od značajnih problema koji umanjuje učinkovitost borbe protiv pretilosti taj što ni liječnici ni javnost ne smatraju pretilost značajnim čimbenikom rizika. Štoviše, pacijenti se često ne ocjenjuju pretilima. Na primjer, u studiji POLONEZ, prema procjeni liječnika na temelju BMI-a, pretilost kod muškaraca i žena zabilježena je tri puta češće nego kod samih pacijenata. Stoga treba pojačati i provoditi informativni rad među stanovništvom o potrebi sprječavanja debljanja, korigiranju postojeće pretilosti i važnosti kontinuiranog liječenja arterijske hipertenzije. KNJIŽEVNOST
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Prevalencija i trendovi pretilosti među odraslim osobama u SAD-u, 1999.-2000. JAMA 2002.; 288:1723-7.
2. Pi-Sunyer F.X. Epidemiologija središnje distribucije masti u odnosu na bolest. Nutr Rev 2004; 62 (7): 120-6.
3. Arbeeny C.M. Rješavanje nezadovoljene medicinske potrebe za sigurnim i učinkovitim terapijama mršavljenja. Obes Res 2004; 12 (8): 1191-6.
4. Stamler J., Rose G., Stamler R. i sur. Nalazi studije INTERSALT. Implikacije za javno zdravlje i medicinsku skrb. Hypertension 1989; 14 (5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Prekomjerna tjelesna težina i hipertenzija u starijih osoba - rezultati studije zajednice. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et al. Smanjenje intraabdominalne visceralne masti može smanjiti krvni tlak u pretilih žena s hipertenzijom. Hypertension 1996; 27(1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et al. American Heart Association; Odbor za pretilost Vijeća za prehranu, tjelesnu aktivnost i metabolizam. Pretilost i kardiovaskularne bolesti: patofiziologija, procjena i učinak gubitka tjelesne težine: ažuriranje znanstvene izjave Američkog udruženja za srce iz 1997. o pretilosti i srčanim bolestima Odbora za pretilost Vijeća za prehranu, tjelesnu aktivnost i metabolizam. Naklada 2006.; 113: 898-918.
8 Alpert M.A. Kardiomiopatija pretilosti; patofiziologija i evolucija kliničkog sindroma. Am J Med Sci 2001; 321: 225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hipertenzija i pretilost. Recent Progr Horm Res 2004; 59: 169-205.
10. Engeli S., Sharma A.M. Sustav renin-angiotenzin i natriuretski peptidi u hipertenziji povezanoj s pretilošću. J Mol Med 2001; 79:21-9.
11. Lafontan M., Moro C., Sengenes C. i sur. Neslućena metabolička uloga atrijskih natriuretskih peptida: kontrola lipolize, mobilizacije lipida i sustavne razine neesterificiranih masnih kiselina u ljudi. Arterioscler Thromb Vasc Biol 2005; 25:2032-42.
12. Hall J.E. Bubrezi, hipertenzija i pretilost. Hipertenzija 2003; 41 (3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et al. ACE, angiotenzinogen i pretilost: potencijalni put do hipertenzije. J Hum Hypertens 1997; 11:107-11.
14. Lu H., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotenzin II povećava ekspresiju angiotenzinogena u masnom tkivu. Am J Physiol Endocrinol Metab 2007; 292:1280-7.
15. Engeli S., Negrel R., Sharma A.M. Fiziologija i patofiziologija renin-angiotenzinskog sustava masnog tkiva. Hipertenzija 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. Adipozni razvoj: od matične stanice do adipocita. Crit Rev Biochem Mol Biol 2005; 40:229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. Disfunkcija masnog tkiva kod pretilosti, šećerne bolesti i krvožilnih bolesti. Eur Heart J 2008; 29:2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A., et al. Adipokini i rizik od dijabetesa tipa 2 kod starijih muškaraca. Diabetes Core 2007; 30:1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et al. Razine inzulina, leptina i topivih TNF receptora u plazmi u odnosu na čimbenike rizika za aterogene i trombogene kardiovaskularne bolesti povezane s pretilošću kod muškaraca. Aterosleroza 2001; 157:495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Odnos između veličine adipocita i ekspresije i izlučivanja adipokina. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T., Fukui T. i sur. Infuzija angiotenzina II smanjuje razinu adiponektina u plazmi putem njegovog receptora tipa 1 kod štakora: implikacija za inzulinsku rezistenciju povezanu s hipertenzijom. Metabolizam 2006; 55:478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et al. Koncentracija imunoreaktivnog leptina u serumu kod ljudi normalne težine i pretilih ljudi. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et al. Kontrola središnjeg živčanog sustava nad unosom hrane. Nature 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Neuroni proopiomelanokortina izravne su mete za leptrin u hipotalamusu. Endokrinologija 1997.; 138; 4489-92.
25 Long Y.C., Zierath J.R. AMP-aktivirana signalizacija protein kinaze u metaboličkoj regulaciji. J Clin Invest 2006; 116:1776-83.
26. Saladin R., De Vos P., Guerre-Millo M., et al. Prolazno povećanje ekspresije gena za pretilost nakon hrane ili primjene inzulina. Priroda 1995; 377:527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Faktor nekroze tumora-alfa ima dvostruki učinak na sintezu i oslobađanje ljudskog masnog leptina. Mol Cell Endocrinol 2000; 159:79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., et al. Adiponektin i razvoj dijabetesa tipa 2 u populaciji Pima Indijanaca. Lancet 2002; 360:57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et al. Niske razine adiponektina u plazmi povezane su s niskim rizikom za buduće kardiovaskularne događaje u bolesnika s klinički vidljivom vaskularnom bolešću. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D., et al. Adipozni angiotenzinogen je uključen u rast masnog tkiva i regulaciju krvnog tlaka. FASEB J 2001; 15:2727-9.
31. Paul M., Mehr A.P., Kreutz R. Fiziologija lokalnih renin-angiotenzinskih sustava. Physiol Rev 2006; 86: 747-803.
32. Karlsson C., Lindell K., Ottosson M., et al. Ljudsko masno tkivo eksprimira angiotenzinogen i enzime potrebne za njegovu pretvorbu u angiotenzin II. J Clin Endocrinol Metab 1998; 83:3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Hormonska regulacija renin-angiotenzinskog sustava ljudskog masnog tkiva: povezanost s pretilošću i hipertenzijom. J Hypertens 2002; 20:965-73.
34. Engeli S., Gorzelniak K., Kreutz R., et al. Koekspresija gena renin-angiotenzinskog sustava u ljudskom masnom tkivu. J Hypertens 1999; 17:555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., et al. Ekspresija reninskog receptora u ljudskom masnom tkivu. Am J Physiol Regul Integr Comp Physiol 2007; 292: 274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Renin-angiotenzinski sustav, natriuretski peptidi, pretilost, metabolički sindrom i hipertenzija: integrirani pogled kod ljudi. J Hypertens 2008; 26:831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et al. Receptori angiotenzina II u ljudskim preadipocitima: uloga u regulaciji staničnog ciklusa. Endokrinologija 1999.; 140:154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G., et al. Angiotenzin II kao trofički faktor bijelog masnog tkiva: stimulacija stvaranja masnih stanica. Endokrinologija 2001; 142:487-92.
39. Watanabe G., Lee R.J., Albanese C., et al. Angiotenzin II aktivacija aktivnosti kinaze ovisne o ciklinu D1. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Diferencijacija preadipoznih stanica: parakrina uloga prostaciklina nakon stimulacije masnih stanica angiotenzinom-II. Endokrinologija 1994.; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotenzin II povećava lipogenezu u 3T3-L1 i ljudskim masnim stanicama. Endokrinologija 1997.; 138:1512-9.
42. Wake D.J., Walker B.R. Inhibicija 11beta-hidroksisteroid dehidrogenaze tipa 1 u pretilosti. Endocrine 2006; 29:101-8.
43. Engeli S., Bohnke J., Feldpausch M., et al. Regulacija 11beta-HSD gena u ljudskom masnom tkivu: utjecaj centralne pretilosti i gubitka težine. Obes Res 2004; 12:9-17.
44. Kim S., Whelan J., Claycombe K., et al. Angiotenzin II povećava izlučivanje leptina pomoću 3T3-L1 i ljudskih adipocita putem mehanizma neovisnog o prostaglandinu. J Nutr 2002; 132:1135-40.
45. Cassis L.A., engleski V.L., Bharadwaj K., Boustany C.M. Diferencijalni učinci lokalnog naspram sistemskog angiotenzina II u regulaciji otpuštanja leptina iz adipocita. Endokrinologija 2004; 145:169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et al. Simpatički živčani sustav i metabolički sindrom. J Hypertens 2007; 25:909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Aktivnost simpatičkog sustava kod pretilosti i metaboličkog sindroma. Ann N Y Acad Sci 2006; 1083:129-52.
48. Landsberg L., Troisi R., Parker D., et al. Pretilost, krvni tlak i simpatički živčani sustav. Ann Epidemiol 1991; 1: 295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Ekspresija i izlučivanje gena za humani adipozni angiotenzinogen stimulirani su cikličkim AMP-om preko povećane aktivnosti vezanja elementa koji odgovara na ciklički AMP DNA. Endocrine 2004; 25:97-104.
50. Cassis L.A. Uloga angiotenzina II u termogenezi smeđeg masnog tkiva tijekom privikavanja na hladnoću. Am J Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. Presinaptička modulacija otpuštanja neurotransmitera endogenim angiotenzinom II u smeđem masnom tkivu. J Neural Transm 1991; 34:129-37.
52. Reisin E., Weir M., Falkner B., et al. Lizinopril naspram hidroklorotiazida u pretilih hipertenzivnih bolesnika: multicentrično placebom kontrolirano ispitivanje. Grupa za ispitivanje pretilih pacijenata s hipertenzijom (TROPHY). Hypertension 1997; 30(1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., et al. Učinkovitost i sigurnost niske i visoke doze fiksnih kombinacija irbesartana/hidroklorotiazida u bolesnika s nekontroliranim sistoličkim krvnim tlakom na monoterapiji: ispitivanje INCLUSIVE. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. u ime istraživačke grupe "ECO". Multicentrično, randomizirano, otvoreno istraživanje učinkovitosti promjene načina života i terapije ACE inhibitorom (kvinapril) u pretilih bolesnika s arterijskom hipertenzijom (IVF). Arterijska hipertenzija 2003; 9(6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Antihipertenzivna terapija i inzulinska osjetljivost: moramo li redefinirati ulogu beta-blokatora? Am J Hypertens 1998; 11 (10): 1258-65.
56. Kaaja R., Kujala S., Manhem K., et al. Učinci simpatolitičke terapije na indekse inzulinske osjetljivosti u hipertenzivnih žena u postmenopauzi. Int J Clin Pharmacol Ther 2007; 45 (7): 394-401.
57. Kuperstein R., Sasson Z. Učinci antihipertenzivne terapije na metabolizam glukoze i inzulina i na masu lijeve klijetke: randomizirana, dvostruko slijepa, kontrolirana studija 21 pretilog hipertoničara. Naklada 2000; 102 (15): 1802-6.
58. Halperin A.K., Cubeddu L.X. Uloga blokatora kalcijevih kanala u liječenju hipertenzije. Am Heart J 1986; 111 (2): 363-82.
59. McAllister R.G. ml. Klinička farmakologija sporih blokatora kanala. Prog Cardiovasc Dis 1982; 25 (2): 83-102.
60. Binggeli C., Corti R., Sudano I., et al. Učinci kronične blokade kalcijevih kanala na aktivnost simpatičkog živca u hipertenziji. Hipertenzija 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K., et al. Učinci klasa antagonista kalcija dihidropiridina i fenilalkilamina na autonomnu funkciju u hipertenziji: studija VAMPHYRE. Am J Hypertens 2001; 14 (11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Obrasci suradljivosti pacijenata liječenih s 2 odvojena antihipertenziva u odnosu na kombiniranu terapiju s fiksnim dozama Am J Hypertens 2004; 175:223.
63. Dezii C.M. Retrospektivna studija postojanosti kombinirane terapije jednom pilulom u odnosu na istodobna terapija s dvije tablete u bolesnika s hipertenzijom. Upravljačka skrb. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. Obrasci pridržavanja kod pacijenata liječenih kombinacijom fiksnih doza u odnosu na zasebne antihipertenzive. Am J Health Syst Pharm 2007; 64 (12): 1279-83.
65. Jackson K. Postojanost fiksne u odnosu na slobodnu kombinaciju s valsartanom i HCTZ-om za pacijente s hipertenzijom. Value Health Suppl 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Kardiovaskularni učinci kombinacije trandolapril/verapamil u bolesnika s blagom do umjerenom esencijalnom hipertenzijom. Am J Cardiol 1997; 79(6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. Trandolapril/verapamil s produljenim oslobađanjem: pregled njegove uporabe u liječenju esencijalne hipertenzije. Lijekovi 2005.; 65 (13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Upravljanje hipertenzijom u bolesnika s dijabetesom - fokus na kombinaciji trandolapril/verapamil. Vasc Health Risk Management 2007; 3 (4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et al. Razlike u toleranciji glukoze između kombinacija fiksnih doza antihipertenziva u osoba s metaboličkim sindromom. Skrb za dijabetes 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., et al. Poništenje poremećaja tolerancije glukoze i novonastalog dijabetesa povezanog s diureticima: rezultati studije STAR-LET. J Cardiometab Syndr 2008; 3 (1): 18-25.
71. Bailey C.J., Dan C. Novi farmakološki pristupi pretilosti. Obesity Practice 2005; 1:2-5.
72. Yanovski S.Z., Yanovski J.A.Y. pretilost. N Engl J Med 2002; 346 (8): 591-602.
73. Dan C., Bailey C.J. Ažuriranje sibutramina. Br J Diabetes Vasc Dis 2002; 2:392-7.
74. James W.P., Astrup A., Finer N., et al. Učinak sibutramina na održavanje težine nakon gubitka težine: randomizirano ispitivanje. Studijska grupa OLUJA. Ispitivanje sibutramina za smanjenje i održavanje pretilosti. Lancet 2000; 356: 2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W., et al. Kardiovaskularni odgovori na kontrolu tjelesne težine i sibutramin u visokorizičnih subjekata: analiza ispitivanja SCOUT. Eur Heart J 2007.; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W., et al. Promjene krvnog tlaka povezane sa sibutraminom i regulacijom tjelesne težine - analiza iz 6-tjednog uvodnog razdoblja ispitivanja kardiovaskularnih ishoda sibutramina (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et al. Učinci kombinacije sibutramin plus verapamil s produljenim oslobađanjem/trandolapril na krvni tlak i metaboličke varijable u pretilih pacijenata s hipertenzijom. Expert Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., et al. Optimalno liječenje hipertenzije povezane s pretilošću: studija hipertenzije-pretilosti-sibutramina (HOS). Naklada 2007.; 115 (15): 1991-8.
79. Glezer M.G. Rezultati ruske studije POLONEZ (UČINKOVITOST I SIGURNOST ENARENALNE KOD PACIJENATA S ARTERIJSKOM HIPERTENZIJOM). Terapeutski arhiv 2006; 4:44-50.
Za citat: Leonova M.V. Novi i obećavajući lijekovi koji blokiraju sustav renin-angiotenzin-aldosteron // RMJ. Medicinski pregled. 2013. broj 17. S. 886
Uloga renin-angiotenzin-aldosteronskog sustava (RAAS) u razvoju arterijske hipertenzije (AH) i drugih kardiovaskularnih bolesti danas se smatra dominantnom. U kardiovaskularnom kontinuumu hipertenzija je jedan od čimbenika rizika, a glavni patofiziološki mehanizam oštećenja kardiovaskularnog sustava je angiotenzin II (ATII). ATII je ključna komponenta RAAS-a – efektor koji provodi vazokonstrikciju, zadržavanje natrija, aktivaciju simpatičkog živčanog sustava, proliferaciju i hipertrofiju stanica, razvoj oksidativnog stresa i upalu vaskularne stijenke.
Trenutno su dvije klase lijekova koji blokiraju RAAS već razvijene i naširoko se klinički koriste - ACE inhibitori i blokatori ATII receptora. Farmakološki i klinički učinci ovih klasa razlikuju se. ACE je cink metaloproteinaza peptidaza koja metabolizira ATI, AT1-7, bradikinin, tvar P i mnoge druge peptide. Mehanizam djelovanja ACE inhibitora uglavnom je povezan sa sprječavanjem stvaranja ATII, što potiče vazodilataciju, natriurezu i eliminira proupalne, proliferativne i druge učinke ATII. Osim toga, ACE inhibitori sprječavaju razgradnju bradikinina i povećavaju njegovu razinu. Bradikinin je snažan vazodilatator, potencira natriurezu, a što je najvažnije, ima kardioprotektivno (sprječava hipertrofiju, smanjuje ishemijsko oštećenje miokarda, poboljšava koronarnu prokrvljenost) i vazoprotektivno djelovanje, poboljšavajući funkciju endotela. Istovremeno, visoka razina bradikinina uzrok je razvoja angioedema, što je jedan od ozbiljnih nedostataka ACE inhibitora koji značajno povećavaju razinu kinina.
ACE inhibitori nisu uvijek u stanju potpuno blokirati stvaranje ATII u tkivima. Sada je utvrđeno da drugi enzimi koji nisu povezani s ACE, prvenstveno endopeptidaze, na koje ACE inhibitori ne utječu, također mogu sudjelovati u njegovoj transformaciji u tkivima. Zbog toga ACE inhibitori ne mogu u potpunosti eliminirati učinke ATII, što može biti razlog njihove neučinkovitosti.
Rješenje ovog problema olakšano je otkrićem ATII receptora i prve klase lijekova koji selektivno blokiraju AT1 receptore. Preko AT1 receptora ostvaruju se nepovoljni učinci ATII: vazokonstrikcija, lučenje aldosterona, vazopresina, norepinefrina, zadržavanje tekućine, proliferacija glatkih mišićnih stanica i kardiomiocita, aktivacija SAS-a, kao i mehanizam negativne povratne sprege - stvaranje renina. . AT2 receptori obavljaju "korisne" funkcije, kao što su vazodilatacija, procesi popravka i regeneracije, antiproliferativno djelovanje, diferencijacija i razvoj embrionalnih tkiva. Klinički učinci blokatora ATII receptora posredovani su eliminacijom "štetnih" učinaka ATII na razini AT1 receptora, čime se postiže potpunije blokiranje štetnih učinaka ATII i povećanje učinka ATII na AT2 receptore. , koji nadopunjuje vazodilatacijske i antiproliferativne učinke. Blokatori ATII receptora imaju specifičan učinak na RAAS bez ometanja kininskog sustava. Nedostatak utjecaja na aktivnost kininskog sustava, s jedne strane, smanjuje ozbiljnost nuspojava (kašalj, angioedem), ali, s druge strane, blokatore ATII receptora lišava važnog antiishemijskog i vazoprotektivnog učinka, što ih razlikuje od ACE inhibitora. Iz tog razloga, indikacije za uporabu blokatora ATII receptora u većini ponavljaju indikacije za imenovanje ACE inhibitora, čineći ih alternativnim lijekovima.
Unatoč uvođenju blokatora RAAS u široku praksu liječenja hipertenzije, problemi poboljšanja ishoda i prognoze ostaju. To uključuje: mogućnost poboljšanja kontrole krvnog tlaka u populaciji, učinkovitost liječenja rezistentne hipertenzije, mogućnost daljnjeg smanjenja rizika od kardiovaskularnih bolesti.
Potraga za novim načinima utjecaja na RAAS aktivno je u tijeku; proučavaju se drugi sustavi koji međusobno blisko djeluju i razvijaju se lijekovi s višestrukim mehanizmima djelovanja, kao što su ACE inhibitori i inhibitori neutralne endopeptidaze (NEP), endotelin-konvertirajući enzim (EPF) i NEP inhibitori, ACE/NEP/EPF inhibitori.
Inhibitori vazopeptidaze
Osim dobro poznatog ACE, vazopeptidaze uključuju još 2 cink metaloproteinaze - neprilizin (neutralna endopeptidaza, NEP) i endotelin-konvertirajući enzim, koji također mogu biti meta farmakoloških učinaka.
Neprilysin je enzim koji proizvodi vaskularni endotel i uključen je u razgradnju natriuretskog peptida, kao i bradikinina.
Sustav natriuretskih peptida predstavljen je s tri različite izoforme: atrijskim natriuretskim peptidom (A-tip), moždanim natriuretskim peptidom (B-tip), koji se sintetiziraju u atriju i miokardu, i endotelnim C-peptidom, koji su endogeni inhibitori RAAS-a u njihove biološke funkcije i endotelin-1 (Tablica 1). Kardiovaskularni i bubrežni učinci natriuretskog peptida su smanjenje krvnog tlaka kroz učinak na vaskularni tonus i ravnotežu vode i elektrolita, kao i u antiproliferativnim i antifibrotičnim učincima na ciljne organe. Nedavno je natriuretski peptidni sustav uključen u metaboličku regulaciju oksidacije lipida, stvaranje i diferencijaciju adipocita, aktivaciju adiponektina, izlučivanje inzulina i toleranciju na ugljikohidrate, što može pružiti zaštitu od razvoja metaboličkog sindroma.
Do danas je postalo poznato da je razvoj kardiovaskularnih bolesti povezan s disregulacijom sustava natriuretskih peptida. Dakle, kod hipertenzije postoji manjak natriuretskog peptida, što dovodi do osjetljivosti na sol i poremećene natriureze; kod kroničnog zatajenja srca (CHF), u pozadini nedostatka, opaža se abnormalno funkcioniranje hormona natriuretskog peptidnog sustava.
Stoga se inhibitori NEP-a mogu koristiti za potenciranje natriuretskog peptidnog sustava kako bi se postigli dodatni hipotenzivni i zaštitni kardiorenalni učinci. Inhibicija neprilizina dovodi do pojačavanja natrijuretskih, diuretskih i vazodilatacijskih učinaka endogenog natriuretskog peptida i, kao rezultat toga, do sniženja krvnog tlaka. Međutim, NEP je također uključen u razgradnju drugih vazoaktivnih peptida, posebno ATI, ATII i endotelina-1. Stoga je ravnoteža učinaka inhibitora NEP-a na vaskularni tonus promjenjiva i ovisi o prevladavanju konstriktorskih i dilatacijskih učinaka. Uz produljenu primjenu, antihipertenzivni učinak inhibitora neprilizina je slabo izražen zbog kompenzacijske aktivacije stvaranja ATII i endotelina-1.
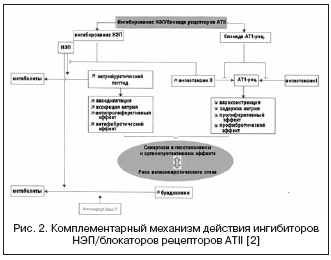
S tim u vezi, kombinacija učinaka ACE inhibitora i NEP inhibitora može značajno potencirati hemodinamske i antiproliferativne učinke kao rezultat komplementarnog mehanizma djelovanja, što je dovelo do stvaranja lijekova s dvojnim mehanizmom djelovanja, objedinjenih pod nazivom - inhibitori vazopeptidaze (Tablica 2, Slika 1) .
Poznati inhibitori vazopeptidaza karakterizirani su različitim stupnjevima selektivnosti za NEP/ACE: omapatrilat - 8,9:0,5; fazidoprilat - 5,1:9,8; sampatrilat - 8,0:1,2. Kao rezultat toga, inhibitori vazopeptidaze dobili su mnogo veće mogućnosti za postizanje hipotenzivnog učinka, neovisno o aktivnosti RAAS i razini retencije natrija, te u zaštiti organa (regresija hipertrofije, albuminurije, vaskularne krutosti). U kliničkim studijama najviše je proučavan omapatrilat, koji je pokazao veću antihipertenzivnu učinkovitost u usporedbi s ACE inhibitorima, te je u bolesnika s CHF doveo do povećanja ejekcijske frakcije i poboljšanja kliničkih ishoda (IMPRESS, OVERTURE studije), ali bez prednosti u odnosu na ACE inhibitore.
Međutim, u velikim kliničkim ispitivanjima s primjenom omapatrilata, utvrđena je veća incidencija angioedema u usporedbi s ACE inhibitorima. Poznato je da je incidencija angioedema pri primjeni ACE inhibitora od 0,1 do 0,5% u populaciji, od čega je 20% slučajeva životno ugroženo, što je povezano s višestrukim povećanjem koncentracije bradikinina i njegovih metabolita. Rezultati velike multicentrične studije OCTAVE (n=25302), koja je bila posebno dizajnirana za proučavanje incidencije angioedema, pokazali su da je incidencija ove nuspojave tijekom liječenja omapatrilatom veća od one u skupini koja je primala enalapril - 2,17% prema 0,68% (relativni rizik 3,4). To je objašnjeno povećanim učinkom na razinu kinina tijekom sinergističke inhibicije ACE i NEP, povezanog s inhibicijom aminopeptidaze P, koja je uključena u razgradnju bradikinina.
Novi dvojni inhibitor vazopeptidaze koji blokira ACE/NEP, ilepatril, ima veći afinitet za ACE nego NEP. Proučavanjem farmakodinamičkih učinaka ilepatrila na djelovanje RAAS-a i natriuretskog peptida u zdravih dobrovoljaca utvrđeno je da lijek ovisno o dozi (u dozama od 5 i 25 mg) i značajno (više od 88%) potiskuje ACE u plazmi više od 48 sati, bez obzira na osjetljivost na sol. Istodobno, lijek je značajno povećao aktivnost renina u plazmi tijekom 48 sati i smanjio razinu aldosterona. Ovi rezultati su pokazali izraženiju i dugotrajniju supresiju RAAS-a, za razliku od ACE inhibitora ramiprila u dozi od 10 mg, što je objašnjeno značajnijim tkivnim učinkom ilepatrila na ACE i većim afinitetom za ACE, te usporedivim stupnjem blokade RAAS-a u usporedbi s kombinacijom irbesartana 150 mg + 10 mg ramiprila. Za razliku od učinka na RAAS, učinak ilepatrila na natriuretski peptid očitovao se prolaznim povećanjem razine njegovog izlučivanja u razdoblju 4-8 sati nakon doze od 25 mg, što ukazuje na manji i slabiji afinitet za NEP i razlikuje ga od omapatrilata. Štoviše, u pogledu razine izlučivanja elektrolita, lijek nema dodatni natriuretski učinak u usporedbi s ramiprilom ili irbesartanom, kao ni s drugim inhibitorima vazopeptidaze. Maksimalni hipotenzivni učinak razvija se 6-12 sati nakon uzimanja lijeka, a smanjenje srednjeg krvnog tlaka je 5±5 i 10±4 mm Hg. pri niskoj odnosno visokoj osjetljivosti na sol. Prema farmakokinetičkim karakteristikama, ilepatril je predlijek s aktivnim metabolitom, koji se brzo stvara s maksimalnom koncentracijom za 1-1,5 sati i polako se eliminira. Trenutno su u tijeku klinička ispitivanja faze III.
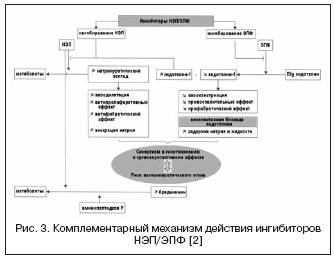
Alternativni put dvojne supresije RAAS-a i NEP-a predstavlja kombinacija blokade ATII receptora i NEP-a (slika 2). Blokatori ATII receptora ne utječu na metabolizam kinina, za razliku od ACE inhibitora, stoga potencijalno imaju manji rizik od razvoja angioedema. Trenutačno je prvi lijek, blokator ATII receptora s učinkom inhibicije NEP u omjeru 1:1, LCZ696, u fazi III kliničkih ispitivanja. Kombinirana molekula lijeka sadrži valsartan i inhibitor NEP (AHU377) u obliku predlijeka. U velikoj studiji u bolesnika s hipertenzijom (n=1328), LCZ696 u dozama od 200-400 mg pokazao je prednost u hipotenzivnom učinku u odnosu na valsartan u dozama od 160-320 mg u obliku dodatnog sniženja krvnog tlaka za 5 /3 i 6/3 mmHg. . Hipotenzivni učinak LCZ696 praćen je izraženijim smanjenjem pulsnog tlaka: za 2,25 i 3,32 mm Hg. u dozama od 200 odnosno 400 mg, što se trenutno smatra pozitivnim prognostičkim čimbenikom za učinak na krutost vaskularne stijenke i kardiovaskularne ishode. Istodobno, istraživanje neurohumoralnih biomarkera tijekom liječenja s LCZ696 pokazalo je povećanje razine natriuretskog peptida s usporedivim stupnjem povećanja razine renina i aldosterona u usporedbi s valsartanom. Podnošljivost u bolesnika s hipertenzijom bila je dobra, a nisu zabilježeni slučajevi angioedema. Ispitivanje PARAMOUMT sada je dovršeno na 685 pacijenata sa CHF i neoštećenom EF. Rezultati studije pokazali su da LCZ696 brže i izraženije smanjuje razinu NT-proBNP (primarna krajnja točka je marker povećane aktivnosti natriuretskog peptida i loše prognoze kod CHF-a) u usporedbi s valsartanom, a također smanjuje veličinu lijevog atrija , što ukazuje na regresiju njegove pregradnje . U tijeku je istraživanje u bolesnika s CHF i smanjenom EF (studija PARADIGM-HF).
Inhibitori endotelinskog sustava
Endotelinski sustav ima važnu ulogu u regulaciji vaskularnog tonusa i regionalnog protoka krvi. Među tri poznate izoforme, endotelin-1 je najaktivniji. Uz poznate vazokonstriktorske učinke, endotelin potiče proliferaciju i sintezu međustaničnog matriksa, a također, zbog izravnog djelovanja na tonus bubrežnih žila, sudjeluje u regulaciji homeostaze vode i elektrolita. Učinci endotelina ostvaruju se interakcijom sa specifičnim receptorima A-tipa i B-tipa, čije su funkcije međusobno suprotne: vazokonstrikcija se događa preko A-tipa receptora, a vazodilatacija preko B-tipa. Posljednjih godina utvrđeno je da receptori tipa B igraju važnu ulogu u klirensu endotelina-1, tj. blokada ovih receptora remeti klirens endotelina-1 ovisan o receptorima i povećava njegovu koncentraciju. Osim toga, receptori tipa B uključeni su u regulaciju bubrežnih učinaka endotelina-1 i održavanje homeostaze vode i elektrolita, što je važno.
Trenutno je dokazana uloga endotelina u razvoju niza bolesti, uklj. AH, CHF, plućna hipertenzija, kronična bubrežna bolest; pokazuje blisku vezu između razine endotelina i metaboličkog sindroma, endotelne disfunkcije i aterogeneze. Od 1990-ih u tijeku je potraga za antagonistima endotelinskih receptora pogodnih za kliničku upotrebu; Već je poznato 10 lijekova ("sentans") s različitim stupnjevima selektivnosti za receptore tipa A / B. Prvi neselektivni antagonist endotelinskih receptora - bosentan - u kliničkoj studiji na bolesnicima s hipertenzijom pokazao je hipotenzivnu učinkovitost usporedivu s onom ACE inhibitora enalaprila. Daljnje studije o učinkovitosti antagonista endotelina u hipertenziji pokazale su njihovu kliničku važnost u liječenju rezistentne hipertenzije i visokog kardiovaskularnog rizika. Ovi su podaci dobiveni u dva velika klinička ispitivanja DORADO (n=379) i DORADO-AC (n=849), u kojima je darusentan dodan u trostruku kombiniranu terapiju u bolesnika s rezistentnom hipertenzijom. U studiji DORADO bolesnici s rezistentnom hipertenzijom povezani su s kroničnom bubrežnom bolešću i proteinurijom, a kao posljedica dodatka darusentana uočeno je ne samo značajno sniženje krvnog tlaka, već i smanjenje izlučivanja proteina. Antiproteinurijski učinak antagonista endotelinskih receptora naknadno je potvrđen u studiji na pacijentima s dijabetičkom nefropatijom koji su koristili avocentan. Međutim, u studiji DORADO-AC nije bilo prednosti u dodatnom sniženju AT u odnosu na usporedne lijekove i placebo, što je bio razlog za prekid daljnjih studija. Osim toga, u 4 velike studije antagonista endotelina (bosentan, darusentan, enrasentan) u bolesnika s CHF dobiveni su proturječni rezultati, što se objašnjava povećanjem koncentracije endotelina-1. Daljnje ispitivanje antagonista endotelinskih receptora obustavljeno je zbog štetnih učinaka povezanih sa zadržavanjem tekućine (periferni edem, preopterećenje volumenom). Razvoj ovih učinaka povezan je s učinkom antagonista endotelina na receptore tipa B, što je promijenilo potragu za lijekovima koji utječu na endotelinski sustav drugim putovima; i antagonisti endotelinskih receptora trenutno imaju samo jednu indikaciju, liječenje plućne hipertenzije.
Uzimajući u obzir veliku važnost endotelinskog sustava u regulaciji vaskularnog tonusa, u tijeku je potraga za drugim mehanizmom djelovanja putem vazopeptidaze - EPF, koji je uključen u stvaranje aktivnog endotelina-1 (slika 3). Blokiranje ACE i kombinacija s inhibicijom NEP-a može učinkovito suzbiti stvaranje endotelina-1 i pojačati učinke natriuretskog peptida. Prednosti dvojnog mehanizma djelovanja su, s jedne strane, u sprječavanju nedostataka NEP inhibitora povezanih s mogućom vazokonstrikcijom posredovanom aktivacijom endotelina, s druge strane, natrijuretsko djelovanje NEP inhibitora omogućuje kompenzaciju zadržavanja tekućine. povezana s neselektivnom blokadom endotelinskih receptora. Daglutril je dvostruki inhibitor NEP i EPF, koji je u fazi II kliničkih ispitivanja. Studije su pokazale izražene kardioprotektivne učinke lijeka zbog smanjenja srčanog i vaskularnog remodeliranja, regresije hipertrofije i fibroze.
Izravni inhibitori renina
Poznato je da ACE inhibitori i blokatori ATII receptora povećavaju aktivnost renina mehanizmom povratne sprege, što je razlog izbjegavanja učinkovitosti blokatora RAAS. Renin predstavlja prvi korak u kaskadi RAAS; proizvode ga jukstaglomerularne stanice bubrega. Renin preko angiotenzinogena potiče stvaranje ATII, vazokonstrikciju i lučenje aldosterona, a također regulira povratne mehanizme. Stoga inhibicija renina omogućuje postizanje potpunije blokade RAAS sustava. Potraga za inhibitorima renina traje od 1970-ih; dugo vremena nije bilo moguće dobiti oralni oblik inhibitora renina zbog njihove niske bioraspoloživosti u gastrointestinalnom traktu (manje od 2%). Prvi izravni inhibitor renina pogodan za oralnu primjenu, aliskiren, registriran je 2007. Aliskiren ima nisku bioraspoloživost (2,6%), dugi poluvijek (24-40 sati), ekstrarenalni put eliminacije. Farmakodinamika aliskirena povezana je s 80%-tnim smanjenjem razine ATII. U kliničkim ispitivanjima u bolesnika s hipertenzijom, aliskiren u dozama od 150-300 mg / dan doveo je do smanjenja SBP-a za 8,7-13 i 14,1-15,8 mm Hg. odnosno, i DBP - za 7,8-10,3 i 10,3-12,3 mm Hg. . Hipotenzivni učinak aliskirena primijećen je u različitim podskupinama bolesnika, uključujući bolesnike s metaboličkim sindromom, pretilošću; po težini bio je usporediv s učinkom ACE inhibitora, blokatora ATII receptora, a aditivni učinak zabilježen je u kombinaciji s valsartanom, hidroklorotiazidom i amlodipinom. Niz kliničkih studija pokazao je organoprotektivne učinke lijeka: antiproteinurijski učinak u bolesnika s dijabetičkom nefropatijom (AVOID studija, n=599), regresiju hipertrofije lijeve klijetke u bolesnika s hipertenzijom (ALLAY studija, n=465). Tako je u studiji AVOID nakon 3 mjeseca liječenja losartanom u dozi od 100 mg/dan i postizanja ciljne razine krvnog tlaka (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Osim toga, provodi se niz kliničkih studija aliskirena u liječenju drugih kardiovaskularnih bolesti s procjenom utjecaja na prognozu bolesnika: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n =7000) studije u bolesnika s CHF, studija ALTITUDE u bolesnika s dijabetes melitusom i visokim kardiovaskularnim rizikom, studija ASPIRE u bolesnika s postinfarktnim remodeliranjem.
Zaključak
Za rješavanje problema prevencije kardiovaskularnih bolesti nastavlja se stvaranje novih lijekova sa složenim višestrukim mehanizmom djelovanja, koji omogućuje potpuniju blokadu RAAS-a kroz kaskadu mehanizama hemodinamske i neurohumoralne regulacije. Potencijalni učinci takvih lijekova omogućuju ne samo pružanje dodatnog antihipertenzivnog učinka, već i postizanje kontrole razine krvnog tlaka u visokorizičnih pacijenata, uključujući rezistentnu hipertenziju. Lijekovi višestrukog mehanizma djelovanja pokazuju prednosti u izraženijem organoprotektivnom učinku, čime će se spriječiti daljnja oštećenja kardiovaskularnog sustava. Proučavanje prednosti novih lijekova koji blokiraju RAAS zahtijeva daljnje istraživanje i procjenu njihovog utjecaja na prognozu bolesnika s hipertenzijom i drugim kardiovaskularnim bolestima.


Književnost
1 Campbell D.J. Inhibicija vazopeptidaze: dvosjekli mač? // Hipertenzija. 2003 Vol. 41. Str. 383-389.
2. Laurent S., Schlaich M., Esler M. Novi lijekovi, postupci i uređaji za hipertenziju // Lancet. 2012. Vol. 380. Str. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Inhibitori vazopeptidaze: novi terapijski koncept kod kardiovaskularnih bolesti? // Cirkulacija. 2001 Vol. 104. Str. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Inhibicija neutralne endopeptidaze i natriuretski peptidni sustav: razvijajuća strategija u terapiji kardiovaskularnih bolesti // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Usporedba inhibitora vazopeptidaze, omapatrilata i lizinoprila na toleranciju napora i morbiditet u pacijenata sa zatajenjem srca: IMPRESS randomizirano ispitivanje // Lancet. 2000 Vol. 356. Str. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Usporedba omapatrilata i enalaprila u bolesnika s kroničnim zatajenjem srca: Omapatrilat protiv enalaprila randomizirano ispitivanje korisnosti u smanjenju događaja (OVERTURE) // Circulation. 2002 Vol. 106. Str. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Blokatori receptora angiotenzina II u bolesnika s angioedemom izazvanim ACE inhibitorom // Ann. Pharmacother. 2000 Vol. 34. Str. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat i enalapril u bolesnika s hipertenzijom: ispitivanje kardiovaskularnog liječenja omapatrilatom protiv enalaprila (OCTAVE) // Am. J. Hypertens. 2004 Vol. 17. Str. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Farmakokinetika i farmakodinamika inhibitora vazopeptidaze AVE7688 kod ljudi // Clin. Pharmacol. Ther. 2006 Vol. 79. Str. 49-61.
10. Gu J., Noe A., Chandra P. et al. Farmakokinetika i farmakodinamika LCZ696, novog dvostrukog inhibitora angiotenzinskog receptoraprilizina (ARNi) // J. Clin. Pharmacol. 2010 Vol. 50. Str. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Smanjenje krvnog tlaka s LCZ696, novim dvostrukim laktirajućim inhibitorom receptora angiotenzina II i neprilizina: randomizirano, dvostruko slijepo, placebom kontrolirano, aktivno usporedno ispitivanje // Lancet. 2010 Vol. 375. Str. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. Inhibitor neprilizina angiotenzinskog receptora LCZ696 u zatajenju srca s očuvanom ejekcijskom frakcijom: dvostruko slijepa randomizirana kontrolirana studija faze 2 // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endotelini // N. Engl. J. Med. 1995 Vol. 333. Str. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Uloga endotelina-1 u kliničkoj hipertenziji: 20 godina kasnije // Hipertenzija. 2008 Vol. 52. Str. 452-459.
15. Burnier M., Forni V. Antagonisti endotelinskih receptora: mjesto u liječenju esencijalne hipertenzije? // Nephrol. Biraj. presaditi. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. Učinak antagonista endotelinskih receptora, bosentana, na krvni tlak u bolesnika s esencijalnom hipertenzijom. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998 Vol. 338. Str. 784-790.
17. Weber M.A., Black H., Bakris G. et al. Selektivni antagonist endotelinskih receptora za smanjenje krvnog tlaka u bolesnika s hipertenzijom otpornom na liječenje: randomizirano, dvostruko slijepo, placebom kontrolirano ispitivanje // Lancet. 2009 Vol. 374. Str. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergentni rezultati korištenja kliničkog i ambulantnog krvnog tlaka: izvješće o ispitivanju hipertenzije otporne na darusentan // Hypertension. 2010 Vol. 56. Str. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan za očitu dijabetičku nefropatiju // J. Am. soc. Nefrol. 2010 Vol. 21. Str. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endotelinkonvertirajući enzim/neutralni inhibitor endopeptidaze SLV338 sprječava hipertenzivno preoblikovanje srca na način neovisan o krvnom tlaku // Hipertenzija. 2011 Vol. 57. Str. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Supresija angiotenzina II u ljudi teorijski aktivnim inhibitorom renina aliskirenom (SPP100): usporedba s enalaprilom // Hipertenzija. 2002 Vol. 39(1). P.E1-8.
22. Alreja G., Joseph J. Renin i kardiovaskularne bolesti: Istrošeni put ili novi smjer? // Svijet J. Cardiol. 2011 Vol. 3(3). Str. 72-83.
23. Ingelfinger J.R. Aliskiren i dvojna terapija u šećernoj bolesti tipa 2 // N. Engl. J. Med. 2008 Vol. 358(23). P. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (za istraživače ALLAY-a). Supresija aldosterona posreduje u regresiji hipertrofije lijeve klijetke u bolesnika s hipertenzijom // J. Renin-Angiotensin-Aldosterone System. 2011 Vol. 12. Str. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, novi inhibitor renina, djeluje renoprotektivno u modelu uznapredovale dijabetičke nefropatije u štakora // Diabetol. 2007 Vol. 50. Str. 2398-2404.


