Aldosteroni on ihmisillä kolesterolista peräisin olevien mineralokortikoidihormonien pääedustaja.
Synteesi
Se suoritetaan lisämunuaiskuoren glomerulaarivyöhykkeellä. Kolesterolista muodostuva progesteroni hapettuu peräkkäin matkallaan aldosteroniksi. 21-hydroksylaasi, 11-hydroksylaasi ja 18-hydroksylaasi. Lopulta muodostuu aldosteronia.

Steroidihormonien synteesin kaavio (täydellinen kaavio)
Synteesin ja erityksen säätely
Aktivoida:
- angiotensiini II vapautuu reniini-angiotensiinijärjestelmän aktivoitumisen aikana,
- lisääntynyt keskittyminen kalium-ionit veressä (liittyy kalvon depolarisaatioon, kalsiumkanavien avautumiseen ja adenylaattisyklaasin aktivoitumiseen).
Reniini-angiotensiinijärjestelmän aktivointi
- Tämän järjestelmän aktivoimiseksi on kaksi lähtökohtaa:
- paineen vähentäminen munuaisten afferenteissa arterioleissa, mikä määritetään baroreseptoreita juxtaglomerulaarisen laitteen solut. Syynä tähän voi olla mikä tahansa munuaisten verenkiertohäiriö - ateroskleroosi. munuaisvaltimot, lisääntynyt veren viskositeetti, kuivuminen, verenhukka jne.
- Na+-ionien pitoisuuden lasku primaarisessa virtsassa munuaisten distaalisissa tubuluksissa, jonka määräävät juxtaglomerulaarisen laitteen solujen osmoreseptorit. Esiintyy suolattoman ruokavalion seurauksena diureettien pitkäaikaisen käytön yhteydessä.
Reniinin (emäksisen) eritystä ylläpitää sympaattinen hermosto, jatkuvaa ja munuaisten verenkierrosta riippumatonta.
- Suorittaessasi yhtä tai molempia solun kohteita juxtaglomerulaarinen laite aktivoituvat ja niistä entsyymi erittyy veriplasmaan reniini.
- Plasmassa on substraatti reniinille - α2-globuliinifraktion proteiini angiotensinogeeni. Proteolyysin seurauksena dekapeptidi ns angiotensiini I. Lisäksi angiotensiini I mukana angiotensiiniä konvertoiva entsyymi(ACE) muuttuu angiotensiini II.
- Angiotensiini II:n pääkohteet ovat sileät myosyytit. verisuonet Ja glomerulaarinen aivokuori lisämunuaiset:
- verisuonten stimulaatio aiheuttaa niiden kouristuksen ja palautumisen verenpaine.
- erittyy lisämunuaisista stimulaation jälkeen aldosteroni vaikuttavat munuaisten distaalisiin tubuluksiin.
Aldosteronille altistuessaan munuaisten tubulukset lisäävät reabsorptiota Na + ionit, natriumin liikkeiden jälkeen vettä. Tämän seurauksena verenkiertoelimen paine palautuu ja natriumionien pitoisuus veriplasmassa ja siten primäärivirtsassa kasvaa, mikä vähentää RAAS:n toimintaa.

Reniini-angiotensiini-aldosteronijärjestelmän aktivointi
Toimintamekanismi
Sytosolinen.
Kohteet ja tehosteet
Vaikuttaa sylkirauhaset, munuaisten distaalisissa tiehyissä ja keräyskanavissa. Tehostaa munuaisten toimintaa natriumionien reabsorptio ja kalium-ionien menetys seuraavien vaikutusten kautta:
- lisää Na +,K + -ATPaasin määrää pohjakalvo epiteelisolujen,
- stimuloi mitokondrioiden proteiinien synteesiä ja lisää solussa tuotetun energian määrää Na +, K + -ATPaasin toimintaa varten,
- stimuloi Na-kanavien muodostumista munuaisten epiteelisolujen apikaalisella kalvolla.
Patologia
hyperfunktio
Conn oireyhtymä (primaarinen aldosteronismi) - esiintyy glomerulaarisen alueen adenoomissa. Sille on ominaista merkkikolmio: verenpainetauti, hypernatremia, alkaloosi.
Toissijainen hyperaldosteronismi - juxtaglomerulaaristen solujen hyperplasia ja hyperfunktio sekä reniinin ja angiotensiini II:n liiallinen eritys. Verenpaine nousee ja turvotus ilmaantuu.
Reniini-angiotensiini-aldosteronijärjestelmä on entsyymien ja hormonien kompleksi, jotka ylläpitävät homeostaasia. Säätelee suolan ja veden tasapainoa kehossa ja verenpainetta.
Toimiva mekanismi
Reniini-angiotensiini-aldosteronijärjestelmän fysiologia on peräisin aivokuoren rajalta ja siellä on juxtaglomerulaarisia soluja, jotka tuottavat peptidaasia (entsyymiä) - reniiniä.
Reniini on hormoni ja RAAS:n alkulinkki.
Tilanteet, joissa reniiniä vapautuu vereen
On useita olosuhteita, joissa hormoni pääsee verenkiertoon:
- Vähentynyt verenkierto munuaiskudoksessa - tulehdusprosessien (glomerulonefriitti jne.) kanssa diabeettinen nefropatia, munuaiskasvaimet.
- Väheneminen (verenvuoto, toistuva oksentelu, ripuli, palovammat).
- Verenpaineen lasku. Munuaisten valtimoissa on baroreseptoreita, jotka reagoivat systeemisen paineen muutoksiin.
- Muutos natriumionien pitoisuudessa. Ihmiskehossa on solukertymiä, jotka reagoivat veren ionikoostumuksen muutoksiin stimuloimalla reniinin tuotantoa. Suola on hukassa runsas hikoilu sekä oksentelua.
- Stressi, psykoemotionaalinen stressi. Munuaisia hermottavat sympaattiset hermot, jotka aktivoituvat negatiivisten psykologisten vaikutusten seurauksena.
Veressä reniini kohtaa proteiinin - angiotensinogeenin, jota maksasolut tuottavat ja joka ottaa siitä fragmentin. Muodostuu angiotensiini I, joka on angiotensiiniä konvertoivan entsyymin (ACE) toiminnan lähde. Tuloksena on angiotensiini II, joka toimii toisena linkkinä ja on voimakas vasokonstriktori. valtimojärjestelmä(supistaa verisuonia).
Angiotensiini II:n vaikutukset
Tarkoitus: lisätä valtimopaine.
- Edistää aldosteronin synteesiä lisämunuaiskuoren glomerulusalueella.
- Vaikuttaa nälän ja janon keskukseen aivoissa aiheuttaen "suolan" ruokahalun. Ihmisen käyttäytyminen motivoituu etsimään vettä ja suolaista ruokaa.
- Vaikuttaa sympaattiset hermot, edistää norepinefriinin vapautumista, joka on myös verisuonia supistava, mutta vähemmän heikko toiminnassa.
- Vaikuttaa verisuoniin aiheuttaen niiden kouristuksen.
- Osallistuu kroonisen sydämen vajaatoiminnan kehittymiseen: edistää proliferaatiota, verisuonten ja sydänlihaksen fibroosia.
- Vähentää
- Estää bradykiniinin tuotantoa.

Aldosteroni on kolmas komponentti, joka vaikuttaa munuaisten päätetiehyissä ja edistää kalium- ja magnesium-ionien erittymistä kehosta sekä natriumin, kloorin ja veden käänteistä imeytymistä (reabsorptiota). Tämän seurauksena kiertävän nesteen tilavuus kasvaa, verenpainearvot kohoavat ja munuaisten verenkierto lisääntyy. Aldosteronireseptoreita ei ole vain munuaisissa, vaan myös sydämessä ja verisuonissa.
Kun keho saavuttaa homeostaasin, verisuonia laajentavia aineita (verisuonia laajentavia aineita) - bradykiniiniä ja kallidiinia - alkaa muodostua. Ja RAAS-komponentit tuhoutuvat maksassa.
Reniini-angiotensiini-aldosteronijärjestelmän kaavio

Kuten mikä tahansa järjestelmä, RAAS voi epäonnistua. Reniini-angiotensiini-aldosteronijärjestelmän patofysiologia ilmenee seuraavissa olosuhteissa:
- Lisämunuaiskuoren vauriot (infektio, verenvuoto ja trauma). Aldosteronin puutostila kehittyy, ja elimistö alkaa menettää natriumia, kloridia ja vettä, mikä johtaa kiertävän nesteen määrän vähenemiseen ja verenpaineen laskuun. Tilanne kompensoituu esittelyllä suolaliuoksia ja aldosteronireseptorin stimulantit.
- Lisämunuaiskuoren kasvain johtaa aldosteronin liialliseen määrään, mikä tajuaa vaikutukset ja nostaa verenpainetta. Myös solujen jakautumisprosessit aktivoituvat, sydänlihaksen hypertrofiaa ja fibroosia esiintyy ja sydämen vajaatoiminta kehittyy.
- Maksan patologia, kun aldosteronin tuhoutuminen häiriintyy ja sen kerääntyminen tapahtuu. Patologiaa hoidetaan aldosteronireseptorin salpaajilla.
- Munuaisten tulehdukselliset sairaudet.

RAAS:n merkitys elämälle ja lääketieteelle
Reniini-angiotensiini-aldosteronijärjestelmä ja sen rooli elimistössä:
- hyväksyy Aktiivinen osallistuminen normaalin verenpaineindikaattorin ylläpitämisessä;
- varmistaa veden ja suolojen tasapainon kehossa;
- ylläpitää veren happo-emästasapainoa.
Järjestelmä saattaa kaatua. Toimimalla sen komponentteihin voit taistella verenpainetautia vastaan. Munuaisten hypertension esiintymismekanismi liittyy myös läheisesti RAAS:iin.
Erittäin tehokkaat lääkeryhmät, jotka syntetisoidaan RAAS-tutkimuksen ansiosta
- "Prily". ÄSSÄ. Angiotensiini I ei muutu angiotensiini II:ksi. Ei vasokonstriktiota - ei verenpaineen nousua. Valmisteet: Amprilan, Enalapril, Captopril, jne. ACE:n estäjät parantavat merkittävästi diabeetikkojen elämänlaatua ja ehkäisevät munuaisten vajaatoimintaa. Lääkkeet otetaan minimiannoksina, mikä ei aiheuta paineen laskua, vaan ainoastaan parantaa paikallista verenkiertoa ja glomerulussuodatusta. Lääkkeet ovat välttämättömiä munuaisten vajaatoiminnalle, krooninen sairaus sydämet ja toimivat yhtenä keinona hoitaa verenpainetautia (jos vasta-aiheita ei ole).
- "Sartaanit". Angiotensiini II -reseptorin salpaajat. Alukset eivät reagoi siihen eivätkä supistu. Lääkkeet: losartaani, eprosartaani jne.

Reniini-angiotensiini-aldosteronijärjestelmän vastakohta on kiniinijärjestelmä. Siksi RAAS:n estäminen johtaa kiniinijärjestelmän veren komponenttien (bradykiniinin jne.) lisääntymiseen, mikä vaikuttaa suotuisasti sydämen ja verisuonten kudoksiin. Sydänlihas ei koe nälkää, koska bradykiniini tehostaa paikallista verenkiertoa, stimuloi luonnollisten verisuonia laajentavien aineiden tuotantoa munuaisytimen soluissa ja keräyskanavien mikrosyyteissä - prostaglandiinit E ja I2. Ne neutraloivat angiotensiini II:n painetta aiheuttavan vaikutuksen. Verisuonet eivät ole puuskittaisia, mikä varmistaa riittävän verenkierron kehon elimiin ja kudoksiin, veri ei viipyy ja ateroskleroottisten plakkien ja veritulppien muodostuminen vähenee. Kiniinit vaikuttavat suotuisasti munuaisiin, lisäävät diureesia (päivittäistä virtsan eritystä).
Renin
- entsyymi, jonka syntetisoivat munuaisten afferenttien arteriolien juxtaglomerulaariset solut ja jonka MM on noin 40 kDa. Erityisen intensiivistä reniinin muodostumista tapahtuu munuaisiskemian aikana. Juxtaglomerulaaristen solujen sijainti tekee niistä erityisen herkkiä verenpaineen muutoksille sekä munuaistiehyiden läpi virtaavan nesteen Na +- ja K + -ionipitoisuuksille. Näistä ominaisuuksista johtuen mikä tahansa tekijöiden yhdistelmä, joka aiheuttaa nestetilavuuden vähenemisen (dehydraatio, verenpaineen lasku, verenhukka jne.) tai alenemisen NaCl-pitoisuus stimuloi reniinin vapautumista.
Samaan aikaan useimmat reniinin synteesin säätelijät toimivat läpi munuaisten baroreseptorit. Reniinin vapautumiseen vaikuttavat keskushermoston tila sekä kehon asennon muutos avaruudessa. Erityisesti makuuasennosta istuma- tai seisoma-asentoon siirryttäessä (klinostaattinen testi) reniinin eritys lisääntyy. Tämä refleksireaktio johtuu autonomisen osan sympaattisen osan sävyn lisääntymisestä hermosto, joka välittää impulsseja juxtaglomerulaaristen solujen b-adrenergisille reseptoreille.
Pääsubstraatti, johon reniini vaikuttaa, on angiotensinogeeni- proteiini, joka on osa 2-globuliinifraktiota ja jota maksaa maksa. Glukokortikoidien ja estrogeenien vaikutuksesta angiotensinogeenin synteesi lisääntyy merkittävästi. Reniinin toiminnan seurauksena angiotensinogeeni muuttuu dekapeptidiksi angiotensiiniminä Tällä yhdisteellä on erittäin heikko vaikutus, eikä sillä ole merkittävää vaikutusta verenpainetasoihin.
sillä välin angiotensiiniminä vaikutuksen alaisena ns angiotensiinia konvertoiva entsyymi (ACE) muuttuu voimakkaaksi vasokonstriktoritekijäksi - angiotensiiniII. ÄSSÄ(dipeptidikarboksipeptidaasi) on kiinteä proteiini, joka sijaitsee pääasiassa endoteelisolujen kalvolla, epiteelillä, yksitumaisilla soluilla, hermopäätteillä, sukuelinten soluilla jne. ACE:n liukoinen muoto on läsnä lähes kaikissa kehon nesteissä.
On tapana erottaa kaksi ACE:n isomuotoa. Ensimmäinen niistä sai koodinimen "somaattinen". Tämän isomuodon MM on 170 kDa ja se sisältää homologisia C- ja N-domeeneja. ACE:n toinen muoto ("reproduktiivinen") löytyy siemennesteestä, sen MM on noin 100 kDa ja se vastaa ensimmäisen ACE-isoformin C-domeenia. Jokainen kahdesta ilmoitetusta domeenista sisältää aminohappotähteitä, jotka voivat osallistua sidoksen muodostumiseen sinkkiatomin kanssa. Tällaiset Zn 2+ -rakenteet ovat tyypillisiä monille metalloproteinaaseille ja ovat pääasiallisia entsyymivuorovaikutuksen paikkoja sekä substraatin että ACE-estäjien kanssa.
On huomattava, että ACE ei johda vain muodostumiseen angiotensiini II, mutta myös tuhoaa bradykiniini - yhteys, joka laajenee verisuonet. Siksi ACE:n vaikutuksen alainen verenpaineen nousu liittyy sekä angiotensiini II:n muodostumiseen että bradykiniinin hajoamiseen (kuvio 32).
Tärkeä rooli ACE:n vaikutuksessa on ionikoostumuksella ja erityisesti kloridi-ionien pitoisuudella. Niinpä ACE:n Cl-C-domeenin korkealla konsentraatiolla sekä bradykiniini että angiotensiini-I hydrolysoituu nopeammin kuin N-domeeni. Solunulkoisilla alueilla, joilla kloridianionien pitoisuus on korkea, N-domeeni on pääasiallisesti vastuussa angiotensiini-I:n konversiosta. Kuitenkin solunsisäisesti, kun Cl:n pitoisuus on alhainen, N-domeeni voi osallistua muiden peptidiaineiden hydrolyysiin.
Takana viime vuodet todettiin, että ACE:llä on tärkeä rooli hematopoieesissa, koska sen vaikutuksen alaisena muodostuu hematopoieettinen peptidi hematopoieettisten solujen muodostumisen estäminen luuytimessä.
ACE:n rooli elimistössä tunnistettiin hiirillä, joista puuttui ACE-geeni. Tällaisilla eläimillä havaittiin alhaista verenpainetta, erilaisia verisuonten toimintahäiriöitä, munuaisten rakenteen ja toiminnan heikkenemistä sekä urosten hedelmättömyyttä.
AngiotensiiniII
lisää verenpainetta aiheuttamalla valtimoiden supistumista ja on tehokkain tunnettu vasoaktiivinen aine. Lisäksi se estää reniinin muodostumista ja vapautumista munuaisten juxtaglomerulaarisissa soluissa palautemekanismin avulla, minkä pitäisi lopulta palauttaa normaalit verenpainetasot. Vaikutuksen alaisena angiotensiiniII tärkeimmän mineralokortikoidin tuotanto lisääntyy jyrkästi - aldosteroni. Vaikka tämä vaikutus on suora, angiotensiini II ei vaikuta kortisolin tuotantoon. Aldosteronin päätarkoitus on säilyttää Na + (lisäämällä sen reabsorptiota munuaistiehyissä) ja K +:n ja H +:n vapautumista (pääasiassa munuaisten kautta). Nämä reaktiot suoritetaan seuraavasti.
Aldosteroni
tunkeutuu solunulkoisesta nesteestä solun sytoplasmaan ja yhdistyy siellä spesifiseen reseptoriin, minkä jälkeen muodostuva kompleksi (aldosteroni + reseptori) tunkeutuu tumaan. Aldosteroni stimuloi myös Na + -kanavien avautumista, minkä ansiosta Na + -ionit tulevat soluun apikaalisen kalvon kautta tubuluksen ontelosta.
K +:n erityksen lisääntyminen aldosteronin vaikutuksen alaisena johtuu apikaalisen kalvon läpäisevyyden lisääntymisestä suhteessa näihin ioneihin, minkä vuoksi K + tulee solusta tubuluksen onteloon.
Na +:n pysyminen kehossa, kuten angiotensiini II, edistää verenpaineen nousua.
AngiotensiiniII jotka kykenevät sitoutumaan lisämunuaisen glomerulaaristen solujen spesifisiin reseptoreihin. Näiden reseptorien sisältö riippuu suurelta osin K+-ionien pitoisuudesta. Joten jos K + -taso nousee, angiotensiini II -reseptorien määrä glomerulaarisissa soluissa kasvaa. K + -ionien pitoisuuden pienentyessä havaitaan päinvastainen vaikutus. Siksi K+-ioneilla on tärkeä rooli angiotensiini II:n vaikutuksessa lisämunuaisiin.
Takana Viime aikoina päätti sen angiotensiiniII pystyy aktivoimaan makrofageja, mikä lisää verihiutaleiden aggregaatiota ja nopeuttaa veren hyytymistä. Samalla se vapautuu aktivaattorin estäjä plasminogeeni-minä (IAP-1), johon voi liittyä fibrinolyysin masennus. A giotensiiniII on yksi tekijöistä, jotka myötävaikuttavat aterogeneesin kehittymiseen, apoptoosin estoon ja lisääntyneeseen oksidatiiviseen stressiin kudoksissa, mikä aiheuttaa verihiutaleiden aggregaatiota ja tromboosia.
AngiotensiiniII pystyy tehostamaan sydänlihaksen toimintaa, osallistuu norepinefriinin ja muiden fysiologisesti aktiivisten aineiden biosynteesiin. Samalla se voi toimia kasvutekijänä, mikä johtaa verisuonten ja sydämen hypertrofiaan.
Jotkut eläimet ja ihmiset angiotensiiniII entsyymin vaikutuksen alaisena aminopeptidaasit muunnetaan heptapeptidiksi angiotensiiniIII. Ihmisillä angiotensiini II:n taso on noin 4 kertaa korkeampi kuin angiotensiini III:n. Molemmat yhdisteet vaikuttavat verenpaineeseen ja aldosteronin tuotantoon, ja entsyymit hajottavat ne melko nopeasti. angiotensinaasi.
Vakavissa munuaissairauksissa, joihin liittyy niiden iskemia, havaitaan reniinin lisääntyneen muodostumisen ja erittymisen vuoksi jatkuvaa verenpaineen nousua ( munuaisten hypertensio). ACE-estäjien käyttö näissä olosuhteissa johtaa verenpaineen nopeaan normalisoitumiseen.
Lopuksi on vielä kerran korostettava, että angiotensiini-renino-aldosteronijärjestelmä liittyy läheisesti kallikreiini-kiniinijärjestelmän toimintaan, koska angiotensiini II:n muodostuminen ja bradykiniinin tuhoutuminen tapahtuvat saman vaikutuksen alaisena. entsyymi - ACE.
Catad_theme Verenpainetauti- artikkeleita
Catad_tema Lihavuus - Artikkelit
Liikalihavuus ja verenpainetauti
Lehdessä julkaistu:NAISTEN TERVEYDEN ONGELMAT № 4, osa 3, 2008
E.I.Astashkin, M.G.Glezer
Moskovan lääketieteellinen akatemia. I. M. Sechenov
YHTEENVETO
Katsauksessa analysoidaan liikalihavuuden roolia hypertension kehittymisessä ja sydän-ja verisuonitauti, tämän suhteen patofysiologiset mekanismit, reniini-angiotensiini-aldosteronijärjestelmän (RAAS) hallitseva rooli. Käsitellään liikalihavien potilaiden korkean verenpaineen farmakologisen korjaamisen kysymyksiä RAAS-salpaavien lääkkeiden ja verapamiilin kiinteällä yhdistelmällä. Esitetään analyysi sibutramiinin käytön tehosta ja turvallisuudesta painonpudotukseen potilailla, joilla on korkea verenpaine.
Avainsanat: liikalihavuus, verenpainetauti, hoito.
ABSTRAKTI
Kirjoittajat analysoivat liikalihavuuden roolia verenpainetaudin ja sydän- ja verisuonisairauksien kehittymisessä, tämän suhteen patofysiologisia mekanismeja ja renniini-angiotensiini-aldosteronijärjestelmän (RAAS) hallitsevaa roolia. Osoitettiin, että korkean verenpaineen farmakologinen korjaaminen lihavilla potilailla kiinteällä RAAS-salpaajien ja verapamiilin yhdistelmällä on tehokasta. Esitetään analyysi sibutramiinin tehokkuudesta ja turvallisuudesta painonpudotuksessa potilailla, joilla on korkea verenpaine.
avainsanat: liikalihavuus, verenpainetauti, hoito.
Käsiteltävän aiheen relevanssi johtuu siitä, että kaikkialla maailmassa liikalihavien määrä on viime vuosina lisääntynyt merkittävästi. Liikalihavuutta pidetään nykyään yhtenä tärkeimmistä sairauksien kehittymistä edistävistä tekijöistä, jotka ovat aikuisväestön kuolleisuuden pääasiallisia syitä. Ensinnäkin me puhumme tyypin 2 diabeteksen kehittymisestä sekä sydän- ja verisuonisairauksista onkologiset sairaudet. Painon nousu 1 kilolla lisää riskiä sairastua sydän- ja verisuonisairauksiin 3,1 % ja diabetekseen 4,5-9 %.
Tiedetään, että liikalihavuudessa riski sairastua verenpainetautiin – tekijä, joka vaikuttaa merkittävästi myös sydän- ja verisuonisairauksien, kuten sydänkohtausten ja aivohalvausten, esiintymiseen – on kolme kertaa suurempi kuin normaalipainoisilla ihmisillä. Kuten INTERSALT-tutkimuksessa osoitettiin, jokaista 4,5 painokiloa kohden systolinen verenpaine (BP) nousee 4,5 mmHg. Taide. .
Liikalihavuus riskitekijänä naisilla hypertensio, varsinkin vanhemmalla iällä, on yleisempää kuin miehillä. Yksi syy tähän on postmenopausaalisella kaudella esiintyvä hypoestrogenia. Joitakin liikalihavuuden esiintyvyyden piirteitä erityyppisissä valtimotaudissa havaitaan. Siten iäkkäillä naisilla, joilla on eristetty systolinen verenpaine, liikalihavuus on harvinaisempaa, eikä painonpudotuksen vaikutuksesta tähän potilasluokkaan ole tietoa. Naisilla, joilla on vatsan lihavuus ja systol-diastolinen verenpainetauti, painonpudotus on tärkeä pointti taudin hallinnassa.
Lihavuudessa esiintyy useita hemodynaamisia muutoksia, erityisesti verenkierron, aivohalvauksen tilavuuden ja sydämen minuuttitilavuuden lisääntymistä suhteellisen normaalilla verisuonivastuksella. Uskotaan, että liikalihavien potilaiden korkea verenpaine johtuu pääasiassa lisääntyneestä sydämen minuuttitilavuudesta ja "riittämättömän normaalista" perifeerisesta resistanssista.
Tämä hemodynaaminen tila stimuloi kahta antagonistista säätelyjärjestelmää, jotka säätelevät veren määrää ja perifeerinen vastus- reniini-angiotensiini-aldosteronijärjestelmä (RAAS) ja sydämen natriureettisten peptidien järjestelmä. Niiden säätelyhäiriöt voivat suurelta osin selittää korkean sydämen minuuttimäärän liikalihavilla hypertensiivisillä potilailla. Lisäksi nämä sydän- ja verisuonijärjestelmän säätelyjärjestelmät ovat osallisina aineenvaihdunnan muutoksissa, jotka liittyvät ylipainoon sydän- ja verisuonitaudeissa.
Joten liikalihavuuden kanssa valtimotaudin patogeneesissä kolmella päämekanismilla on merkittävä rooli:
Verenpainetaudin ja sydän- ja verisuonisairauksien kehittymisen patogeneesi liikalihavuudessa on esitetty kaavamaisesti kuvassa 1.
Kuva 1. Kaavio verenpainetaudin ja sydän- ja verisuonitautien patogeneesistä liikalihavuudessa
Systeeminen ja kudosreniini-angiotensiini-aldosteronijärjestelmä ja sen muutokset liikalihavuudessa
RAAS:n koostumus sisältää angiotensinogeeniä, reniiniä, angiotensiini I:tä, angiotensiiniä konvertoivaa entsyymiä (ACE) ja angiotensiini II:ta (AT II). AT II:lla on monipuolinen vaikutus erilaisiin soluihin, joilla on spesifisiä reseptoreita.
Klassisten käsitteiden mukaan angiotensinogeeniä muodostuu maksassa ja munuaisten periglomerulaarisissa soluissa (juxtaglomerulaarisissa soluissa) syntetisoituneen reniinin vaikutuksesta angiotensinogeeni muuttuu veressä angiotensiini I:ksi. ACE on vastuussa AT I:n hajoamisesta, mikä johtaa AT II:n muodostumiseen.
On tärkeää huomata, että liikalihavuudessa RAAS:n säätelymekanismit rikkovat. Fysiologisissa olosuhteissa RAAS-aktiivisuuden lisääntyminen johtaa resistenssin lisääntymiseen perifeeriset verisuonet ja sen seurauksena verenpaineen nousu. Palauteperiaatteen mukaan verenpaineen nousun tulisi aiheuttaa reniinin erityksen laskua, AT II -tason laskua ja aldosteronipitoisuuden laskua. Tämä puolestaan vähentää nesteen ja natriumin kertymistä ja ylläpitää verenpainetta normaalilla tasolla.
Kuitenkin potilailla, joilla on viskeraalinen liikalihavuus, RAAS:n systeemisten verenkierron komponenttien tason säätely on heikentynyt. Huolimatta kohonneesta verenpaineesta, natriumin ja nesteen kertymisestä sekä kiertävän veren tilavuuden kasvusta plasman reniini- ja aldosteroniaktiivisuus pysyy normaalina tai jopa hieman kohonneena. Tällainen RAAS:n säätelyhäiriö liikalihavuudessa voi johtua RAAS-komponenttien muodostumisen lisääntymisestä ja/tai niiden pitoisuuden toissijaisesta kasvusta, joka johtuu natriureettisen peptidijärjestelmän puutteista.
Todettiin, että veren RAAS:n lisäksi on kudosta eli ns. paikallinen RAAS, jota havaittiin useissa kudoksissa ja elimissä, kuten aivoissa, sydämessä, verisuonissa, munuaisissa, kiveksissä, rasvakudoksessa jne. .
Kuten tiedetään, kahdella tekijällä on keskeinen rooli AT II:n muodostumisessa: reniiniaktiivisuus ja angiotensinogeenipitoisuus. Angiotensinogeenin synteesi ja eritys soluissa eri tyyppiä ei vain määritä AT II:n paikallisen pitoisuuden kasvua, vaan lisää myös RAAS:n systeemistä aktiivisuutta. Krooninen AT II:n infuusio hiiriin liittyi merkittävään angiotensinogeenin mRNA-pitoisuuden lisääntymiseen rasvasoluissa. Nämä tulokset osoittavat positiivisen palautteen olemassaolon AT II:n ja angiotensinogeenin välillä, kun yhden aineen tason nousu stimuloi toisen muodostumista. Lihavuudessa, erityisesti viskeraalisessa lihavuudessa, plasman reniiniaktiivisuus säilyy, kuten jo mainittiin, normaalilla tai jonkin verran kohonnut taso ja angiotensinogeenin ja AT II:n tasot kohoavat.
Rasvakudoksen rakenne ja fysiologiset ominaisuudet
Rasvakudos koostuu erityyppisistä soluista, mukaan lukien rasvasolut, makrofagit, fibroblastit, verisuonten endoteelisolut ja preadiposyytit (adipoblastit). Jälkimmäinen solutyyppi on peräisin pluripotenteista mesodermikantasoluista. Aikuisen ihmisen kehon preadiposyyteistä muodostuu uusia erilaistuneita ("pieniä") rasvasoluja. Näiden rasvasolujen koko kasvaa ("suuret" adiposyytit) lisääntyneen ravinnonsaannin vuoksi. rasvahapot. Pitkäketjuiset rasvahapot kulkeutuvat adiposyytteihin verestä ja kerrostuvat neutraaleina triasyyliglyseroleina. Rasvakudos on vastuussa pitkäketjuisten rasvahappojen varastoinnista ja erityksestä, jotka toimivat yhtenä tärkeimmistä energiasubstraateista monille elimille ja kudoksille, kuten sydän- ja luustolihaksille. "Suuret" adiposyytit erittävät huomattavasti enemmän tyydyttyneitä rasvahappoja. Triglyseridien hydrolyysi ja rasvahappojen vapautuminen tapahtuvat solunsisäisen hormoniherkän lipaasin vaikutuksesta, jonka aktiivisuutta säätelevät katekoliamiinit (positiivinen säätely) ja insuliini (negatiivinen säätely).
Rasvakudoksen endokriininen toiminta
Toisin kuin ihonalaista rasvaa, joka muodostaa yleensä 75 % kehon kokonaisrasvakudoksesta ja on pääasiallinen lipidien varasto, sisäelinten rasvaa pidetään tällä hetkellä aktiivisena hormoneja tuottavana kudoksena.
Adiposyytit tuottavat laaja valikoima hormonit ja sytokiinit, jotka osallistuvat glukoosiaineenvaihduntaan (adiponektiini, resistiini jne.), lipideihin (kolesteroliesterin siirtoproteiini), tulehdukseen (TNF-α, interleukiini-6), koagulaatioon (plasminogeeniaktivaattori-1-estäjä), verenpaineen säätelyyn (angiotensinogeeni, AT II), syömiskäyttäytyminen(leptiini), sekä vaikuttaa eri elinten ja kudosten aineenvaihduntaan ja toiminnalliseen toimintaan, mukaan lukien lihakset, maksa, aivot ja verisuonet (katso taulukko).
Pöytä. endokriininen toiminta adiposyytit: adiposytokiinit
| Adiposytokiinit | Adiposytokiinien vaikutukset |
| Leptiini | Ruoan imeytyminen, rasvamassa |
| Adiponektiini | |
| vastustaa | Insuliiniresistenssi, tulehdus |
| Visfatiini | insuliiniresistenssi |
| omentin | insuliiniresistenssi |
| Serpiini vapautuu viskeraalisesta rasvakudoksesta (Vaspin) | insuliiniresistenssi |
| Apelin | Vasodilataatio |
| Kolesteroliesterin siirtoproteiini (CETP) | lipidien aineenvaihdunta |
| Lipoproteiinilipaasi (LPL) | lipidien aineenvaihdunta |
| Hormoniherkkä lipaasi (HSL) | lipidien aineenvaihdunta |
| Proteiinia sitovat rasvahapot adiposyyteissä-4 (A-FABP-4 (aP2)) | lipidien aineenvaihdunta |
| Perlipin | lipidien aineenvaihdunta |
| Renitolia sitova proteiini (RBP) | lipidien aineenvaihdunta |
| Proteiinia stimuloiva asylaatio (ASP) | lipidien aineenvaihdunta |
| Angiotensiini II (AT II) | Valtimopaine |
| Angiotensiinia konvertoiva entsyymi (ACE) | Valtimopaine |
| Angiotensinogeeni (AGT) | Valtimopaine |
| Tuumorinekroositekijä alfa (TNF-a) | Tulehdus |
| Interleukiini, 6 (IL-6) | Tulehdus |
| C-reaktiivinen proteiini (CRP) | Tulehdus |
| Adiposyyttitrypsiini/komplementtitekijä D (adipsiini) | Tulehdus |
| Makrofagikemoattraktanttiproteiini-1 (MCP-1) | Makrofagien houkutin |
| Solujen välinen adheesiomolekyyli-1 (ICAM-1) | Makrofagien aktivointi |
| Plasminogeenin aktivaattorin estäjä-1 (PAI-1) | fibrinolyysi |
On tärkeää korostaa, että jopa pieni volyymin lisäys viskeraalinen rasva sillä on merkittävä rooli aineenvaihduntahäiriöissä, vesi- ja elektrolyyttitasapainon säätelyssä sekä sydän- ja verisuonisairauksissa.
Rasvakudoksen massan kasvaessa lähes kaikkien adipokiinien pitoisuus veressä kasvaa. Poikkeuksena on adiponektiini, jonka taso laskee näissä olosuhteissa. Leptiini ja adiponektiini ovat tällä hetkellä tutkituimpia adipokiineja.
Leptiini. Leptiinin tuotanto tapahtuu pääasiassa "suurissa" rasvasoluissa. Leptiini nähdään usein signaalimolekyylinä, joka välittää ravinteiden saannin, rasvakudoksen ja keskushermoston (hypotalamuksen) välistä suhdetta. Leptiini lisää lipidien hapettumista maksassa sekä lipolyysiä rasvasoluissa ja luustolihakset. Insuliini stimuloi leptiinin tuotantoa. Leptiinitasoihin vaikuttavat myös vapaat rasvahapot, TNF-α, estrogeenit ja kasvuhormoni.
Adiponektiini. Adiponektiinin muodostuminen tapahtuu yksinomaan rasvasoluissa. Adiponektiinilla on erilaisia biologisia vaikutuksia - sillä on antiaterogeeninen vaikutus, se lisää solujen herkkyyttä insuliinille, estää glukoosin synteesiä maksassa, tehostaa sen kuljetusta lihaksiin ja lisää rasvahappojen hapettumista. Adiponektiinitasot laskevat liikalihavuudessa, insuliiniresistenssissä ja tyypin 2 diabeteksessa.
Rasvakudos ja RAAS-aktiivisuus
Kävi ilmi, että rasvakudos on toisella sijalla maksan jälkeen angiotensinogeenin muodostuksessa. Esimerkiksi angiotensinogeenin mRNA:n määrä rasvasoluissa on noin 70 % maksan määrästä. Angiotensinogeenin tason, liikalihavuuden ja valtimoverenpainetaudin välinen suhde on selvästi osoitettu kokeissa siirtogeenisten hiirten mallilla, jotka ilmentävät liiallisia määriä angiotensinogeenia rasvakudoksessa. Näillä hiirillä on sisäelinten liikalihavuus ja verenpainetauti. Preadiposyytit ja erilaistuneet rasvasoluja niillä on täydellinen sarja komponentteja, jotka ovat välttämättömiä AT II:n paikalliseen synteesiin, sekä AT 1 -reseptori AT II:lle, joka tarjoaa AT II:n laukaisemien aktivaatiosignaalien solunsisäisen siirron. Liikalihavuuden yhteydessä viskeraalisten erilaistuneiden rasvasolujen tilavuus kasvaa 20-30 kertaa. Lihavuudelle on tyypillistä rasvasolujen toimintahäiriö, joka ymmärretään erilaisten adipokiinien, sytokiinien muodostumisen ja erittymisen lisääntymisenä sekä RAAS-komponenttien pitoisuuden lisääntymisenä, pääasiassa sisäelinten rasvassa.
Yhteenvetona eri tutkimusten tuloksista voidaan todeta, että liikalihavuuden myötä RAAS-aktiivisuus lisääntyy, mikä heijastuu seuraaviin seikkoihin:
korkea aktiivisuus RAAS puolestaan johtaa rasvakudoksen massan kasvuun. Erityisesti siirtogeenisten hiirten, jotka yliekspressoivat angiotensinogeeniä vain rasvasoluissa, on osoitettu lisäävän angiotensinogeenin tasoja veressä, kehittävän verenpainetautia ja lisäävän rasvakudosmassaa. Kudos AT II toimii olennaisesti rasvasolujen kasvutekijänä. AT 1 - reseptoreihin vaikuttava AT II lisää sykliini D 1 : n proteiinia , joka osallistuu rasvasolujen kasvun ja jakautumisen säätelyyn . On osoitettu, että AT II indusoi G1-faasin läpikulkua solusykli ihmisen preadiposyyteissä. Tämä vaikutus yhdistettiin vaikutukseen AT 1 -reseptoreihin ja sitä seuraavaan sykliini D 1 -riippuvaisen kinaasin aktivaatioon.
On osoitettu, että AT II aiheuttaa preadiposyyttien erilaistumista, aktivoi lipidien muodostumisen (lipogeneesi) avainentsyymejä ja lisää triglyseridien kertymistä rasvasoluihin.
Viskeraaliseen liikalihavuuteen liittyy 11-beeta-hydroksisteroididehydrogenaasin tyypin 1 aktiivisuuden lisääntyminen, mikä johtaa kortisolin muodostumiseen, joka on keskeinen hormoni preadiposyyttien erilaistumisessa adiposyyteiksi.
Kudos-RAS:n aktiivisuus liittyy läheisesti rasvakudoksen adipokiinien tuotantoon. Esimerkiksi AT II:n on osoitettu indusoivan leptiinin ilmentymistä rasvasoluissa. On ehdotettu, että tällainen aktiivisuus on ominaista vain paikallisesti syntetisoidulle AT II:lle, toisin kuin systeemiselle AT II:lle.
Liikalihavuus ja sympaattisen hermoston toiminta
Lihavuudessa, erityisesti sen vatsalihasmuodossa, havaitaan hyvin usein sympaattisen hermoston aktivoitumista. Normotesive Aging Study (NAS) -tutkimus havaitsi virtsan norepinefriinin lisääntymisen suhteessa painoindeksiin. Painonpudotuksen myötä sympaattisen hermoston toiminta heikkenee.
Sympaattisen hermoston lisääntynyt aktiivisuus liikalihavuudessa edistää hyperinsulinemian ja insuliiniresistenssin esiintymistä. Insuliini voi itsessään lisätä sympatoadrenaalisen järjestelmän toimintaa, mutta tämä voi johtua osittain leptiinin vaikutuksesta. Tiedetään, että liikalihavuuden lisääntyessä rasvasolujen erittämän leptiinin paastotaso nousee. Leptiini lisää sympaattisen hermoston toimintaa, erityisesti munuaisissa. Tämä johtaa toisaalta korkeaan tehoon ja sydämen sykkeen nousuun ja toisaalta natriumin takaisinabsorption lisääntymiseen ja suonensisäisen veren tilavuuden kasvuun.
RAAS:n ja sympaattisen hermoston välinen yhteys on osoitettu. Reniinin erittymisen lisääntyminen munuaisissa liittyy sympaattisen hermoston aktivoitumiseen, ja tämä tapahtuu riippumatta siitä, onko munuaistensisäinen. aistijärjestelmä säätelee munuaisten reniinin eritystä. Lisäksi syklisen adenosiinimonofosfaatin lisääntyminen katekoliamiinien vaikutuksen alaisena stimuloi angiotensinogeenin ilmentymistä ihmisen rasvasoluissa. AT II:n tason nousu lisää ihmisen sympaattisen hermoston aktiivisuutta. On osoitettu, että AT II aktivoi paikallista sympaattista hermostoa, joka osallistuu kehon lämpötilan nousuun (termogeneesi). Kylmäkäsittely johtaa AT II -pitoisuuden lisääntymiseen rasvasoluissa ilman samanaikaista muutosta plasman AT II -tasossa.
Siten liikalihavuuden RAAS-sääntelyhäiriöt voivat myös stimuloida sympaattisen hermoston toimintaa.
Menetelmät kohonneen verenpaineen farmakologiseen korjaamiseen liikalihavuudessa
Eri patogeneettisten mekanismien osuus korkean verenpaineen ylläpitämisessä liikalihavuudessa voi olla erilainen. Siksi tässä tilanteessa verenpainetta alentavilla lääkkeillä, joilla on erilaisia vaikutusmekanismeja, voi olla edullinen vaikutus.
Nykyisten verenpainetaudin hoitosuositusten mukaisesti avain verenpaineen merkittävään laskuun on yhdistelmähoidon käyttö. Lihavuuspotilaille tällaisen hoidon pääkomponenttien tulisi ensinnäkin sisältää yhdistelmä lääkkeitä, jotka vähentävät RAAS:n toimintaa (ACE:n estäjät ja sartaanit), lääkkeitä, jotka vähentävät sympaattisen hermoston toimintaa (beetasalpaajat ja ei-dihydropyridiinikalsiumantagonistit) ja diureetit. Korkea hyötysuhde RAAS:n estävien lääkkeiden käyttö liikalihavuudessa on osoitettu monissa tutkimuksissa. Mitä tulee beetasalpaajien käyttöön, tiedot ovat hyvin ristiriitaisia, mikä johtuu ensisijaisesti epäilyistä niiden käyttökelpoisuudesta potilaiden, joilla on komplisoitumatonta verenpainetautia, ja toiseksi, koska β-salpaajat, ainakin klassiset, voivat lisätä potilaiden painoa ja lisää insuliiniresistenssiä. Siksi, jos β-salpaajat valitaan liikalihavuuden tai metabolisen oireyhtymän potilaiden hoitoon, näiden tulee olla lääkkeitä, joilla on erityisiä ominaisuuksia, erityisesti karvediloli ja nebivololi.
Samanaikaisesti on todettu, että ei-dihydropyridiini-kalsiumantagonisti verapamiili voi paitsi merkittävästi vähentää verenpainetta, myös vähentää sympaattisen hermoston aktiivisuutta.
Siten liikalihavuuden tapauksessa RAAS-salpaavien lääkkeiden ja verapamiilin yhdistelmää voidaan käyttää verenpainetaudin hoitoon.
On syytä korostaa, että tämän tyyppinen yhdistelmä lääkkeet on olemassa valmiin yhdistelmän muodossa annosmuoto- lääke Tarka, joka sisältää koostumuksessaan rasvaliukoista ACE-estäjää - trandolapriilia ja hitaasti vapautuvaa verapamiilia (verapamiili SR). Tämä lähestymistapa on erittäin tärkeä tehokkaan hoidon kannalta, koska valmiiden annosmuotojen käyttö parantaa potilaan sitoutumista hoitoon.
On näyttöä siitä, että Tarka alentaa verenpainetta enemmän kuin mikään sen ainesosista, sillä on selvä kyky vähentää vasemman kammion hypertrofiaa, edistää endoteelin toiminnan normalisoitumista ja on metabolisesti neutraali, jopa diabetes mellitusta sairastavilla potilailla.
kaksinkertainen toiminta- RAAS-aktiivisuuden väheneminen trandolapriilin vaikutuksen alaisena ja sympaattinen hermosto verapamiilin pitkittyneen vaikutuksen vuoksi - vaikuttavat merkittävästi patogeneettiset mekanismit hypertension kehittyminen liikalihavuudessa ja mekanismit, jotka aiheuttavat vaurioita kohde-elimiin tämäntyyppisessä verenpaineessa.
Erityistä huomiota liikalihavuuden hypertension hoidosta käsiteltäessä on kiinnitettävä huomiota siihen, että trandalapriilin ja pitkävaikutteisen verapamiilin yhdistelmään perustuva hoito voi vähentää diabetes mellituksen kehittymisriskiä verrattuna toiseen hoitotaktiikkaan - sartaanin yhdistelmään. pienellä annoksella tiatsididiureettia. STAR-tutkimuksen tulokset osoittavat selvästi, että kun Tarkaa käytetään vuoden ajan, vähemmän ihmisiä, joilla on metabolinen oireyhtymä, jossa vatsalihavuus on hallitseva rooli, kehittyy diabetes(Kuva 2) .
Kuva 2. Uusien diabetes mellitustapausten kehitys (paastoglukoosi > 126 mg/dl tai 2 tunnin glukoosin sietotesti > 200 mg/dl) verenpainetta alentavan hoidon tyypeittäin ihmisillä, joilla on metabolinen oireyhtymä STAR-tutkimuksessa

Lisäksi STAR-LET-tutkimuksen mukaan, vaikka diabetes mellitus esiintyisi taustalla huumeterapia näiden potilaiden siirto Tarka-lääkkeen vastaanotolle mahdollisti puolet potilaista normalisoitua hiilihydraattiaineenvaihduntaa.
Näiden tutkimusten tulokset edellyttävät, että suosituksia on harkittava uudelleen huumeterapia verenpainetaudin potilailla, joilla on metabolinen oireyhtymä, ja aloita hoito ACE-estäjää (tai sartaania) ja kalsiumantagonistia sisältävällä yhdistelmällä tai siirrä potilaat tällaiseen hoitoon.
Kuten on toistuvasti mainittu, verenpainetaudin hoidossa potilaiden painon ja vatsan lihavuuden asteen vähentämisellä on tärkeä rooli. Tietysti painonpudotus tavalla tai toisella voi vaikuttaa merkittävästi sydän- ja verisuonitautien esiintyvyyden vähentämiseen. Tällä hetkellä on olemassa erilaisia lähestymistapoja liikalihavuuden lääkehoitoon. Ensimmäinen on oireenmukaista hoitoa, nimittäin kulutettujen kalorien määrän vähentäminen vähentämällä rasvan imeytymistä ruoasta. Tällaista lähestymistapaa voidaan kutsua kompensoivaksi. Itse asiassa tällaisella hoidolla tautia ei poisteta (koska potilas jatkaa ylensyöntiä), vaan lääke kompensoi sitä vain tilapäisesti. Toinen lähestymistapa ylipainon ja liikalihavuuden hoitoon on puuttua ongelman ytimeen, nimittäin krooniseen ylensyömiseen. Näin sibutramiini (Meridian lääke) toimii. Se johtaa nopeaan kyllästymiseen, vähentää kulutetun ruoan määrää estämällä norepinefriinin ja serotoniinin takaisinottoa hermosolujen synapseissa. Tänään Meridia on ainoa alkuperäinen lääke liikalihavuuden syyn poistaminen.
Perimmäinen ero sibutramiinin välillä on se, että se edistää kylläisyyden tunteen aikaistumista aiheuttamatta ruokahalun laskua. Ihminen pääsee eroon patologisesta ylensyöntitottumuksesta, mikä johtaa asteittaiseen ja tasaiseen painon laskuun. Sibutramiinin vaikutuksen alaisena ruoan saanti vähenee noin 20 %. Tämän ohella sibutramiini vaikuttaa epäsuorasti veren biogeenisten amiinien tasoon, jotka aktivoivat adrenoreseptoreita rasvakudoksessa ja käynnistävät lipolyysin rasvasoluissa, johon liittyy veren energiasubstraattipitoisuuden muutos. Sibutramiini tehostaa β 2 - ja β 3 -adrenergisten reseptorien aktivoitumisen vuoksi termogeneesin prosesseja ja lisää kehon energiankulutusta.
Sibutramiinin (Meridia) kliininen teho ja turvallisuus on osoitettu suurissa määrissä monikeskustutkimukset. Erityisesti STORM (Sibutramine Trial on Obesity Reduction and Maintenance) -tutkimuksessa, johon osallistui 605 liikalihavaa potilasta, osoitettiin, että kahden vuoden sibutramiinin saanti alensi potilaiden painoa 3 kertaa ja vyötärön ympärysmitta - 2 kertaa enemmän. voimakkaammin kuin lumelääke.. Tärkeää on, että 80 % potilaista säilytti painonpudotuksensa kahden vuoden ajan verrattuna 16 %:iin lumelääkepotilaista (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов korkea tiheys nousi 21 % matalatiheyksisten lipoproteiini- ja triglyseridipitoisuuksien laskun myötä.
Painonpudotuksen myönteinen vaikutus hypertensiopotilaiden ja muiden sydän- ja verisuonitautien hoidossa voi olla myös se, että vatsansisäisen rasvan vähentäminen voi vähentää munuaisten mekaanista puristusta, mikä voi johtaa verenkierron paranemiseen ja verenkiertoon. RAAS-aktiivisuuden lasku. Rasvakudoksen vähentäminen munuaisissa ja niiden ympärillä voi johtaa interstitiaalisen paineen laskuun, Henley-silmukan ohuen osan puristumiseen, verenvirtauksen lisääntymiseen vasa rectassa ja Na +:n ja veden tubulaarisen takaisinabsorption vähenemiseen. Siten ei-lääke- tai lääkekorjausmenetelmien aiheuttama painonpudotus voi alentaa verenpaineen korkeutta.
Kuitenkin viime aikoihin asti, todella hoitokäytäntö sibutramiinia käytettiin varoen, koska se pelkäsi sen mahdollista negatiivinen vaikutus verenpaineeseen ja sydämen sykkeeseen, mikä puolestaan voi johtaa, vaikkakin pienelle määrälle potilaita, epämiellyttäviin subjektiivisia tunteita. Tutkiakseen sibutramiinin vaikutusta sydän- ja verisuonijärjestelmään ja todistaakseen lääkkeen turvallisuutta potilasryhmässä, jolla on kohonnut sydän- ja verisuonisairauksien riski, toteutettiin laajamittainen monikeskus, kaksoissokkoutettu, lumekontrolloitu kansainvälinen tutkimus SCOUT (Sibutramine Cardiovascular). OUTcomes) aloitettiin, jossa havaittiin 10 742 potilasta, joista 97 %:lla oli sairauksia. sydän- ja verisuonijärjestelmästä 88 - verenpainetauti ja 84 % - tyypin 2 diabetes mellitus. Tutkimuksen ensimmäisen valmistuneen vaiheen tulosten mukaan sibutramiinin määrääminen johti merkittävään (p< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Herää luonnollinen kysymys, kuinka tämä tai tuo verenpainetta alentava hoito korreloi sibutramiinihoidon kanssa. Useita tutkimuksia on tehty tähän kysymykseen vastaamiseksi. Esimerkiksi verapamiilia 180 mg / trandolapriilia 2 mg sisältävän yhdistetyn annosmuodon käyttö yhdessä 10 mg sibutramiinin kanssa johti selvempään verenpaineen laskuun 6 kuukauden aikana kuin pelkkä verenpainelääkitys - systolinen verenpaine laski, vastaavasti. 21,9 ± 8,1 vs. 15,9 ± 12,3 mm Hg. Taide. ja diastolinen - 15,7 ± 8,1 vs. 9,1 ± 9,9 mmHg. Taide. (p = 0,03). Yhdistelmähoito johti myös selvempään antropometristen parametrien paranemiseen; luotettava (s<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
Prospektiivisessa, monikeskus-, lumekontrolloidussa, kaksoissokkoutetussa HOS-tutkimuksessa (Hypertension-Obesity-Sibutramine) 16 viikon ajan, vertailtiin erilaisten verenpainetta alentavien hoito-ohjelmien tehokkuutta (felodipiini 5 mg / ramipriili 5 mg (n = 57)). , verapamiili 180 mg / vrk), trandolapriili 2 mg (n = 55), metoprololisukkinaatti 95 mg/hydroklooritiatsidi 12,5 mg n = 59) sibutramiinin ja lumelääkkeen kanssa. Tässä tutkimuksessa vahvistettiin, että sibutramiini voi nostaa verenpainetta. Siksi on tietysti tarpeen suorittaa riittävästi verenpainetta alentavaa hoitoa sibutramiinin käytön aikana potilailla, joilla on korkea verenpaine. On myös osoitettu, että hoidossa beetasalpaajan ja hydroklooritiatsidin yhdistelmällä sibutramiinin positiiviset vaikutukset painonpudotukseen, vyötärön ympärysmittaan ja aineenvaihduntaprofiiliin olivat huomattavasti vähäisempiä kuin yhdistelmähoidolla ACE:n kanssa. estäjät ja kalsiumantagonistit sibutramiinin kanssa. Tämä vahvistaa jälleen kerran tarpeen valita huolellinen verenpainetta alentava hoito liikalihavilla potilailla, erityisesti kun suoritetaan painonpudotukseen tarkoitettuja ohjelmia. Yhteenvetona on todettava, että meidän näkökulmastamme yksi merkittävistä liikalihavuuden torjunnan tehokkuutta heikentävistä ongelmista on se, että lääkärit tai yleisö eivät pidä lihavuutta merkittävänä riskitekijänä. Lisäksi potilaat eivät usein pidä itseään lihaviksi. Esimerkiksi POLONEZ-tutkimuksessa Lääkäreiden painoindeksiin perustuvan arvion mukaan sekä miehillä että naisilla lihavuus todettiin kolme kertaa useammin kuin potilaiden itse ilmoittamat. Siksi väestön keskuudessa tulisi vahvistaa ja tehdä selitystyötä painonnousun ehkäisyn tarpeesta, olemassa olevan liikalihavuuden korjaamisesta ja verenpainetaudin jatkuvan hoidon tärkeydestä. KIRJALLISUUS
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Lihavuuden esiintyvyys ja suuntaukset yhdysvaltalaisten aikuisten keskuudessa, 1999-2000. JAMA 2002; 288:1723-7.
2. Pi-Sunyer F.X. Rasvan keskusjakauman epidemiologia suhteessa sairauksiin. Nutr Rev 2004; 62(7): 120-6.
3. Arbeeny C.M. Vastaamaan turvallisten ja tehokkaiden painonpudotushoitojen tarpeisiin. Obes Res 2004; 12(8): 1191-6.
4. Stamler J., Rose G., Stamler R., et ai. INTERSALT-tutkimuksen tulokset. Vaikutukset kansanterveyteen ja sairaanhoitoon. Hypertension 1989; 14(5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Ylipaino ja verenpainetauti vanhuksilla - yhteisön tutkimuksen tulokset. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et ai. Vatsan sisäisen viskeraalisen rasvan väheneminen voi alentaa verenpainetta lihavilla hypertensiivisillä naisilla. Hypertension 1996; 27(1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et ai. Amerikan Sydänyhdistys; Ravitsemus-, fyysinen aktiivisuus ja aineenvaihduntaneuvoston liikalihavuuskomitea. Liikalihavuus ja sydän- ja verisuonisairaudet: painonpudotuksen patofysiologia, arviointi ja vaikutus: päivitys vuoden 1997 American Heart Associationin liikalihavuutta ja sydänsairauksia koskevasta tieteellisestä lausunnosta ravitsemusta, fyysistä aktiivisuutta ja aineenvaihduntaa käsittelevän neuvoston liikalihavuuskomitealta. levikki 2006; 113: 898-918.
8 Alpert M.A. Liikalihavuuden kardiomyopatia; patofysiologia ja kliinisen oireyhtymän evoluutio. Am J Med Sci 2001; 321:225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hypertensio ja liikalihavuus. Recent Progr Horm Res 2004; 59:169-205.
10. Engeli S., Sharma A.M. Reniini-angiotensiinijärjestelmä ja natriureettiset peptidit liikalihavuuteen liittyvässä verenpaineessa. J Mol Med 2001; 79:21-9.
11. Lafontan M., Moro C., Sengenes C., et ai. Eteisten natriureettisten peptidien odottamaton metabolinen rooli: lipolyysin, lipidien mobilisaation ja systeemisten esteröimättömien rasvahappojen tasojen hallinta ihmisillä. Arterioscler Thromb Vasc Biol 2005; 25:2032-42.
12. Halli J.E. Munuaiset, verenpainetauti ja liikalihavuus. Hypertensio 2003; 41(3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et ai. ACE, angiotensinogeeni ja liikalihavuus: mahdollinen reitti, joka johtaa verenpaineeseen. J Hum Hypertens 1997; 11:107-11.
14. Lu H., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotensiini II lisää rasvan angiotensinogeenin ilmentymistä. Am J Physiol Endocrinol Metab 2007; 292:1280-7.
15. Engeli S., Negrel R., Sharma A.M. Rasvakudoksen reniini-angiotensiinijärjestelmän fysiologia ja patofysiologia. Hypertensio 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. Rasvakehitys: kantasoluista rasvasoluihin. Crit Rev Biochem Mol Biol 2005; 40:229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. Rasvakudoksen toimintahäiriöt liikalihavuudessa, diabeteksessa ja verisuonisairauksissa. Eur Heart J 2008; 29:2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A., et ai. Adipokiinit ja tyypin 2 diabeteksen riski vanhemmilla miehillä. Diabetes Core 2007; 30:1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et ai. Plasman insuliini-, leptiini- ja liukoisen TNF-reseptorin tasot suhteessa liikalihavuuteen liittyviin aterogeenisiin ja trombogeenisiin sydän- ja verisuonitautien riskitekijöihin miehillä. Aterosleroosi 2001; 157:495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Adiposyyttien koon ja adipokiinien ilmentymisen ja erittymisen välinen suhde. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T, Fukui T. et ai. Angiotensiini II -infuusio alentaa plasman adiponektiinitasoa sen tyypin 1 reseptorin kautta rotilla: tämä vaikuttaa verenpaineeseen liittyvään insuliiniresistenssiin. Metabolism 2006; 55:478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et ai. Seerumin immunoreaktiivinen leptiinipitoisuus normaalipainoisessa ja lihavassa ihmisessä. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et ai. Keskushermoston ruoansaannin hallinta. Nature 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanokortiinihermosolut ovat leptriinin suoria kohteita hypotalamuksessa. Endocrinology 1997; 138; 4489-92.
25 Long Y.C., Zierath J.R. AMP-aktivoitu proteiinikinaasisignalointi metabolisessa säätelyssä. J Clin Invest 2006; 116:1776-83.
26. Saladin R., De Vos P., Guerre-Millo M., et ai. Liikalihavien geenien ilmentymisen ohimenevä lisääntyminen ruoan tai insuliinin antamisen jälkeen. Nature 1995; 377:527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Tuumorinekroositekijä-alfa vaikuttaa huumanin rasvaleptiinin synteesiin ja vapautumiseen. Mol Cell Endocrinol 2000; 159:79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., et ai. Adiponektiini ja tyypin 2 diabeteksen kehittyminen Pima Intian väestössä. Lancet 2002; 360:57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et ai. Alhaiset plasman adiponektiinipitoisuudet liittyvät alhaiseen tulevien kardiovaskulaaristen tapahtumien riskiin potilailla, joilla on kliinisesti ilmeinen verisuonisairaus. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D., et ai. Rasvainen angiotensinogeeni osallistuu rasvakudoksen kasvuun ja verenpaineen säätelyyn. FASEB J 2001; 15:2727-9.
31. Paul M., Mehr A.P., Kreutz R. Paikallisten reniini-angiotensiinijärjestelmien fysiologia. Physiol Rev 2006; 86:747-803.
32. Karlsson C., Lindell K., Ottosson M., et ai. Ihmisen rasvakudos ilmentää angiotensinogeeniä ja entsyymejä, joita tarvitaan sen muuntumiseen angiotensiini II:ksi. J. Clin. Endocrinol Metab 1998; 83:3925-9.
33. Gorzelniak K., Engeli S., Janke J. et ai. Ihmisen rasvakudosten reniini-angiotensiinijärjestelmän hormonaalinen säätely: suhde liikalihavuuteen ja verenpaineeseen. J Hypertens 2002; 20:965-73.
34. Engeli S., Gorzelniak K., Kreutz R., et ai. Reniini-angiotensiinijärjestelmän geenien yhteisilmentyminen ihmisen rasvakudoksessa. J Hypertens 1999; 17:555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., et ai. Reniinireseptorin ilmentyminen ihmisen rasvakudoksessa. Am J Physiol Regul Integr Comp Physiol 2007; 292:274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Reniini-angiotensiinijärjestelmä, natrriureettiset peptidit, liikalihavuus, metabolinen oireyhtymä ja verenpainetauti: integroitu näkemys ihmisestä. J Hypertens 2008; 26:831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et ai. Angiotensiini II -reseptorit ihmisen preadiposyyteissä: rooli solusyklin säätelyssä. Endocrinology 1999; 140:154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G. et ai. Angiotensiini II valkoisen rasvakudoksen trofisena tekijänä: rasvasolujen muodostumisen stimulointi. Endokrinologia 2001; 142:487-92.
39. Watanabe G., Lee R.J., Albanese C., et ai. Angiotensiini II aktivoi sykliini D1 -riippuvaisen kinaasiaktiivisuuden. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Preadipoosisolujen erilaistuminen: prostasykliinin parakriininen rooli, kun angiotensiini-II stimuloi rasvasoluja. Endocrinology 1994; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotensiini II lisää lipogeneesiä 3T3-L1- ja ihmisen rasvasoluissa. Endocrinology 1997; 138:1512-9.
42. Wake D.J., Walker B.R. 11-beeta-hydroksisteroididehydrogenaasin tyypin 1 esto liikalihavuudessa. Endokriininen 2006; 29:101-8.
43. Engeli S., Bohnke J., Feldpausch M., et ai. 11-beeta-HSD-geenien säätely ihmisen rasvakudoksessa: keskuslihavuuden ja painonpudotuksen vaikutus. Obes Res 2004; 12:9-17.
44. Kim S., Whelan J., Claycombe K., et ai. Angiotensiini II lisää leptiinin eritystä 3T3-L1:n ja ihmisen adiposyyttien toimesta prostaglandiinista riippumattoman mekanismin kautta. J Nutr 2002; 132:1135-40.
45. Cassis L.A., englantilainen V.L., Bharadwaj K., Boustany C.M. Paikallisen ja systeemisen angiotensiini II:n erilaiset vaikutukset leptiinin vapautumisen säätelyssä rasvasoluista. Endokrinologia 2004; 145:169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et ai. Sympaattinen hermosto ja metabolinen oireyhtymä. J Hypertens 2007; 25:909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Sympaattisen järjestelmän aktiivisuus liikalihavuudessa ja metabolisessa oireyhtymässä. Ann N Y Acad Sci 2006; 1083:129-52.
48. Landsberg L., Troisi R., Parker D., et ai. Liikalihavuus, verenpaine ja sympaattinen hermosto. Ann Epidemiol 1991; 1:295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Ihmisen rasvan angiotensinogeenigeenin ilmentymistä ja eritystä stimuloi syklinen AMP lisääntyneen DNA:n syklisen AMP:n herkän elementin sitoutumisaktiivisuuden kautta. Endokrine 2004; 25:97-104.
50. Cassis L.A. Angiotensiini II:n rooli ruskean rasvan termogeneesissä kylmän totuttelun aikana. Am J. Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. Endogeenisen angiotensiini II:n välittäjäaineiden vapautumisen presynaptinen modulaatio ruskeassa rasvakudoksessa. J Neural Transm 1991; 34:129-37.
52. Reisin E., Weir M., Falkner B., et ai. Lisinopriili vs. hydroklooritiatsidi liikalihavilla hypertensiivisillä potilailla: monikeskus, lumekontrolloitu tutkimus. Hoito liikalihavilla hypertensiopotilailla (TROPHY) -tutkimusryhmä. Hypertension 1997; 30(1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., et ai. Irbesartaanin/hydroklooritiatsidin pienten ja suurten annosten kiinteiden yhdistelmien teho ja turvallisuus potilailla, joilla on hallitsematon systolinen verenpaine monoterapiassa: INCLUSIVE-tutkimus. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. tutkimusryhmän "ECO" puolesta. Monikeskus, satunnaistettu, avoin tutkimus elämäntapamuutosten ja ACE:n estäjähoidon (kinapriili) tehokkuudesta lihavilla potilailla, joilla on verenpainetauti (IVF). Verenpainetauti 2003; 9(6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Verenpainetta alentava hoito ja insuliiniherkkyys: pitääkö meidän määritellä uudelleen beetasalpaajien rooli? Am J Hypertens 1998; 11(10): 1258-65.
56. Kaaja R., Kujala S., Manhem K. et ai. Sympatolyyttisen hoidon vaikutukset insuliiniherkkyysindekseihin hypertensiivisillä postmenopausaalisilla naisilla. Int J. Clin. Pharmacol Ther 2007; 45(7): 394-401.
57. Kuperstein R., Sasson Z. Verenpainetta alentavan hoidon vaikutukset glukoosi- ja insuliiniaineenvaihduntaan ja vasemman kammion massaan: satunnaistettu, kaksoissokkoutettu, kontrolloitu tutkimus 21 liikalihavasta verenpainepotilasta. levikki 2000; 102(15): 1802-6.
58. Halperin A.K., Cubeddu L.X. Kalsiumkanavasalpaajien rooli verenpainetaudin hoidossa. Am Heart J 1986; 111(2): 363-82.
59. McAllister R.G. Jr. Hitaiden kanavien salpaajien kliininen farmakologia. Prog Cardiovasc Dis 1982; 25(2): 83-102.
60. Binggeli C., Corti R., Sudano I. et ai. Kroonisen kalsiumkanavasalpauksen vaikutukset sympaattiseen hermotoimintaan verenpainetaudissa. Hypertensio 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K. et ai. Dihydropyridiinin ja fenyylialkyyliamiinin kalsiumantagonistiluokkien vaikutukset autonomiseen toimintaan verenpainetaudissa: VAMPHYRE-tutkimus. Am J Hypertens 2001; 14(11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Kahdella erillisellä verenpainetta alentavalla lääkkeellä hoidettujen potilaiden noudattamismallit verrattuna kiinteän annoksen yhdistelmähoitoon Am J Hypertens 2004; 175:223.
63. Dezii C.M. Retrospektiivinen tutkimus pysyvyydestä yhden pillerin yhdistelmähoidolla vs. samanaikainen kahden pillerin hoito hypertensiopotilailla. Johdon hoito. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. Kiinnittymismallit potilailla, joita hoidettiin kiinteän annoksen yhdistelmällä verrattuna erillisiin verenpainetta alentaviin aineisiin. Am J Health Syst Pharm 2007; 64(12): 1279-83.
65. Jackson K. Kiinteän ja vapaan yhdistelmän pysyvyys valsartaanin ja HCTZ:n kanssa hypertensiopotilailla. Value Health Suppl 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Trandolapriili/verapamiili-yhdistelmän kardiovaskulaariset vaikutukset potilailla, joilla on lievä tai kohtalainen essentiaalinen hypertensio. Am J Cardiol 1997; 79(6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. Trandolapriili/verapamiili hidastettu vapautuminen: katsaus sen käyttöön essentiaalisen hypertension hoidossa. Drugs 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Hypertension hallinta diabeettisilla potilailla - keskity trandolapriilin/verapamiilin yhdistelmään. Vasc Terveysriskien hallinta 2007; 3(4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et ai. Erot glukoosin sietokyvyssä kiinteäannoksisten verenpainetta alentavien lääkeyhdistelmien välillä ihmisillä, joilla on metabolinen oireyhtymä. Diabetes Care 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., et ai. Diureetteihin liittyvän heikentyneen glukoositoleranssin ja uuden diabeteksen kumoaminen: STAR-LET-tutkimuksen tulokset. J Cardiometab Syndr 2008; 3(1): 18-25.
71. Bailey C.J., Day C. Uusia farmakologisia lähestymistapoja liikalihavuuteen. Liikalihavuuskäytäntö 2005; 1:2-5.
72. Yanovski S.Z., Yanovski J.A.Y. lihavuus. N Engl J Med 2002; 346(8): 591-602.
73. Day C., Bailey C.J. Sibutramiini päivitys. Br J Diabetes Vasc Dis 2002; 2:392-7.
74. James W.P., Astrup A., Finer N., et ai. Sibutramiinin vaikutus painon ylläpitämiseen painonpudotuksen jälkeen: satunnaistettu tutkimus. STORM-tutkimusryhmä. Sibutramiinikoe liikalihavuuden vähentämisestä ja ylläpidosta. Lancet 2000; 356:2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W. et ai. Kardiovaskulaariset vasteet painonhallintaan ja sibutramiiniin suuren riskin koehenkilöillä: analyysi SCOUT-tutkimuksesta. Eur Heart J 2007; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W. et ai. Sibutramiiniin ja painonhallintaan liittyvät verenpaineen muutokset – analyysi sibutramiinin sydän- ja verisuonitautien tutkimusten (SCOUT) kuuden viikon aloitusjaksosta. Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et ai. Sibutramiinin ja verapamiilin hitaasti vapautuvan / trandolapriilin yhdistelmän vaikutukset verenpaineeseen ja metabolisiin muuttujiin liikalihavilla hypertensiivisillä potilailla. Expert Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., et ai. Lihavuuteen liittyvän verenpainetaudin optimaalinen hoito: Hypertension-Obesity-Sibutramine (HOS) -tutkimus. levikki 2007; 115(15): 1991-8.
79. Glezer M.G. Tulokset venäläisestä POLONEZ-tutkimuksesta (ENARENALIN TEHOKKUUS JA TURVALLISUUS VALTIOIDEN KOKOONPISTEISIÄ POTILAATILLE). Terapeuttinen arkisto 2006; 4:44-50.
Lainausta varten: Leonova M.V. Uudet ja lupaavat lääkkeet, jotka estävät reniini-angiotensiini-aldosteronijärjestelmän // RMJ. Lääketieteellinen arvostelu. 2013. Nro 17. S. 886
Reniini-angiotensiini-aldosteronijärjestelmän (RAAS) roolia hypertension (AH) ja muiden sydän- ja verisuonitautien kehittymisessä pidetään tällä hetkellä hallitsevana. Sydän- ja verisuonijärjestelmän jatkumossa verenpainetauti on yksi riskitekijöistä, ja pääasiallinen sydän- ja verisuonijärjestelmän vaurioiden patofysiologinen mekanismi on angiotensiini II (ATII). ATII on RAAS:n avainkomponentti - efektori, joka toteuttaa vasokonstriktiota, natriumin retentiota, sympaattisen hermoston aktivointia, solujen lisääntymistä ja hypertrofiaa, oksidatiivisen stressin kehittymistä ja verisuonten seinämän tulehdusta.
Tällä hetkellä on jo kehitetty ja kliinisesti laajalti käytetty kaksi RAAS-salpaavaa lääkeryhmää - ACE:n estäjät ja ATII-reseptorin salpaajat. Näiden luokkien farmakologiset ja kliiniset vaikutukset vaihtelevat. ACE onsi, joka metaboloi ATI:tä, AT1-7:ää, bradykiniiniä, substanssia P ja monia muita peptidejä. ACE-estäjien vaikutusmekanismi liittyy pääasiassa ATII:n muodostumisen estämiseen, mikä edistää vasodilataatiota, natriureesia ja eliminoi ATII:n tulehdusta edistävät, proliferatiiviset ja muut vaikutukset. Lisäksi ACE:n estäjät estävät bradykiniinin hajoamista ja lisäävät sen tasoa. Bradykiniini on voimakas verisuonia laajentava aine, se tehostaa natriureesia ja mikä tärkeintä, sillä on sydäntä suojaava (estää hypertrofiaa, vähentää sydänlihaksen iskeemisiä vaurioita, parantaa sepelvaltimoverenkiertoa) ja verisuonia suojaava vaikutus, joka parantaa endoteelin toimintaa. Samanaikaisesti korkea bradykiniinitaso on syynä angioedeeman kehittymiseen, mikä on yksi ACE:n estäjien vakavista haitoista, jotka nostavat merkittävästi kiniinien tasoa.
ACE:n estäjät eivät aina pysty täysin estämään ATII:n muodostumista kudoksissa. Nyt on todettu, että muut entsyymit, jotka eivät liity ACE:hen, ensisijaisesti endopeptidaasit, joihin ACE:n estäjät eivät vaikuta, voivat myös osallistua sen muuntamiseen kudoksissa. Tämän seurauksena ACE:n estäjät eivät pysty täysin poistamaan ATII:n vaikutuksia, mikä saattaa olla syynä niiden tehottomuuteen.
Tämän ongelman ratkaisua helpotti ATII-reseptorien ja ensimmäisen luokan lääkkeiden löytäminen, jotka salpaavat selektiivisesti AT1-reseptoreita. AT1-reseptorien kautta toteutuvat ATII:n epäsuotuisat vaikutukset: vasokonstriktio, aldosteronin, vasopressiinin, norepinefriinin eritys, nesteretentio, sileiden lihassolujen ja kardiomyosyyttien lisääntyminen, SAS:n aktivaatio sekä negatiivinen palautemekanismi - reniinin muodostuminen . AT2-reseptorit suorittavat "hyödyllisiä" toimintoja, kuten verisuonten laajentamista, korjaus- ja regeneraatioprosesseja, antiproliferatiivista toimintaa, alkiokudosten erilaistumista ja kehitystä. ATII-reseptorisalpaajien kliiniset vaikutukset välittyvät ATII:n "haitallisten" vaikutusten eliminoimisen kautta AT1-reseptorien tasolla, mikä saa aikaan täydellisemmän ATII:n haittavaikutusten eston ja ATII:n vaikutuksen lisääntymisen AT2-reseptoreihin. , joka täydentää verisuonia laajentavia ja antiproliferatiivisia vaikutuksia. ATII-reseptorin salpaajilla on spesifinen vaikutus RAAS:iin häiritsemättä kiniinijärjestelmää. Vaikutuksen puute kiniinijärjestelmän toimintaan toisaalta vähentää ei-toivottujen vaikutusten (yskä, angioödeema) vakavuutta, mutta toisaalta riistää ATII-reseptorin salpaajilta tärkeän iskeemisen ja verisuonia suojaavan vaikutuksen. mikä erottaa ne ACE:n estäjistä. Tästä syystä ATII-reseptorin salpaajien käyttöaiheet toistavat useimmiten ACE:n estäjien nimittämistä koskevat ohjeet, mikä tekee niistä vaihtoehtoisia lääkkeitä.
Huolimatta RAAS-salpaajien käyttöönotosta laajalle levinneeseen verenpainetaudin hoitoon, tulosten ja ennusteen parantamisessa on edelleen ongelmia. Näitä ovat: mahdollisuus parantaa väestön verenpaineen hallintaa, resistentin verenpainetaudin hoidon tehokkuus, mahdollisuus vähentää edelleen sydän- ja verisuonitautien riskiä.
Uusia tapoja vaikuttaa RAASiin etsitään aktiivisesti; muita läheisesti vuorovaikutuksessa olevia järjestelmiä tutkitaan ja lääkkeitä, joilla on useita vaikutusmekanismeja, kehitetään, kuten ACE:n estäjät ja neutraalin endopeptidaasin (NEP) estäjät, endoteliinia konvertoivan entsyymin (EPF) ja NEP:n estäjät, ACE/NEP/EPF-estäjät.
Vasopeptidaasin estäjät
Tunnetun ACE:n lisäksi vasopeptidaasit sisältävät 2 muuta sinkkimetalloproteinaasia - neprilysiini (neutraali endopeptidaasi, NEP) ja endoteliinia konvertoiva entsyymi, jotka voivat olla myös farmakologisten vaikutusten kohteita.
Neprilysiini on verisuonten endoteelin tuottama entsyymi, joka osallistuu natriureettisen peptidin sekä bradykiniinin hajoamiseen.
Natriureettista peptidijärjestelmää edustaa kolme erilaista isoformia: eteisen natriureettinen peptidi (A-tyyppi), aivojen natriureettinen peptidi (B-tyyppi), jotka syntetisoituvat eteisessä ja sydänlihaksessa, ja endoteelin C-peptidi, jotka ovat endogeenisiä RAAS-estäjiä. niiden biologiset toiminnot ja endoteliini-1 (taulukko 1). Natriureettisen peptidin sydän- ja verisuoni- ja munuaisvaikutukset ovat verenpainetta alentava vaikutus verisuonten sävyyn ja vesi- ja elektrolyyttitasapainoon sekä antiproliferatiiviset ja antifibroottiset vaikutukset kohde-elimiin. Viime aikoina natriureettinen peptidijärjestelmä osallistuu lipidien hapettumisen, rasvasolujen muodostumisen ja erilaistumisen, adiponektiinin aktivaation, insuliinin erittymisen ja hiilihydraattitoleranssin metaboliseen säätelyyn, mikä voi antaa suojan metabolisen oireyhtymän kehittymistä vastaan.
Tähän mennessä on tullut tunnetuksi, että sydän- ja verisuonisairauksien kehittyminen liittyy natriureettisen peptidijärjestelmän säätelyhäiriöihin. Joten verenpainetautissa on natriureettisen peptidin puute, mikä johtaa suolaherkkyyteen ja heikentyneeseen natriureesiin; kroonisessa sydämen vajaatoiminnassa (CHF) puutoksen taustalla havaitaan natriureettisen peptidijärjestelmän hormonien epänormaalia toimintaa.
Siksi NEP-estäjiä voidaan käyttää natriureettisen peptidijärjestelmän tehostamiseen, jotta saavutetaan lisää verenpainetta alentavia ja suojaavia sydän- ja munuaisvaikutuksia. Neprilysiinin esto johtaa endogeenisen natriureettisen peptidin natriureettisten, diureettisten ja verisuonia laajentavien vaikutusten voimistumiseen ja sen seurauksena verenpaineen laskuun. NEP osallistuu kuitenkin myös muiden vasoaktiivisten peptidien, erityisesti ATI:n, ATII:n ja endoteliini-1:n, hajoamiseen. Siksi NEP-estäjien vaikutusten tasapaino verisuonten sävyyn on vaihteleva ja riippuu supistavien ja laajentavien vaikutusten vallitsevasta määrästä. Pitkäaikaisessa käytössä neprilysiini-inhibiittoreiden verenpainetta alentava vaikutus ilmentyy heikosti johtuen ATII:n ja endoteliini-1:n muodostumisen kompensoivasta aktivoinnista.
Tässä suhteessa ACE-estäjien ja NEP-estäjien vaikutusten yhdistelmä voi merkittävästi voimistaa hemodynaamisia ja antiproliferatiivisia vaikutuksia täydentävän vaikutusmekanismin seurauksena, mikä johti lääkkeiden luomiseen, joilla on kaksoisvaikutusmekanismi ja jotka yhdistetään nimellä - vasopeptidaasi-inhibiittorit (taulukko 2, kuvio 1).
Tunnetuille vasopeptidaasin estäjille on tunnusomaista vaihteleva selektiivisyysaste NEP/ACE:lle: omapatrilaatti - 8,9:0,5; fazidoprilaatti - 5,1:9,8; sampatrilaatti - 8,0:1,2. Tämän seurauksena vasopeptidaasi-inhibiittorit saivat paljon paremmat mahdollisuudet saavuttaa verenpainetta alentava vaikutus riippumatta RAAS:n aktiivisuudesta ja natriumretention tasosta sekä elinten suojauksessa (hypertrofian regressio, albuminuria, verisuonten jäykkyys). Kliinisissä tutkimuksissa eniten tutkittu omapatrilaatti, joka osoitti korkeampaa verenpainetta alentavaa tehoa verrattuna ACE:n estäjiin, ja CHF-potilailla johti ejektiofraktion kasvuun ja kliinisten tulosten paranemiseen (IMPRESS-, OVERTURE-tutkimukset), mutta ilman etuja ACE:n estäjiin verrattuna.
Kuitenkin suurissa kliinisissä tutkimuksissa, joissa käytettiin omapatrilaatia, angioedeeman ilmaantuvuus havaittiin enemmän kuin ACE:n estäjillä. Tiedetään, että angioedeeman ilmaantuvuus ACE-estäjiä käytettäessä on 0,1-0,5 % väestöstä, joista 20 % tapauksista on hengenvaarallisia, mikä liittyy bradykiniinin ja sen metaboliittien pitoisuuksien moninkertaiseen nousuun. Tulokset suuresta monikeskustutkimuksesta OCTAVE (n=25 302), joka oli erityisesti suunniteltu tutkimaan angioedeeman ilmaantuvuutta, osoittivat, että tämän sivuvaikutuksen ilmaantuvuus omapatrilaattihoidon aikana on suurempi kuin enalapriiliryhmässä - 2,17 % vs. 0,68 %. (suhteellinen riski 3,4). Tämä selittyy lisääntyneellä vaikutuksella kiniinien tasoon ACE:n ja NEP:n synergistisen inhibition aikana, mikä liittyy bradykiniinin hajoamiseen osallistuvan aminopeptidaasi P:n estämiseen.
Uudella kaksois-ACE/NEP-salpavalla vasopeptidaasi-inhibiittorilla, ilepatriililla, on suurempi affiniteetti ACE:hen kuin NEP:llä. Kun tutkittiin ilepatriilin farmakodynaamisia vaikutuksia RAAS:n ja natriureettisen peptidin aktiivisuuteen terveillä vapaaehtoisilla, havaittiin, että lääke annoksesta riippuvaisesti (annoksilla 5 ja 25 mg) ja merkittävästi (yli 88 %) suppressoi. ACE plasmassa yli 48 tuntia suolaherkkyydestä riippumatta. Samaan aikaan lääke lisäsi merkittävästi plasman reniiniaktiivisuutta 48 tunnin ajan ja alensi aldosteronitasoa. Nämä tulokset osoittivat voimakasta ja pidempään RAAS:n suppressiota, toisin kuin ACE:n estäjä ramipriili annoksella 10 mg, mikä selittyy ilepatriilin merkittävämmällä kudosvaikutuksella ACE:hen ja suuremmalla affiniteetilla ACE:hen ja vastaavalla määrällä. RAAS:n esto verrattuna irbesartaanin 150 mg + 10 mg ramipriilin yhdistelmään. Toisin kuin RAAS:iin kohdistuva vaikutus, ilepatriilin vaikutus natriureettiseen peptidiin ilmeni ohimenevänä lisääntymisenä sen erittymismäärässä 4-8 tunnin aikana 25 mg:n annoksen jälkeen, mikä viittaa pienempään ja heikompaan affiniteettiin. NEP:lle ja erottaa sen omapatrilatista. Lisäksi, mitä tulee elektrolyyttierityksen määrään, lääkkeellä ei ole ylimääräistä natriureettista vaikutusta verrattuna ramipriiliin tai irbesartaaniin eikä muihin vasopeptidaasin estäjiin. Maksimaalinen verenpainetta alentava vaikutus kehittyy 6-12 tunnin kuluttua lääkkeen ottamisesta, ja keskimääräinen verenpaine laskee 5±5 ja 10±4 mmHg. alhaisella ja korkealla suolaherkkyydellä. Farmakokineettisten ominaisuuksien mukaan ilepatriili on aihiolääke, jossa on aktiivinen metaboliitti, joka muodostuu nopeasti huippupitoisuudella 1-1,5 tunnissa ja poistuu hitaasti. Vaiheen III kliiniset tutkimukset ovat parhaillaan käynnissä.
Vaihtoehtoinen reitti RAAS:n ja NEP:n kaksoissuppressioon on ATII-reseptorien ja NEP:n salpauksen yhdistelmä (kuvio 2). ATII-reseptorin salpaajat eivät vaikuta kiniinien aineenvaihduntaan, toisin kuin ACE:n estäjät, joten niillä on mahdollisesti pienempi angioedeeman kehittymisen riski. Tällä hetkellä ensimmäinen lääke, ATII-reseptorin salpaaja, jonka vaikutus estää NEP:tä suhteessa 1:1, LCZ696, on vaiheen III kliinisissä kokeissa. Yhdistetty lääkemolekyyli sisältää valsartaania ja NEP-estäjää (AHU377) aihiolääkkeen muodossa. Suuressa tutkimuksessa verenpainepotilailla (n = 1328) LCZ696 osoitti 200–400 mg:n annoksilla verenpainetta alentavaa vaikutusta valsartaaniin verrattuna 160–320 mg:n annoksilla verenpaineen lisälaskemisena 5 prosentilla. /3 ja 6/3 mmHg. . LCZ696:n verenpainetta alentavaan vaikutukseen liittyi selvempi pulssipaineen lasku: 2,25 ja 3,32 mm Hg. 200 ja 400 mg:n annoksilla, mitä pidetään tällä hetkellä positiivisena ennustetekijänä vaikutukselle verisuonten seinämän jäykkyyteen ja kardiovaskulaarisiin tuloksiin. Samaan aikaan neurohumoraalisten biomarkkerien tutkimus LCZ696-hoidon aikana osoitti natriureettisen peptidin tason nousua ja reniinin ja aldosteronin tason nousua verrattavissa olevaan valsartaaniin verrattuna. Hypertensiopotilaiden siedettävyys oli hyvä, eikä angioödeematapauksia havaittu. PARAMOUMT-tutkimus on nyt saatu päätökseen 685 potilaalla, joilla on sepelvaltimotauti ja heikentynyt EF. Tutkimuksen tulokset osoittivat, että LCZ696 alentaa NT-proBNP-tasoa nopeammin ja selvemmin (ensisijainen päätepiste on lisääntynyt natriureettinen peptidiaktiivisuus ja huono ennuste CHF:ssä) verrattuna valsartaaniin ja pienentää myös vasemman eteisen kokoa. , mikä osoittaa sen uudelleenmuodostumisen taantumista. Tutkimus potilailla, joilla on CHF ja heikentynyt EF, on meneillään (PARADIGM-HF-tutkimus).
Endoteliinijärjestelmän estäjät
Endoteliinijärjestelmällä on tärkeä rooli verisuonten sävyn ja alueellisen verenvirtauksen säätelyssä. Kolmesta tunnetusta isoformista endoteliini-1 on aktiivisin. Tunnettujen verisuonia supistavien vaikutusten lisäksi endoteliini stimuloi solujen välisen matriisin proliferaatiota ja synteesiä, ja myös suoran vaikutuksensa vuoksi munuaisten verisuonten sävyyn osallistuu veden ja elektrolyyttien homeostaasin säätelyyn. Endoteliinin vaikutukset toteutuvat vuorovaikutuksessa spesifisten A- ja B-tyypin reseptoreiden kanssa, joiden toiminnot ovat keskenään päinvastaisia: A-tyypin reseptorien kautta tapahtuu vasokonstriktio ja B-tyypin kautta verisuonten laajeneminen. Viime vuosina on todettu, että B-tyypin reseptoreilla on tärkeä rooli endoteliini-1:n puhdistumisessa, ts. näiden reseptorien salpaus häiritsee endoteliini-1:n reseptorista riippuvaa puhdistumaa ja lisää sen pitoisuutta. Lisäksi B-tyypin reseptorit osallistuvat endoteliini-1:n munuaisvaikutusten säätelyyn ja veden ja elektrolyyttien homeostaasin ylläpitämiseen, mikä on tärkeää.
Tällä hetkellä endoteliinin rooli on todistettu useiden sairauksien, mm. AH, CHF, keuhkoverenpainetauti, krooninen munuaissairaus; osoittaa läheistä yhteyttä endoteliinitason ja metabolisen oireyhtymän, endoteelin toimintahäiriön ja aterogeneesin välillä. 1990-luvulta lähtien kliiniseen käyttöön sopivien endoteliinireseptorin antagonistien etsintä on meneillään; Tunnetaan jo 10 lääkettä ("sentaanit"), joiden selektiivisyys A/B-tyypin reseptoreille vaihtelee. Ensimmäinen ei-selektiivinen endoteliinireseptorin antagonisti - bosentaani - osoitti verenpainepotilailla tehdyssä kliinisessä tutkimuksessa verenpainetta alentavaa tehoa, joka on verrattavissa ACE-estäjän enalapriilin tehoon. Lisätutkimukset endoteliiniantagonistien tehosta kohonneeseen verenpaineeseen ovat osoittaneet niiden kliinisen merkityksen resistentin hypertension hoidossa ja korkean kardiovaskulaarisen riskin hoidossa. Nämä tiedot saatiin kahdessa suuressa kliinisessä tutkimuksessa DORADO (n=379) ja DORADO-AC (n=849), joissa darusentaania lisättiin kolmoisyhdistelmähoitoon potilailla, joilla oli resistentti hypertensio. DORADO-tutkimuksessa potilaille, joilla oli resistentti hypertensio, liittyi krooninen munuaissairaus ja proteinuria, ja darusentaanin lisäämisen seurauksena ei havaittu pelkästään verenpaineen merkittävää laskua, vaan myös proteiinien erittymisen vähenemistä. Eproteiinien vastainen vaikutus vahvistettiin myöhemmin avocentaania käyttävillä potilailla, joilla oli diabeettinen nefropatia. Kuitenkaan DORADO-AC-tutkimuksessa verenpaineen lisälaskemisesta ei ollut etua vertailuvalmisteisiin ja lumelääkkeeseen verrattuna, mikä oli syy lisätutkimusten keskeyttämiseen. Lisäksi neljässä suuressa tutkimuksessa endoteliiniantagonisteista (bosentaani, darusentaani, enrasentaani) CHF-potilailla saatiin ristiriitaisia tuloksia, mikä selittyy endoteliini-1:n pitoisuuden nousulla. Endoteliinireseptorin antagonistien lisätutkimukset keskeytettiin nesteretentioon liittyvien haittavaikutusten vuoksi (perifeerinen turvotus, tilavuuden ylikuormitus). Näiden vaikutusten kehittyminen liittyy endoteliiniantagonistien vaikutukseen B-tyypin reseptoreihin, mikä on muuttanut sellaisten lääkkeiden etsintää, jotka vaikuttavat endoteliinijärjestelmään muiden reittien kautta; ja endoteliinireseptorin antagonisteilla on tällä hetkellä vain yksi indikaatio, keuhkoverenpainetaudin hoito.
Ottaen huomioon endoteliinijärjestelmän suuren merkityksen verisuonten sävyn säätelyssä, etsitään toista vaikutusmekanismia vasopeptidaasi-EPF:n kautta, joka on osallisena aktiivisen endoteliini-1:n muodostumisessa (kuvio 3). ACE:n salpaus ja yhdistelmä NEP:n eston kanssa voivat tehokkaasti tukahduttaa endoteliini-1:n muodostumisen ja voimistaa natriureettisen peptidin vaikutuksia. Kaksoisvaikutusmekanismin edut ovat toisaalta NEP-estäjien haittojen ehkäisy, jotka liittyvät mahdolliseen endoteliinin aktivoitumisen välittämään vasokonstriktioon, toisaalta NEP-estäjien natriureettinen aktiivisuus mahdollistaa nesteretention kompensoinnin. liittyy endoteliinireseptorien ei-selektiiviseen salpaukseen. Daglutriili on NEP:n ja EPF:n kaksoisestäjä, joka on vaiheen II kliinisissä tutkimuksissa. Tutkimukset ovat osoittaneet lääkkeen voimakkaita sydäntä suojaavia vaikutuksia, jotka johtuvat sydämen ja verisuonten uudelleenmuodostumisen vähenemisestä, hypertrofian ja fibroosin taantumisesta.
Suorat reniinin estäjät
Tiedetään, että ACE:n estäjät ja ATII-reseptorin salpaajat lisäävät reniinin aktiivisuutta takaisinkytkentämekanismilla, mikä on syynä RAAS-salpaajien tehon karkaamiseen. Renin edustaa aivan ensimmäistä askelta RAAS-kaskadissa; sitä tuottavat munuaisten juxtaglomerulaariset solut. Reniini edistää angiotensinogeenin kautta ATII:n muodostumista, vasokonstriktiota ja aldosteronin eritystä sekä säätelee myös palautemekanismeja. Siksi reniinin esto mahdollistaa täydellisemmän RAAS-järjestelmän eston. Reniinin estäjien etsintä on jatkunut 1970-luvulta lähtien; pitkään aikaan ei ollut mahdollista saada oraalista reniini-inhibiittorimuotoa niiden alhaisen biologisen hyötyosuuden vuoksi maha-suolikanavassa (alle 2 %). Ensimmäinen oraaliseen käyttöön soveltuva suora reniinin estäjä, aliskireeni, rekisteröitiin vuonna 2007. Aliskireenilla on alhainen hyötyosuus (2,6 %), pitkä puoliintumisaika (24-40 tuntia), eliminaatioreitti munuaisten ulkopuolella. Aliskireenin farmakodynamiikkaan liittyy 80 %:n lasku ATII-tasossa. Kliinisissä tutkimuksissa verenpainepotilailla aliskireenin annoksilla 150-300 mg/vrk johti verenpaineen laskuun 8,7-13 ja 14,1-15,8 mmHg. vastaavasti ja DBP - 7,8-10,3 ja 10,3-12,3 mm Hg. . Aliskireenin verenpainetta alentava vaikutus havaittiin eri potilaiden alaryhmissä, mukaan lukien potilaat, joilla oli metabolinen oireyhtymä, lihavuus; Vaikeudeltaan se oli verrattavissa ACE:n estäjien, ATII-reseptorin salpaajien vaikutukseen, ja additiivinen vaikutus havaittiin yhdessä valsartaanin, hydroklooritiatsidin ja amlodipiinin kanssa. Useat kliiniset tutkimukset ovat osoittaneet lääkkeen organoprotektiivisia vaikutuksia: antiproteinuurista vaikutusta diabeettista nefropatiaa sairastavilla potilailla (AVOID-tutkimus, n=599), vasemman kammion hypertrofian regressiota verenpainepotilailla (ALLAY-tutkimus, n=465). Näin ollen AVOID-tutkimuksessa 3 kuukauden losartaanihoidon jälkeen annoksella 100 mg/vrk ja verenpaineen tavoitetaso saavutettiin (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Lisäksi tehdään sarja kliinisiä tutkimuksia aliskireenista muiden sydän- ja verisuonisairauksien hoidossa, joissa arvioidaan vaikutusta potilaiden ennusteeseen: ALOFT (n=320), ASTRONAUTI (n=1639), ATMOSPHERE (n) =7000) tutkimukset CHF-potilailla, ALTITUDE-tutkimus potilailla, joilla on diabetes mellitus ja korkea kardiovaskulaarinen riski, ASPIRE-tutkimus potilailla, joilla on infarktin jälkeinen uudelleenmuotoilu.
Johtopäätös
Sydän- ja verisuonisairauksien ehkäisyongelmien ratkaisemiseksi jatkuu uusien lääkkeiden luominen, joilla on monimutkainen monivaikutusmekanismi, mikä mahdollistaa RAAS:n täydellisemmän eston hemodynaamisen ja neurohumoraalisen säätelyn mekanismien kaskadin kautta. Tällaisten lääkkeiden mahdolliset vaikutukset mahdollistavat paitsi ylimääräisen verenpainetta alentavan vaikutuksen, myös verenpainetason hallinnan korkean riskin potilailla, mukaan lukien resistentti hypertensio. Lääkkeillä, joilla on useita toimintamekanismeja, on etuja selvemmässä organoprotektiivisessa vaikutuksessa, mikä estää sydän- ja verisuonijärjestelmän lisävaurioita. Uusien RAAS:ää estävien lääkkeiden hyötyjen tutkiminen vaatii lisätutkimusta ja niiden vaikutusten arvioimista verenpainepotilaiden ja muiden sydän- ja verisuonisairauksien ennusteeseen.


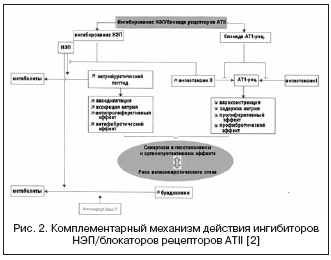
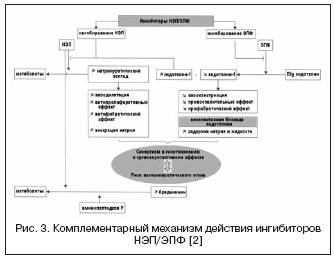
Kirjallisuus
1 Campbell D.J. Vasopeptidaasin esto: kaksiteräinen miekka? // Hypertensio. 2003 Voi. 41. s. 383-389.
2. Laurent S., Schlaich M., Esler M. Uudet lääkkeet, menettelyt ja laitteet verenpainetautiin // Lancet. 2012. Voi. 380. S. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et ai. Vasopeptidaasin estäjät: uusi terapeuttinen konsepti sydän- ja verisuonisairauksissa? // Levikki. 2001 Voi. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et ai. Neutraali endopeptidaasin esto ja natriureettinen peptidijärjestelmä: kehittyvä strategia kardiovaskulaarisessa terapiassa // Eur. Heart J. 2012, doi: 10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et ai. Vasopeptidaasi-inhibiittorin, omapatrilaatin ja lisinopriilin vertailu rasituksen sietokyvyn ja sairastuvuuden suhteen sydämen vajaatoimintaa sairastavilla potilailla: IMPRESS satunnaistettu tutkimus // Lancet. 2000 Vol. 356. s. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et ai. Omapatrilaatin ja enalapriilin vertailu kroonista sydämen vajaatoimintaa sairastavilla potilailla: Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 Voi. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensiini II -reseptorin salpaajat potilailla, joilla on ACE-estäjän aiheuttama angioedeema // Ann. Pharmacother. 2000 Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et ai. Omapatrilaatti ja enalapriili verenpainepotilailla: Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) -tutkimus // Am. J. Hypertens. 2004 Voi. 17. S. 103-111.
9. Azizi M., Bissery A., Peyrard S. et ai. Vasopeptidaasi-inhibiittorin AVE7688 farmakokinetiikka ja farmakodynamiikka ihmisillä // Clin. Pharmacol. Siellä. 2006 Voi. 79. S. 49-61.
10. Gu J., Noe A., Chandra P. et ai. LCZ696:n, uuden kaksoisvaikutteisen angestäjän (ARNi) farmakokinetiikka ja farmakodynamiikka // J. Clin. Pharmacol. 2010 Voi. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et ai. Verenpaineen alentaminen LCZ696:lla, uudella angiotensiini II -reseptorin ja neprilysiinin kaksoisvaikutteisella estäjällä: satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, aktiivinen vertailututkimus // Lancet. 2010 Voi. 375. S. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et ai. Angiotensiinireseptorin neprilysiinin estäjä LCZ696 sydämen vajaatoiminnassa säilyneellä ejektiofraktiolla: vaiheen 2 kaksoissokkoutettu satunnaistettu kontrolloitu tutkimus // Lancet. 2012. Voi. 380(9851). P. 1387-1395.
13. Levin E.R. Endoteliinit // N. Engl. J. Med. 1995 Voi. 333. s. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et ai. Endoteliini-1:n rooli kliinisessä verenpaineessa: 20 vuotta // Hypertensio. 2008 Voi. 52. s. 452-459.
15. Burnier M., Forni V. Endoteliinireseptoriantagonistit: paikka essentiaalisen hypertension hoidossa? // Nephrol. Soita. elinsiirto. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et ai. Endoteliinireseptoriantagonistin, bosentaanin, vaikutus verenpaineeseen potilailla, joilla on essentiaalinen hypertensio. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998 Voi. 338. s. 784-790.
17. Weber M.A., Black H., Bakris G. et ai. Selektiivinen endoteliinireseptorin antagonisti verenpaineen alentamiseksi potilailla, joilla on hoitoresistentti hypertensio: satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus // Lancet. 2009 Voi. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et ai. Poikkeavat tulokset käyttämällä kliinisiä ja ambulatorisia verenpaineita: raportti darusentaaniresistentistä verenpainetutkimuksesta // Hypertensio. 2010 Voi. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et ai. Avosentaani ilmeiseen diabeettiseen nefropatiaan // J. Am. soc. Nephrol. 2010 Voi. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et ai. Endoteliinikonvertoiva entsyymi / neutraali endopeptidaasi-inhibiittori SLV338 estää hypertensiivisen sydämen uudelleenmuodostumisen verenpaineesta riippumattomalla tavalla // Hypertensio. 2011 Voi. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et ai. Angiotensiini II:n suppressio ihmisillä teoreettisesti aktiivisella reniinin estäjällä Aliskireenilla (SPP100): vertailu enalapriiliin // Hypertensio. 2002 Voi. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin ja sydän- ja verisuonitaudit: uupunut polku vai uusi suunta? // World J. Cardiol. 2011 Voi. 3(3). s. 72-83.
23. Ingelfinger J.R. Aliskireeni ja kaksoishoito tyypin 2 diabeteksessa // N. Engl. J. Med. 2008 Voi. 358(23). P. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (ALLAY Investigatorsille). Aldosteronin suppressio välittää vasemman kammion hypertrofian regressiota potilailla, joilla on verenpainetauti // J. Renin-Angiotensin-Aldosterone System. 2011 Voi. 12. s. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et ai. Aliskireeni, uusi reniinin estäjä, on renoprotektiivinen pitkälle edenneen diabeettisen nefropatian mallissa rotilla // Diabetol. 2007 Voi. 50. P. 2398-2404.


