Aldosterons cilvēkiem ir galvenais mineralokortikoīdu hormonu, holesterīna atvasinājumu, pārstāvis.
Sintēze
To veic virsnieru garozas glomerulos zonā. Progesterons, kas veidojas no holesterīna, tiek pakļauts secīgai oksidācijai ceļā uz aldosteronu. 21-hidroksilāze, 11-hidroksilāze un 18-hidroksilāze. Galu galā veidojas aldosterons.

Steroīdu hormonu sintēzes shēma (pilna shēma)
Sintēzes un sekrēcijas regulēšana
Aktivizēt:
- angiotenzīns II, kas izdalās, aktivizējoties renīna-angiotenzīna sistēmai,
- paaugstināta koncentrācija kālija joni asinīs (saistīts ar membrānas depolarizāciju, kalcija kanālu atvēršanu un adenilāta ciklāzes aktivāciju).
Renīna-angiotenzīna sistēmas aktivizēšana
- Lai aktivizētu šo sistēmu, ir divi sākumpunkti:
- spiediena samazināšanās nieru aferentajos arteriolos, kas tiek noteikts baroreceptori juxtaglomerulārā aparāta šūnas. Iemesls tam var būt jebkurš nieru asinsrites pārkāpums - ateroskleroze nieru artērijas, paaugstināta asins viskozitāte, dehidratācija, asins zudums utt.
- Na + jonu koncentrācijas samazināšanās primārajā urīnā nieru distālajās kanāliņos, ko nosaka juxtaglomerulārā aparāta šūnu osmoreceptori. Rodas bezsāls diētas rezultātā, ilgstoši lietojot diurētiskos līdzekļus.
Pastāvīgi un neatkarīgi no nieru asinsrites, renīna sekrēciju (bazālo) uztur simpātiskā nervu sistēma.
- Veicot vienu vai abus šūnas punktus juxtaglomerulārs aparāts tiek aktivizēti un no tiem ferments tiek izdalīts asins plazmā renīns.
- Renīnam plazmā ir substrāts - α2-globulīna frakcijas proteīns angiotenzinogēns. Proteolīzes rezultātā dekapeptīds sauc angiotenzīns I. Tālāk angiotenzīns I ar piedalīšanos angiotenzīnu konvertējošais enzīms(APF) pārvēršas par angiotenzīns II.
- Galvenie angiotenzīna II mērķi ir gludi miocīti asinsvadi Un glomerulozes garozas zona virsnieru dziedzeri:
- asinsvadu stimulēšana izraisa to spazmu un atjaunošanos asinsspiediens.
- pēc stimulācijas izdalās no virsnieru dziedzeriem aldosterons, iedarbojoties uz nieru distālajiem kanāliņiem.
Kad aldosterons iedarbojas uz nieru kanāliņiem, palielinās reabsorbcija Na+ joni, seko nātrijs ūdens. Rezultātā tiek atjaunots spiediens asinsrites sistēmā un palielinās nātrija jonu koncentrācija asins plazmā un līdz ar to arī primārajā urīnā, kas samazina RAAS aktivitāti.

Renīna-angiotenzīna-aldosterona sistēmas aktivizēšana
Darbības mehānisms
Citozolisks.
Mērķi un efekti
Ietekmē siekalu dziedzeri, uz nieru distālajiem kanāliņiem un savākšanas kanāliem. Stiprina nierēs nātrija jonu reabsorbcija un kālija jonu zudums šādu efektu dēļ:
- palielina Na + ,K + -ATPāzes daudzumu par bazālā membrāna epitēlija šūnas,
- stimulē mitohondriju proteīnu sintēzi un šūnā ģenerētās enerģijas daudzuma palielināšanos Na +,K + -ATPāzes darbam,
- stimulē Na kanālu veidošanos uz nieru epitēlija šūnu apikālās membrānas.
Patoloģija
Hiperfunkcija
Conn sindroms (primārais aldosteronisms) – rodas ar glomerulozes zonas adenomām. To raksturo simptomu triāde: hipertensija, hipernatriēmija, alkaloze.
Sekundārais hiperaldosteronisms - jukstaglomerulāro šūnu hiperplāzija un hiperfunkcija un pārmērīga renīna un angiotenzīna II sekrēcija. Ir paaugstināts asinsspiediens un parādās tūska.
Renīna-angiotenzīna-aldosterona sistēma ir enzīmu un hormonu komplekss, kas uztur homeostāzi. Regulē sāls un ūdens līdzsvaru organismā un asinsspiediena līmeni.
Darbības mehānisms
Renīna-angiotenzīna-aldosterona sistēmas fizioloģija rodas pie garozas robežas un kur atrodas jukstaglomerulārās šūnas, kas ražo peptidāzi (enzīmu) - renīnu.
Renīns ir hormons un sākotnējā RAAS saite.
Situācijas, kurās renīns izdalās asinīs
Ir vairāki apstākļi, kādos hormons nonāk asinsritē:
- Samazināta asins plūsma nieru audos - iekaisuma procesu laikā (glomerulonefrīts u.c.), ar diabētiskā nefropātija, nieru audzēji.
- Samazināts (ar asiņošanu, atkārtotu vemšanu, caureju, apdegumiem).
- Asinsspiediena līmeņa pazemināšanās. Nieru artērijās ir baroreceptori, kas reaģē uz sistēmiskā spiediena izmaiņām.
- Nātrija jonu koncentrācijas izmaiņas. Cilvēka organismā ir šūnu kopas, kas reaģē uz izmaiņām asins jonu sastāvā, stimulējot renīna veidošanos. Sāls tiek zaudēta, kad spēcīga svīšana, kā arī ar vemšanu.
- Stress, psihoemocionālais stress. Nieres inervē simpātiskie nervi, kurus aktivizē negatīva psiholoģiska ietekme.
Asinīs renīns tiekas ar proteīnu - angiotenzinogēnu, ko ražo aknu šūnas un ņem no tā fragmentu. Veidojas angiotenzīns I, kas ir angiotenzīnu konvertējošā enzīma (AKE) darbības avots. Rezultāts ir angiotenzīns II, kas kalpo kā otrā saite un ir spēcīgs vazokonstriktors arteriālā sistēma( sašaurina asinsvadus).
Angiotenzīna II ietekme
Mērķis: palielināt arteriālais spiediens.
- Veicina aldosterona sintēzi virsnieru garozas glomerulos.
- Tas ietekmē bada un slāpju centru smadzenēs, izraisot "sāls" apetīti. Cilvēka uzvedība kļūst motivēta meklēt ūdeni un sāļu pārtiku.
- Ietekmē simpātiskie nervi, veicinot norepinefrīna izdalīšanos, kas arī ir vazokonstriktors, bet mazāk vājš darbībā.
- Tas ietekmē asinsvadus, izraisot to spazmas.
- Piedalās hroniskas sirds mazspējas attīstībā: veicina proliferāciju, asinsvadu un miokarda fibrozi.
- Samazina
- Nomāc bradikinīna veidošanos.

Aldosterons ir trešais komponents, kas iedarbojas uz nieru gala kanāliņiem un veicina kālija un magnija jonu izdalīšanos no organisma un nātrija, hlora un ūdens reabsorbciju (reabsorbciju). Sakarā ar to palielinās cirkulējošā šķidruma tilpums, paaugstinās asinsspiediens un palielinās nieru asins plūsma. Aldosterona receptori atrodas ne tikai nierēs, bet arī sirdī un asinsvados.
Kad organisms sasniedz homeostāzi, sāk veidoties vazodilatatori (vielas, kas paplašina asinsvadus) – bradikinīns un kalidīns. Un RAAS sastāvdaļas tiek iznīcinātas aknās.
Renīna-angiotenzīna-aldosterona sistēmas diagramma

Tāpat kā jebkura sistēma, RAAS var neizdoties. Renīna-angiotenzīna-aldosterona sistēmas patofizioloģija izpaužas šādos apstākļos:
- Virsnieru garozas bojājumi (infekcija, asiņošana un traumas). Attīstās aldosterona deficīta stāvoklis, un organisms sāk zaudēt nātriju, hloru un ūdeni, kas izraisa cirkulējošā šķidruma tilpuma samazināšanos un asinsspiediena pazemināšanos. Stāvoklis tiek kompensēts, ieviešot sāls šķīdumi un aldosterona receptoru stimulatori.
- Virsnieru garozas audzējs izraisa aldosterona pārpalikumu, kas apzinās tā ietekmi un paaugstina asinsspiedienu. Tiek aktivizēti arī šūnu dalīšanās procesi, rodas miokarda hipertrofija un fibroze, attīstās sirds mazspēja.
- Aknu patoloģija, kad tiek traucēta aldosterona iznīcināšana un notiek tā uzkrāšanās. Patoloģiju ārstē ar aldosterona receptoru blokatoriem.
- Nieru iekaisuma slimības.

RAAS nozīme dzīvē un medicīnā
Renīna-angiotenzīna-aldosterona sistēma un tās loma organismā:
- pieņem Aktīva līdzdalība lai uzturētu normālu asinsspiedienu;
- nodrošina ūdens un sāļu līdzsvaru organismā;
- uztur skābju-bāzes līdzsvaru asinīs.
Sistēma var neizdoties. Ietekmējot tās sastāvdaļas, jūs varat cīnīties ar hipertensiju. Nieru hipertensijas mehānisms ir arī cieši saistīts ar RAAS.
Ļoti efektīvas narkotiku grupas, kas tika sintezētas, pētot RAAS
- "Prilijs." APF. Angiotenzīns I nepārvēršas par angiotenzīnu II. Nav vazokonstrikcijas – nepaaugstinās asinsspiediens. Zāles: Amprilāns, Enalaprils, Kaptoprils uc AKE inhibitori būtiski uzlabo cukura diabēta pacientu dzīves kvalitāti, nodrošinot nieru mazspējas profilaksi. Zāles lieto minimālās devās, kas neizraisa spiediena pazemināšanos, bet tikai uzlabo lokālo asinsriti un glomerulāro filtrāciju. Zāles ir neaizstājamas nieru mazspējas gadījumā, hroniska slimība sirds un kalpo kā viens no līdzekļiem hipertensijas ārstēšanai (ja nav kontrindikāciju).
- "Sartāni". Angiotenzīna II receptoru blokatori. Kuģi uz to nereaģē un nesaraujas. Zāles: losartāns, eprosartāns utt.

Renīna-angiotenzīna-aldosterona sistēmas pretstats ir kinīna sistēma. Tāpēc RAAS bloķēšana izraisa kinīna sistēmas komponentu (bradikinīna u.c.) palielināšanos asinīs, kas labvēlīgi ietekmē sirds audus un asinsvadu sieniņas. Miokards nepiedzīvo badu, jo bradikinīns palielina lokālo asins plūsmu un stimulē dabisko vazodilatatoru veidošanos nieru medulla šūnās un savācējvadu mikrocītos - prostaglandīnus E un I2. Tie neitralizē angiotenzīna II presējošo efektu. Asinsvadi netiek spazmēti, kas nodrošina adekvātu asins piegādi ķermeņa orgāniem un audiem, netiek aizturētas asinis un samazinās aterosklerozes plankumu un asins recekļu veidošanās. Kinīni labvēlīgi ietekmē nieres un palielina diurēzi (ikdienas urīna izdalīšanos).
Renins
– enzīms, ko sintezē nieru aferento arteriolu jukstaglomerulārās šūnas un kura MW ir aptuveni 40 kDa. Īpaši intensīvi renīna veidošanās notiek nieru išēmijas laikā. Juxtaglomerulāro šūnu atrašanās vieta padara tās īpaši jutīgas pret asinsspiediena izmaiņām, kā arī Na + un K + jonu koncentrāciju šķidrumā, kas plūst caur nieru kanāliņiem. Šo īpašību dēļ jebkura faktoru kombinācija, kas izraisa šķidruma tilpuma samazināšanos (dehidratācija, asinsspiediena pazemināšanās, asins zudums utt.) vai samazināšanos. NaCl koncentrācija, stimulē renīna izdalīšanos.
Tajā pašā laikā lielākā daļa renīna sintēzes regulatoru darbojas caur nieru baroreceptori. Renīna izdalīšanos ietekmē centrālās nervu sistēmas stāvoklis, kā arī ķermeņa stāvokļa izmaiņas kosmosā. Jo īpaši, pārejot no guļus stāvokļa uz sēdu vai stāvu (klinostatiskais tests), palielinās renīna sekrēcija. Šo reflekso reakciju izraisa veģetatīvās sistēmas simpātiskās daļas tonusa palielināšanās nervu sistēma, pārraidot impulsus uz jukstaglomerulāro šūnu b-adrenerģiskajiem receptoriem.
Galvenais substrāts, ko ietekmē renīns, ir angiotenzinogēns– proteīns, kas iekļauts 2-globulīnu frakcijā un ko ražo aknas. Glikokortikoīdu un estrogēnu ietekmē ievērojami palielinās angiotenzinogēna sintēze. Renīna darbības rezultātā angiotenzinogēns tiek pārveidots par dekapeptīdu angiotenzīnsesŠim savienojumam ir ārkārtīgi vāja iedarbība un tas būtiski neietekmē asinsspiediena līmeni.
Tikmēr angiotenzīnses ietekmē t.s angiotenzīnu konvertējošais enzīms (AKE) pārvēršas par spēcīgu vazokonstriktora faktoru - angiotenzīnsII. APF(dipeptīda karboksipeptidāze) ir neatņemama olbaltumviela, kas galvenokārt atrodas uz endotēlija šūnu membrānas, epitēlija, mononukleāro šūnu, nervu galiem, reproduktīvo orgānu šūnām utt. AKE šķīstošā forma ir gandrīz visos ķermeņa šķidrumos.
Ir ierasts atšķirt divas AKE izoformas. Pirmais no tiem saņēma parasto nosaukumu "somatisks". Šīs izoformas MW ir 170 kDa, un tajā ir homologi C un N domēni. Otrā ACE forma (“reproduktīvā”) ir atrodama sēklas šķidrumā, tās MW ir aptuveni 100 kDa, un tā atbilst ACE pirmās izoformas C domēnam. Katrs no 2 norādītajiem domēniem satur aminoskābju atlikumus, kas var piedalīties saites veidošanā ar cinka atomu. Šādas Zn 2+ struktūras ir raksturīgas daudzām metaloproteināzēm un ir galvenās enzīma mijiedarbības vietas gan ar substrātu, gan AKE inhibitoriem.
Jāatzīmē, ka ACE ne tikai noved pie veidošanās angiotenzīns II, bet arī iznīcina bradikinīns - paplašināšanas savienojums asinsvadi. Tāpēc asinsspiediena paaugstināšanās, saskaroties ar AKE, ir saistīta gan ar angiotenzīna II veidošanos, gan ar bradikinīna sadalīšanos (32. att.).
Svarīgu lomu AKE darbībā spēlē jonu sastāvs un jo īpaši hlora jonu saturs. Tādējādi augstās Cl koncentrācijās AKE C domēns gan bradikinīnu, gan angiotenzīnu I hidrolizē ātrāk nekā N domēns. Ekstracelulārajos reģionos, kur ir augsta hlorīda anjonu koncentrācija, N-domēns galvenokārt ir atbildīgs par angiotenzīna-I pārveidi. Tomēr intracelulāri, kur Cl koncentrācija ir zema, N-domēns var piedalīties citu peptīdu vielu hidrolīzē.
Aiz muguras pēdējie gadi Ir konstatēts, ka AKE ir nozīmīga loma asinsradi, jo tās ietekmē veidojas hematopoētiskais peptīds, kavējot hematopoētisko šūnu veidošanos kaulu smadzenēs.
AKE loma organismā tika atklāta pelēm, kurām trūka ACE gēna. Šādiem dzīvniekiem bija zems asinsspiediens, dažādas asinsvadu disfunkcijas, nieru struktūras un funkcijas traucējumi, kā arī tēviņu neauglība.
AngiotenzīnsII
paaugstina asinsspiedienu, izraisot arteriolu sašaurināšanos, un ir visspēcīgākais zināmais vazoaktīvais līdzeklis. Turklāt, izmantojot atgriezeniskās saites mehānismu, tas kavē renīna veidošanos un izdalīšanos no nieru jukstaglomerulārajām šūnām, kam galu galā vajadzētu atjaunot normālu asinsspiediena līmeni. Ietekmē angiotenzīnsII krasi palielinās galvenā mineralokortikoīda ražošana, aldosterons. Lai gan šī darbība ir tieša, angiotenzīns II neietekmē kortizola veidošanos. Aldosterona galvenais mērķis ir Na + aizture (pastiprinot tā reabsorbciju nieru kanāliņos) un K + un H + izdalīšanās (galvenokārt caur nierēm). Šīs reakcijas tiek veiktas šādi.
Aldosterons
no ekstracelulārā šķidruma iekļūst šūnas citoplazmā un tur savienojas ar specifisku receptoru, pēc kura iegūtais komplekss (aldosterons + receptors) iekļūst kodolā. Aldosterons arī stimulē Na + kanālu atvēršanu, ļaujot Na + joniem iekļūt šūnā caur apikālo membrānu no kanāliņu lūmena.
K + sekrēcijas palielināšanās aldosterona ietekmē ir saistīta ar apikālās membrānas caurlaidības palielināšanos attiecībā pret šiem joniem, kā rezultātā K + no šūnas nonāk kanāliņu lūmenā.
Na+ aizture organismā, tāpat kā angiotenzīns II, veicina paaugstinātu asinsspiedienu.
AngiotenzīnsII spēj saistīties ar specifiskiem virsnieru dziedzera glomerulāro šūnu receptoriem. Šo receptoru saturs lielā mērā ir atkarīgs no K + jonu koncentrācijas. Tātad, ja K + līmenis palielinās, palielinās angiotenzīna II receptoru skaits glomerulārās šūnās. Samazinoties K + jonu koncentrācijai, tiek novērots pretējs efekts. Tāpēc K + joniem ir liela nozīme angiotenzīna II iedarbībā uz virsnieru dziedzeriem.
Aiz muguras Nesen noteica, ka angiotenzīnsII spēj aktivizēt makrofāgus, tādējādi palielinot trombocītu agregāciju un paātrinot asins recēšanu. Tajā pašā laikā tas tiek atbrīvots aktivatora inhibitors plazminogēns-es (IAP-1), ko var pavadīt fibrinolīzes nomākums. A giotenzīnsII ir viens no faktoriem, kas veicina ateroģenēzes attīstību, apoptozes inhibīciju un paaugstinātu oksidatīvo stresu audos, tādējādi provocējot trombocītu agregāciju un trombu veidošanos.
AngiotenzīnsII spēj uzlabot miokarda darbību, piedalās norepinefrīna un citu fizioloģiski aktīvo vielu biosintēzē. Tajā pašā laikā tas var darboties kā augšanas faktors, izraisot asinsvadu un sirds hipertrofiju.
Dažiem dzīvniekiem un cilvēkiem angiotenzīnsII fermenta ietekmē aminopeptidāzes pārvēršas par heptapeptīdu angiotenzīnsIII. Cilvēkiem angiotenzīna II līmenis ir aptuveni 4 reizes augstāks nekā angiotenzīna III līmenis. Abi šie savienojumi ietekmē asinsspiedienu un aldosterona veidošanos, un tos diezgan ātri sadala fermenti angiotenzināze.
Smagas nieru slimības, ko pavada išēmija, sakarā ar palielinātu renīna veidošanos un sekrēciju, tiek novērots pastāvīgs asinsspiediena paaugstināšanās ( nieru hipertensija). AKE inhibitoru lietošana šajos apstākļos izraisa ātru asinsspiediena normalizēšanos.
Noslēgumā vēlreiz jāuzsver, ka angiotenzīna-renīna-aldosterona sistēma ir cieši saistīta ar kallikreīna-kinīna sistēmas darbību, jo angiotenzīna II veidošanās un bradikinīna iznīcināšana notiek tās pašas sistēmas ietekmē. enzīms - AKE.
Catad_theme Arteriālā hipertensija- raksti
Catad_tema Aptaukošanās - raksti
Aptaukošanās un arteriālā hipertensija
Publicēts žurnālā:SIEVIEŠU VESELĪBAS PROBLĒMAS Nr.4, 3.sējums, 2008.g.
E. I. Astaškins, M. G. Glezers
Nosaukta Maskavas Medicīnas akadēmija. I.M.Sečenova
KOPSAVILKUMS
Pārskatā analizēta aptaukošanās loma arteriālās hipertensijas attīstībā un sirds un asinsvadu slimības, šī savienojuma patofizioloģiskie mehānismi, renīna-angiotenzīna-aldosterona sistēmas (RAAS) dominējošā loma. Tiek apspriesti jautājumi par paaugstināta asinsspiediena farmakoloģisko korekciju pacientiem ar aptaukošanos, izmantojot fiksētu zāļu kombināciju, kas bloķē RAAS un verapamilu. Tiek sniegta analīze par sibutramīna lietošanas efektivitāti un drošību svara zudumam pacientiem ar augstu asinsspiedienu.
Atslēgvārdi: aptaukošanās, arteriālā hipertensija, ārstēšana.
KOPSAVILKUMS
Autori analizēja aptaukošanās lomu arteriālās hipertensijas un sirds un asinsvadu slimību attīstībā, šo attiecību patofizioloģiskos mehānismus un renīna-angiotenzīna-aldosterona sistēmas (RAAS) dominējošo lomu. Tika pierādīts, ka augsta asinsspiediena farmakoloģiskā korekcija pacientiem ar aptaukošanos ar fiksētu RAAS blokatoru un verapamila kombināciju ir efektīva. Tiek sniegta sibutramīna efektivitātes un drošības analīze svara zaudēšanai pacientiem ar augstu asinsspiedienu.
Atslēgas vārdi: aptaukošanās, arteriālā hipertensija, ārstēšana.
Aplūkojamās tēmas aktualitāte ir saistīta ar to, ka pēdējos gados visā pasaulē ir ievērojami pieaudzis to cilvēku skaits, kuriem ir aptaukošanās. Aptaukošanās pašlaik tiek uzskatīta par vienu no galvenajiem faktoriem, kas veicina tādu slimību attīstību, kas ir galvenie pieaugušo mirstības cēloņi. Pirmkārt mēs runājam par par 2. tipa cukura diabēta attīstību, kā arī sirds un asinsvadu un onkoloģiskās slimības. Svara pieaugums par 1 kg palielina sirds un asinsvadu slimību risku par 3,1% un diabēta risku par 4,5-9%.
Ir zināms, ka aptaukošanās gadījumā risks saslimt ar arteriālo hipertensiju, faktors, kas būtiski ietekmē arī sirds un asinsvadu slimību, piemēram, sirdslēkmes un insultu, rašanos, ir trīskāršs salīdzinājumā ar cilvēkiem ar normālu ķermeņa svaru. Kā parādīts INTERSALT pētījumā, uz katriem 4,5 kg svara pieauguma sistoliskais asinsspiediens (BP) palielinās par 4,5 mmHg. Art. .
Aptaukošanās kā riska faktors sievietēm ar arteriālā hipertensija, īpaši vecākā vecumā, rodas biežāk nekā vīriešiem. Viens no iemesliem ir hipoestrogēnisms, kas rodas pēcmenopauzes periodā. Tiek atzīmētas dažas aptaukošanās izplatības pazīmes dažādu veidu arteriālās hipertensijas gadījumā. Tādējādi gados vecākām sievietēm ar izolētu sistolisko hipertensiju aptaukošanās nav tik izplatīta, un nav datu par svara zaudēšanas ietekmi uz šo pacientu kategoriju. Sievietēm ar vēdera aptaukošanos un sistoliski-diastolisko arteriālās hipertensijas formu svara zudums ir svarīgs punkts slimību kontrolē.
Ar aptaukošanos notiek vairākas hemodinamiskas izmaiņas, jo īpaši palielinās cirkulējošo asiņu tilpums, insulta tilpums un sirds izsviede ar relatīvi normālu asinsvadu pretestību. Tiek uzskatīts, ka augsts asinsspiediens pacientiem ar aptaukošanos galvenokārt ir saistīts ar palielinātu sirds izsviedi ar "neadekvāti normālu" perifēro pretestību.
Šim hemodinamiskajam stāvoklim ir stimulējoša ietekme uz divām antagonistiskām regulēšanas sistēmām, kas kontrolē asins tilpumu un perifērā pretestība- renīna-angiotenzīna-aldosterona sistēma (RAAS) un sirds nātrijurētisko peptīdu sistēma. To disregulācija lielā mērā var izskaidrot lielo sirdsdarbības apjomu pacientiem ar aptaukošanos un hipertensiju. Turklāt šīs sirds un asinsvadu regulējošās sistēmas ir iesaistītas vielmaiņas izmaiņās, kas saistītas ar lieko ķermeņa svaru sirds un asinsvadu slimību gadījumā.
Tātad aptaukošanās gadījumā arteriālās hipertensijas patoģenēzē nozīmīgu lomu spēlē trīs galvenie mehānismi:
Arteriālās hipertensijas un sirds un asinsvadu slimību attīstības patoģenēze aptaukošanās gadījumā shematiski parādīta 1. attēlā.
1. attēls. Arteriālās hipertensijas un sirds un asinsvadu slimību patoģenēzes shēma aptaukošanās gadījumā
Sistēmiskā un audu renīna-angiotenzīna-aldosterona sistēma un tās izmaiņas aptaukošanās gadījumā
RAAS ietver angiotensinogēnu, renīnu, angiotenzīnu I, angiotenzīnu konvertējošo enzīmu (AKE) un angiotenzīnu II (AT II). AT II daudzveidīgi iedarbojas uz dažādām šūnām, kurām ir specifiski receptori.
Saskaņā ar klasiskajiem jēdzieniem angiotenzinogēns veidojas aknās un renīna ietekmē sintezējas nieru periglomerulārajās šūnās (jukstaglomerulārajās šūnās), angiotenzinogēns asinīs pārvēršas par angiotenzīnu I. AKE ir atbildīgs par AT šķelšanos. I, kā rezultātā veidojas AT II.
Ir svarīgi atzīmēt, ka aptaukošanās gadījumā tiek traucēti RAAS darbību regulējošie mehānismi. Fizioloģiskos apstākļos palielināta RAAS aktivitāte palielina rezistenci perifērie trauki un, attiecīgi, uz asinsspiediena paaugstināšanos. Saskaņā ar atgriezeniskās saites principu asinsspiediena paaugstināšanās izraisa renīna sekrēcijas samazināšanos, AT II līmeņa pazemināšanos un aldosterona līmeņa pazemināšanos. Tas savukārt samazina šķidruma un nātrija aizturi un uztur asinsspiedienu normālā līmenī.
Tomēr pacientiem ar viscerālu aptaukošanos ir traucēta RAAS sistēmiskās cirkulācijas komponentu līmeņa regulēšana. Neskatoties uz paaugstinātu asinsspiedienu, nātrija un šķidruma aizturi, kā arī cirkulējošā asins tilpuma palielināšanos, plazmas renīna un aldosterona aktivitāte saglabājas normāla vai pat nedaudz paaugstināta. Šāda RAAS disregulācija aptaukošanās gadījumā var būt RAAS komponentu veidošanās palielināšanās un/vai sekundāra to koncentrācijas palielināšanās sekas natriurētisko peptīdu sistēmas defektu dēļ.
Tika konstatēts, ka papildus asins RAAS ir audi jeb tā sauktais lokālais RAAS, kas ir identificēts vairākos audos un orgānos, tostarp smadzenēs, sirdī, asinsvados, nierēs, sēkliniekos, taukaudos. utt.
Kā zināms, AT II veidošanā galveno lomu spēlē divi faktori: renīna aktivitāte un angiotenzinogēna koncentrācija. Angiotenzinogēna sintēze un sekrēcija šūnās dažādi veidi ne tikai nosaka AT II vietējās koncentrācijas palielināšanos, bet arī palielina RAAS sistēmisko aktivitāti. Hronisku AT II infūziju pelēm pavadīja ievērojams angiotenzinogēna mRNS satura pieaugums adipocītos. Šie rezultāti liecina par pozitīvu atgriezenisko saiti starp AT II un angiotenzinogēnu, kur viena līdzekļa līmeņa paaugstināšanās stimulē otrās veidošanos. Aptaukošanās gadījumā, īpaši viscerālā tipa, plazmas renīna aktivitāte, kā jau norādīts, saglabājas normālā vai nedaudz paaugstināts līmenis, un palielinās angiotenzinogēna un AT II līmenis.
Taukaudu struktūra un fizioloģiskās īpašības
Taukaudi satur dažāda veida šūnas, tostarp adipocītus, makrofāgus, fibroblastus, asinsvadu endotēlija šūnas un preadipocītus (adipoblastus). Pēdējā veida šūnas nāk no pluripotentām mezodermas cilmes šūnām. Pieauguša cilvēka organismā no preadipocītiem veidojas jauni diferencēti (“mazie”) adipocīti. Šo adipocītu izmērs palielinās ("lielie" adipocīti) palielinātas uztura dēļ. taukskābes. Garās ķēdes taukskābes no asinīm iekļūst adipocītos un tiek nogulsnētas neitrālu triacilglicerīnu veidā. Taukaudi ir atbildīgi par garo ķēžu taukskābju uzglabāšanu un sekrēciju, kas darbojas kā viens no galvenajiem enerģijas substrātiem daudziem orgāniem un audiem, piemēram, sirds un skeleta muskuļiem. “Lielākie” adipocīti izdala ievērojami vairāk piesātināto taukskābju. Triglicerīdu hidrolīze un taukskābju izdalīšanās notiek intracelulārās hormonu jutīgās lipāzes ietekmē, kuras darbību kontrolē kateholamīni (pozitīvā regulēšana) un insulīns (negatīvā regulēšana).
Taukaudu endokrīnā darbība
Atšķirībā no zemādas tauki, kas parasti veido 75% no kopējiem ķermeņa taukaudiem un ir galvenā lipīdu uzglabāšanas vieta, viscerālie tauki pašlaik tiek uzskatīti par aktīviem hormonus ražojošiem audiem.
Adipocīti ražo plaša spektra hormoni un citokīni, kas iesaistīti glikozes (adiponektīns, rezistīns utt.), lipīdu (holesterīna esteru pārneses proteīna), iekaisuma (TNF-α, interleikīna-6), koagulācijas (plazminogēna aktivatora inhibitors-1), asinsspiediena regulēšanā. (angiotenzinogēns, AT II), ēšanas uzvedība(leptīns), kā arī ietekmē dažādu orgānu un audu, tostarp muskuļu, aknu, smadzeņu un asinsvadu vielmaiņu un funkcionālo aktivitāti (skatīt tabulu).
Tabula. Endokrīnā funkcija adipocīti: adipocitokīni
| Adipocitokīni | Adipocitokīnu ietekme |
| Leptīns | Pārtikas uzsūkšanās, tauku masa |
| Adiponektīns | |
| Resistīns | Insulīna rezistence, iekaisums |
| Visfatīns | Insulīna rezistence |
| Omentin | Insulīna rezistence |
| Serpīns, kas izdalās no viscerālajiem taukaudiem (Vaspin) | Insulīna rezistence |
| Apelīns | Vazodilatācija |
| Holesterīna estera pārneses proteīns (CETP) | Lipīdu metabolisms |
| Lipoproteīna lipāze (LPL) | Lipīdu metabolisms |
| Hormonjutīgā lipāze (HSL) | Lipīdu metabolisms |
| Adipocītu taukskābes saistošais proteīns-4 (A-FABP-4 (aP2)) | Lipīdu metabolisms |
| Perlipīns | Lipīdu metabolisms |
| Renitolu saistošais proteīns (RBP) | Lipīdu metabolisms |
| Acilāciju stimulējošais proteīns (ASP) | Lipīdu metabolisms |
| Angiotenzīns II (AT II) | Arteriālais spiediens |
| Angiotenzīnu konvertējošais enzīms (ACE) | Arteriālais spiediens |
| Angiotensinogēns (AGT) | Arteriālais spiediens |
| Audzēja nekrozes faktors alfa (TNF-a) | Iekaisums |
| Interleikīns, 6 (IL-6) | Iekaisums |
| C-reaktīvais proteīns (CRP) | Iekaisums |
| Adipocītu-tripsīna/komplementa faktors D (adipsīns) | Iekaisums |
| Makrofāgu ķīmijatraktants proteīns-1 (MCP-1) | Makrofāgu atraktants |
| Starpšūnu adhēzijas molekula-1 (ICAM-1) | Makrofāgu aktivizēšana |
| Plazminogēna aktivatora inhibitors-1 (PAI-1) | Fibrinolīze |
Ir svarīgi uzsvērt, ka pat neliels apjoma pieaugums viscerālie tauki spēlē nozīmīgu lomu vielmaiņas traucējumos, ūdens-elektrolītu līdzsvara regulēšanā un sirds un asinsvadu slimībās.
Palielinoties taukaudu masai, palielinās gandrīz visu adipokīnu saturs asinīs. Izņēmums ir adiponektīns, kura līmenis šajos apstākļos samazinās. Leptīns un adiponektīns šobrīd ir visvairāk pētītie adipokīni.
Leptīns. Leptīna ražošana notiek galvenokārt "lielos" adipocītos. Leptīnu bieži uzskata par signālmolekulu, kas ir starpnieks starp organismā nonākušo barības vielu saturu, taukaudu stāvokli un centrālo nervu sistēmu (hipotalāmu). Leptīns palielina lipīdu oksidāciju aknās, kā arī lipolīzi adipocītos un skeleta muskuļi. Insulīns stimulē leptīna veidošanos. Leptīna līmeni ietekmē arī brīvās taukskābes, TNF-α, estrogēni un augšanas hormons.
Adiponektīns. Adiponektīna ražošana notiek tikai adipocītos. Adiponektīnam ir daudzveidīga bioloģiska iedarbība – tam piemīt antiaterogēna iedarbība, tas paaugstina šūnu jutību pret insulīnu, nomāc glikozes sintēzi aknās, uzlabo tā transportēšanu uz muskuļiem, paaugstina taukskābju oksidēšanos. Adiponektīna līmenis samazinās aptaukošanās, insulīna rezistences un 2. tipa diabēta gadījumā.
Taukaudi un RAAS aktivitāte
Izrādījās, ka angiotenzinogēna veidošanā taukaudi ieņem otro vietu aiz aknām. Piemēram, angiotenzinogēna mRNS daudzums adipocītos ir aptuveni 70% no līmeņa aknās. Saistība starp angiotenzinogēna līmeni, aptaukošanos un arteriālo hipertensiju ir skaidri pierādīta eksperimentos, izmantojot transgēnas peles, kas ekspresē pārmērīgu angiotenzinogēna daudzumu taukaudos. Šīm pelēm ir viscerālā aptaukošanās un hipertensija. Preadipocīti un diferencēti tauku šūnas ir pilns komponentu komplekts, kas nepieciešams vietējai AT II sintēzei, kā arī AT 1 receptors AT II, kas nodrošina AT II aktivizēto aktivācijas signālu intracelulāro pārraidi. Aptaukošanās gadījumā viscerālo diferencēto adipocītu apjoms palielinās 20-30 reizes. Aptaukošanos raksturo adipocītu disfunkcija, ar ko saprot pastiprinātu dažādu adipokīnu, citokīnu veidošanos un sekrēciju, kā arī RAAS komponentu satura palielināšanos, galvenokārt viscerālajos taukos.
Apkopojot dažādu pētījumu datus, varam konstatēt, ka ar aptaukošanos ir vērojama RAAS aktivitātes palielināšanās, kas atspoguļojas sekojošos faktos:
Augsta aktivitāte Savukārt RAAS izraisa taukaudu masas palielināšanos. Konkrēti, transgēnām pelēm, kas pārmērīgi ekspresē angiotenzinogēnu tikai tauku šūnās, tika konstatēts paaugstināts angiotenzinogēna līmenis asinīs, hipertensijas attīstība un palielināta taukaudu masa. Audi AT II būtībā darbojas kā adipocītu augšanas faktors. AT II, iedarbojoties uz AT 1 receptoriem, izraisa ciklīna D 1 proteīna palielināšanos, kas ir iesaistīts tauku šūnu augšanas un dalīšanās regulēšanā. Ir pierādīts, ka AT II inducē G 1 fāzes pāreju šūnu cikls cilvēka preadipocītos. Šis efekts bija saistīts ar ietekmi uz AT 1 receptoriem un sekojošu ciklīna D 1 atkarīgās kināzes aktivāciju.
Ir konstatēts, ka AT II izraisa preadipocītu diferenciāciju, aktivizē galvenos lipīdu veidošanās enzīmus (lipoģenēzi) un palielina triglicerīdu uzkrāšanos adipocītos.
Viscerālo aptaukošanos pavada 1. tipa 11-beta-hidroksisteroīdu dehidrogenāzes aktivitātes palielināšanās, kas izraisa kortizola veidošanos, kas ir galvenais hormons preadipocītu diferenciācijā adipocītos.
Audu RAS aktivitāte ir cieši saistīta ar adipokīnu ražošanu taukaudos. Piemēram, ir pierādīts, ka AT II inducē leptīna ekspresiju adipocītos. Tika ierosināts, ka šāda aktivitāte ir raksturīga tikai lokāli sintezētajam AT II atšķirībā no sistēmiskās AT II.
Aptaukošanās un simpātiskās nervu sistēmas darbība
Ar aptaukošanos, īpaši ar tās vēdera variantu, ļoti bieži tiek novērota simpātiskās nervu sistēmas aktivizēšanās. NAS (Normotesive Aging Study) atklāja norepinefrīna palielināšanos urīnā, kas ir proporcionāla ķermeņa masas indeksam. Zaudējot svaru, samazinās simpātiskās nervu sistēmas aktivitāte.
Simpātiskās nervu sistēmas pastiprinātu aktivitāti aptaukošanās gadījumā veicina hiperinsulinēmija un insulīna rezistence. Insulīns pats par sevi var palielināt simpatoadrenālās sistēmas aktivitāti, bet tas var būt daļēji saistīts ar leptīna darbību. Ir zināms, ka, palielinoties aptaukošanās pakāpei, palielinās leptīna līmenis tukšā dūšā, ko izdala adipocīti. Leptīns palielina simpātiskās nervu sistēmas aktivitāti, īpaši nierēs. Tas, no vienas puses, izraisa lielu izlaidi un palielinātu sirdsdarbības ātrumu, no otras puses, palielinātu nātrija reabsorbciju un intravaskulārā asins tilpuma palielināšanos.
Ir izveidota saistība starp RAAS un simpātisko nervu sistēmu. Simpātiskās nervu sistēmas aktivizēšana ir saistīta ar palielinātu renīna sekrēciju nierēs, un tas notiek neatkarīgi no intrarenālas maņu sistēma regulē renīna sekrēciju caur nierēm. Turklāt cikliskā adenozīna monofosfāta palielināšanās kateholamīnu ietekmē stimulē angiotenzinogēna ekspresiju cilvēka adipocītos. AT II līmeņa paaugstināšanās cilvēkiem palielina simpātiskās nervu sistēmas aktivitāti. Konstatēts, ka AT II aktivizē lokālo simpātisko nervu sistēmu, kas ir iesaistīta ķermeņa temperatūras paaugstināšanā (termoģenēzē). Aukstā apstrāde izraisa AT II satura palielināšanos adipocītos, vienlaikus nemainot AT II līmeni plazmā.
Tādējādi RAAS disregulācija aptaukošanās gadījumā var stimulēt arī simpātiskās nervu sistēmas darbību.
Augsta asinsspiediena farmakoloģiskās korekcijas metodes aptaukošanās gadījumā
Dažādu patoģenētisko mehānismu ieguldījums augsta asinsspiediena uzturēšanā aptaukošanās gadījumā var būt atšķirīgs. Tādēļ antihipertensīvie līdzekļi ar ļoti atšķirīgu darbības mehānismu var labvēlīgi ietekmēt šo situāciju.
Saskaņā ar mūsdienu ieteikumiem arteriālās hipertensijas ārstēšanā būtiska asinsspiediena pazemināšanās panākumu atslēga ir kombinētās terapijas izmantošana. Pacientiem ar aptaukošanos, pirmkārt, šādas terapijas galvenajām sastāvdaļām jābūt RAAS aktivitāti mazinošu zāļu (AKE inhibitori un sartāni) kombinācijai ar zālēm, kas samazina simpātiskās nervu sistēmas darbību (β-blokatori un nedihidropiridīna kalcija antagonisti) un diurētiskie līdzekļi. Augsta efektivitāte Zāļu lietošana, kas bloķē RAAS aptaukošanās gadījumā, ir pierādīta daudzos pētījumos. Attiecībā uz β-blokatoru lietošanu dati ir ļoti pretrunīgi, pirmkārt, kopumā šaubu dēļ par to lietderību nekomplicētas arteriālās hipertensijas pacientu ārstēšanā, un, otrkārt, sakarā ar to, ka β-blokatori, vismaz. klasiskās, var palielināt pacientu svaru un palielināt insulīna rezistenci. Tāpēc, ja mēs izvēlamies β-blokatorus pacientu ar aptaukošanos vai metabolisko sindromu ārstēšanai, tad tiem vajadzētu būt zālēm ar īpašām īpašībām, jo īpaši karvedilolu un nebivololu.
Tajā pašā laikā tika konstatēts, ka nedihidropiridīna kalcija antagonists verapamils var ne tikai būtiski samazināt asinsspiedienu, bet arī samazināt simpātiskās nervu sistēmas aktivitāti.
Tādējādi aptaukošanās gadījumā arteriālās hipertensijas ārstēšanai var izmantot RAAS bloķējošu zāļu un verapamila kombināciju.
Jāuzsver, ka šāda veida kombinācija zāles pastāv gatavu kombināciju veidā zāļu forma- zāles Tarka, kas satur taukos šķīstošu AKEI - trandolaprilu un lēnas darbības verapamilu (verapamilu SR). Šī pieeja ir ļoti svarīga efektīvai terapijai, jo gatavo zāļu formu lietošana uzlabo pacienta atbilstību ārstēšanai.
Ir pierādījumi, ka Tarka lielākā mērā nekā katra tā sastāvdaļa samazina asinsspiedienu, tai ir izteikta spēja samazināt kreisā kambara hipertrofiju, palīdz normalizēt endotēlija darbību un ir metaboliski neitrāla pat pacientiem ar cukura diabētu.
Dubultā darbība- RAAS aktivitātes samazināšanās trandolaprila ietekmē un simpātiskā nervu sistēma verapamila ilgstošas darbības dēļ - nodrošina nozīmīgu ietekmi uz patoģenētiskie mehānismi arteriālās hipertensijas attīstība aptaukošanās gadījumā un mehānismi, kas provocē mērķa orgānu bojājumus šāda veida hipertensijas gadījumā.
Apspriežot hipertensijas ārstēšanu aptaukošanās gadījumā, īpaša uzmanība jāpievērš tam, ka terapija, kuras pamatā ir trandalaprila kombinācija ar ilgstošas darbības verapamilu, var samazināt cukura diabēta attīstības risku salīdzinājumā ar citas ārstēšanas taktikas - kombinācijas lietošanu. sartāna ar mazu tiazīdu grupas diurētiskā līdzekļa devu. STAR pētījums skaidri parāda, ka, lietojot Tarka vienu gadu, mazāk cilvēku attīstās ar metabolisko sindromu, kurā dominē vēdera aptaukošanās. cukura diabēts(2. att.) .
2. attēls. Jaunu cukura diabēta gadījumu (glikozes līmenis tukšā dūšā > 126 mg/dL vai 2 stundu glikozes tolerances tests > 200 mg/dL) attīstība pēc antihipertensīvās terapijas veida personām ar metabolo sindromu STAR pētījumā.

Turklāt, saskaņā ar STAR-LET pētījumu, pat tad, ja cukura diabēts rodas uz fona zāļu terapijašo pacientu nodošana zāļu Tarka lietošanai ļāva normalizēties pusei pacientu ogļhidrātu metabolisms.
Šo pētījumu rezultāti liek mums pārskatīt ieteikumus zāļu terapija arteriālo hipertensiju personām ar metabolisko sindromu un sākt terapiju ar kombināciju, kas satur AKE inhibitoru (vai sartānu) un kalcija antagonistu, vai pārcelt pacientus uz līdzīgu terapiju.
Kā jau daudzkārt minēts, arteriālās hipertensijas ārstēšanā liela nozīme ir pacientu svara un vēdera aptaukošanās pakāpes samazināšanai. Protams, ķermeņa masas samazināšana vienā vai otrā veidā var būtiski ietekmēt saslimstības ar sirds un asinsvadu slimībām samazināšanos. Pašlaik ir dažādas pieejas aptaukošanās medikamentozai terapijai. Pirmais ir simptomātiska ārstēšana, proti, patērēto kaloriju skaita samazināšana, samazinot tauku uzsūkšanos no pārtikas. Šo pieeju var saukt par kompensējošu. Patiešām, ar šādu terapiju slimība netiek izvadīta (jo pacients turpina pārēsties), bet to tikai īslaicīgi kompensē zāles. Vēl viena pieeja liekā svara un aptaukošanās ārstēšanai ir risināt problēmas sakni, proti, hronisku pārēšanās. Šādi darbojas sibutramīns (Meridia). Tas izraisa ātru sāta sajūtu un samazina patērētās pārtikas daudzumu, nomācot norepinefrīna un serotonīna atpakaļsaisti neironu ķēžu sinapsēs. Šodien Meridia ir vienīgā oriģinālās zāles, novēršot aptaukošanās cēloni.
Būtiskā atšķirība starp sibutramīnu ir tāda, ka, neizraisot apetītes samazināšanos, tas veicina agrāku sāta sajūtas rašanos. Cilvēks atbrīvojas no patoloģiskā pārēšanās ieraduma, kā rezultātā pakāpeniski un ilgtspējīgi samazinās ķermeņa svars. Sibutramīna ietekmē pārtikas patēriņš samazinās par aptuveni 20%. Līdz ar to sibutramīns netieši ietekmē biogēno amīnu līmeni asinīs, kas aktivizē adrenerģiskos receptorus taukaudos un ierosina lipolīzi adipocītos, ko pavada enerģētisko substrātu satura izmaiņas asinīs. Sibutramīns, aktivizējot β 2 - un β 3 -adrenerģiskos receptorus, uzlabo termoģenēzes procesus un palielina enerģijas patēriņu organismā.
Sibutramīna (Meridia) klīniskā efektivitāte un drošība ir pierādīta lielos daudzumos daudzcentru pētījumi. Jo īpaši STORM (Sibutramine Trial on Obesity Reduction and Maintenance) pētījumā, kurā piedalījās 605 pacienti ar aptaukošanos, tika pierādīts, ka divu gadu sibutramīna lietošana samazina pacientu svaru 3 reizes un vidukļa apkārtmēru - 2 reizes izteiktāk. nekā placebo.. Svarīgi, ka 80% pacientu saglabāja svara zudumu divu gadu laikā, salīdzinot ar 16% pacientu, kas saņēma placebo (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов liels blīvums palielinājās par 21%, samazinoties zema blīvuma lipoproteīnu un triglicerīdu līmenim.
Svara zaudēšanas labvēlīgā ietekme, ārstējot pacientus ar arteriālo hipertensiju un citām sirds un asinsvadu slimībām, var būt arī apstāklī, ka intraabdominālo tauku samazināšanās var samazināt nieru mehānisko saspiešanu, kā rezultātā var uzlaboties asins piegāde nierēm. un RAAS aktivitātes samazināšanās. Taukaudu samazināšanās nierēs un ap tām var izraisīt samazinātu intersticiālu spiedienu, Henlija cilpas plānās daļas saspiešanu, palielinātu asins plūsmu vazās taisnajā zarnā un samazinātu Na + un ūdens reabsorbciju cauruļveida formā. Tādējādi svara zudums, ko izraisa ne-narkotiku vai zāļu korekcijas metodes, var samazināt asinsspiedienu.
Tomēr vēl nesen reāli klīniskā prakse sibutramīns tika lietots piesardzīgi, baidoties no tā iespējamības negatīva ietekme uz asinsspiedienu un sirdsdarbības ātrumu, kas savukārt var izraisīt nepatīkamas, lai gan nelielam pacientu skaitam subjektīvās sajūtas. Lai izpētītu sibutramīna ietekmi uz sirds un asinsvadu sistēmu un pierādītu zāļu drošumu pacientu grupā ar paaugstinātu sirds un asinsvadu slimību risku, veikts liela mēroga daudzcentru, dubultmaskēts, placebo kontrolēts starptautisks pētījums SCOUT (Sibutramine Cardiovascular). OUTcomes), tika uzsākta 10 742 pacienti, no kuriem 97% bija slimības. sirds un asinsvadu sistēmu, 88 - arteriāla hipertensija un 84% - 2. tipa cukura diabēts. Pamatojoties uz pirmā pabeigtā pētījuma posma rezultātiem, tika konstatēts, ka sibutramīna ievadīšana izraisīja ievērojamu (p< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Rodas dabisks jautājums, kā šī vai cita veida antihipertensīvā terapija būs saistīta ar ārstēšanu ar sibutramīnu. Lai atbildētu uz šo jautājumu, ir veikti vairāki pētījumi. Piemēram, tika pierādīts, ka kombinētas zāļu formas, kas satur verapamilu 180 mg/trandolaprila 2 mg, lietošana kombinācijā ar 10 mg sibutramīna 6 mēnešu laikā izraisīja izteiktāku asinsspiediena pazemināšanos nekā tikai antihipertensīvā terapija – pazeminājās sistoliskais asinsspiediens, attiecīgi par 21,9 ± 8,1 pret 15,9 ± 12,3 mm Hg. Art. un diastoliskais - par 15,7 ± 8,1 pret 9,1 ± 9,9 mm Hg. Art. (p = 0,03). Kombinētā terapija izraisīja arī izteiktāku antropometrisko parametru uzlabošanos; uzticams (lpp<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
HOS (Hypertension-Obesity-Sibutramine) pētījums bija 16 nedēļas ilgs, perspektīvs, daudzcentru, placebo kontrolēts, dubultmaskēts pētījums, kurā salīdzināja dažādas antihipertensīvās shēmas (felodipīns 5 mg/ramiprils 5 mg (n = 57), verapamils 180 mg/ trandolaprils 2 mg (n = 55), metoprolola sukcināts 95 mg/hidrohlortiazīds 12,5 mg n = 59), ja tiek nozīmēts sibutramīns un placebo. Šis pētījums apstiprināja, ka sibutramīns var paaugstināt asinsspiedienu. Tādēļ, protams, pacientiem ar arteriālo hipertensiju sibutramīna lietošanas periodā ir nepieciešama adekvāta antihipertensīvā terapija. Tika arī pierādīts, ka, ārstējot ar β-blokatora un hidrohlortiazīda kombināciju, sibutramīna pozitīvā ietekme uz svara zudumu, vidukļa apkārtmēru un ietekmi uz vielmaiņas profilu bija ievērojami mazāk izteikta nekā kombinācijā ar AKE terapiju. inhibitori un kalcija antagonisti ar sibutramīnu. Tas vēlreiz apstiprina nepieciešamību rūpīgi izvēlēties antihipertensīvo terapiju pacientiem ar aptaukošanos, īpaši, veicot programmas, kuru mērķis ir svara zudums. Un noslēgumā jāatzīmē, ka no mūsu viedokļa viena no būtiskām problēmām, kas samazina aptaukošanās apkarošanas efektivitāti, ir tā, ka ne ārsti, ne iedzīvotāji aptaukošanos neuzskata par būtisku riska faktoru. Turklāt pacienti bieži sevi nenovērtē kā aptaukošanos. Piemēram, POLONESE pētījumā, pēc ārstu vērtējuma, pamatojoties uz ĶMI aprēķiniem, aptaukošanās gan vīriešiem, gan sievietēm tika reģistrēta trīs reizes biežāk nekā pēc pacientu pašnovērtējuma. Līdz ar to ir jāstiprina un jāveic iedzīvotāju informēšanas darbs par nepieciešamību novērst svara pieaugumu, koriģēt esošo aptaukošanos un pastāvīgas arteriālās hipertensijas ārstēšanas nozīmi. LITERATŪRA
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Aptaukošanās izplatība un tendences pieaugušo vidū ASV, 1999-2000. JAMA 2002; 288:1723-7.
2. Pi-Sunyer F.X. Centrālā tauku sadalījuma epidemioloģija saistībā ar slimībām. Nutr Rev 2004; 62(7): 120-6.
3. Arbeeny C.M. Neapmierināto medicīnisko vajadzību risināšana pēc drošas un efektīvas svara zaudēšanas terapijas. Obes Res 2004; 12(8): 1191-6.
4. Stamler J., Rose G., Stamler R. u.c. INTERSALT pētījuma rezultāti. Ietekme uz sabiedrības veselību un medicīnisko aprūpi. Hipertensija 1989; 14(5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Pārmērīgs svars un hipertensija gados vecākiem cilvēkiem – kopienas pētījuma rezultāti. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S. u.c. Intraabdominālo viscerālo tauku samazināšanās var samazināt asinsspiedienu sievietēm ar aptaukošanos un hipertensiju. Hipertensija 1996; 27(1): 125-9.
7. Puarē P., Džailss T.D., Brejs G.A. u.c. Amerikas Sirds asociācija; Uztura, fizisko aktivitāšu un vielmaiņas padomes aptaukošanās komiteja. Aptaukošanās un sirds un asinsvadu slimības: svara zaudēšanas patofizioloģija, novērtējums un ietekme: 1997. gada Amerikas Sirds asociācijas zinātniskā paziņojuma par aptaukošanos un sirds slimībām atjauninājums, ko sniedza Uztura, fizisko aktivitāšu un vielmaiņas padomes aptaukošanās komiteja. Tirāža 2006; 113:898-918.
8. Alpert M.A. Aptaukošanās kardiomiopātija; klīniskā sindroma patofizioloģija un evolūcija. Am J Med Sci 2001; 321: 225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hipertensija un aptaukošanās. Recent Progr Horm Res 2004; 59: 169-205.
10. Engeli S., Sharma A.M. Renīna-angiotenzīna sistēma un natriurētiskie peptīdi ar aptaukošanos saistītās hipertensijas gadījumā. J Mol Med 2001; 79: 21-9.
11. Lafontan M., Moro C., Sengenes C. u.c. Neparedzēta priekškambaru natriurētisko peptīdu vielmaiņas loma: lipolīzes, lipīdu mobilizācijas un sistēmisku neesterificētu taukskābju līmeņa kontrole cilvēkiem. Arterioscler Thromb Vasc Biol 2005; 25: 2032-42.
12. Zāle J.E. Nieres, hipertensija un aptaukošanās. Hipertensija 2003; 41(3): 625-33.
13. Kūpers R., Makfarleins Andersons N., Benets F. I. u.c. AKE, angiotensinogēns un aptaukošanās: potenciāls ceļš, kas noved pie hipertensijas. J Hum Hypertens 1997; 11: 107-11.
14. Lu N., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotenzīns II palielina tauku angiotenzinogēna ekspresiju. Am J Physiol Endocrinol Metab 2007; 292: 1280-7.
15. Engeli S., Negrel R., Sharma A.M. Taukaudu renīna-angiotenzīna sistēmas fizioloģija un patofizioloģija. Hipertensija 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. Tauku attīstība: no cilmes šūnām līdz adipocītiem. Crit Rev Biochem Mol Biol 2005; 40: 229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. Taukaudu disfunkcija aptaukošanās, diabēta un asinsvadu slimību gadījumā. Eur Sirds J 2008; 29: 2959-71.
18. Wannathee S. G., Lowe G. D., Rumley A. u.c. Adipokīni un 2. tipa diabēta risks gados vecākiem vīriešiem. Diabēts Core 2007; 30: 1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S. u.c. Plazmas insulīna, leptīna un šķīstošo TNF receptoru līmenis saistībā ar aptaukošanos saistītiem aterogēniem un trombogēniem sirds un asinsvadu slimību riska faktoriem vīriešiem. Aterosleroze 2001; 157: 495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Saistība starp adipocītu izmēru un adipokīnu ekspresiju un sekrēciju. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J, Hirano T, Fukui T u.c. Angiotenzīna II infūzija samazina adiponektīna līmeni plazmā, izmantojot tā 1. tipa receptorus žurkām: ietekme uz ar hipertensiju saistītu insulīna rezistenci. Metabolisms 2006; 55: 478-88.
22. Konsidīns R.V., Sinha M.K., Heimans M.L. u.c. Imūnreaktīvā-leptīna koncentrācija serumā normāla svara un aptaukošanās cilvēkiem. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr. u.c. Centrālās nervu sistēmas kontrole pār uzturu. Daba 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanokortīna neironi ir tiešie leptrīna mērķi hipotalāmā. Endokrinoloģija 1997; 138; 4489-92.
25. Long Y.C., Zierath J.R. AMP aktivētas proteīnkināzes signalizācija vielmaiņas regulēšanā. J Clin Invest 2006; 116: 1776-83.
26. Saladin R., De Vos P., Guerre-Millo M. u.c. Pārejošs aptaukošanās gēnu ekspresijas pieaugums pēc pārtikas uzņemšanas vai insulīna ievadīšanas. Daba 1995; 377:527-9.
27. Džans H.H., Kumars S., Bārnets A.H., Eggo M.C. Audzēja nekrozes faktoram-alfa ir divējāda ietekme uz cilvēka tauku leptīna sintēzi un izdalīšanos. Mol Cell Endokrinols 2000; 159: 79-88.
28. Lindsay R. S., Funahashi T., Hanson R. L. u.c. Adiponektīns un 2. tipa diabēta attīstība Pima Indijas populācijā. Lancets 2002; 360: 57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K. u.c. Zems adiponektīna līmenis plazmā ir saistīts ar zemu turpmāko kardiovaskulāro notikumu risku pacientiem ar klīniski acīmredzamu asinsvadu slimību. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D. u.c. Taukaudu angiotenzinogēns ir iesaistīts taukaudu augšanā un asinsspiediena regulēšanā. FASEB J 2001; 15: 2727-9.
31. Paul M., Mehr A.P., Kreutz R. Vietējo renīna-angiotenzīna sistēmu fizioloģija. Physiol Rev 2006; 86: 747-803.
32. Karlsson C., Lindell K., Ottosson M. u.c. Cilvēka taukaudi ekspresē angiotenzinogēnu un fermentus, kas nepieciešami tā pārvēršanai par angiotenzīnu II. J Clin Endocrinol Metab 1998; 83: 3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Cilvēka taukaudu renīna-angiotenzīna sistēmas hormonālā regulēšana: saistība ar aptaukošanos un hipertensiju. J Hipertensijas 2002; 20: 965-73.
34. Engeli S., Gorzelniak K., Kreutz R., et al. Renīna-angiotenzīna sistēmas gēnu līdzekspresija cilvēka taukaudos. J Hipertenss 1999; 17: 555-60.
35. Achard V., Boullu-Ciocca S., Desbrière R. u.c. Renīna receptoru ekspresija cilvēka taukaudos. Am J Physiol Regul Integr Comp Physiol 2007; 292: 274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Renīna-angiotenzīna sistēma, natriurētiskie peptīdi, aptaukošanās, metaboliskais sindroms un hipertensija: integrēts skatījums uz cilvēku. J Hipertensijas 2008; 26: 831-43.
37. Crandall D. L., Armellino D. C., Busler D. E. u.c. Angiotenzīna II receptori cilvēka preadipocītos: loma šūnu cikla regulēšanā. Endokrinoloģija 1999; 140: 154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G. u.c. Angiotenzīns II kā balto taukaudu trofiskais faktors: taukaudu šūnu veidošanās stimulēšana. Endokrinoloģija 2001; 142: 487-92.
39. Watanabe G., Lee R. J., Albanese C. u.c. Ciklin D1 atkarīgās kināzes aktivitātes angiotenzīna II aktivācija. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Preadipose šūnu diferenciācija: prostaciklīna parakrīnā loma, stimulējot taukaudu šūnas ar angiotenzīnu-II. Endokrinoloģija 1994; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotenzīns II palielina lipoģenēzi 3T3-L1 un cilvēka tauku šūnās. Endokrinoloģija 1997; 138: 1512-9.
42. Veik D.J., Vokers B.R. 1. tipa 11-beta-hidroksisteroīdu dehidrogenāzes inhibīcija aptaukošanās gadījumā. Endokrīnā 2006; 29: 101-8.
43. Engeli S., Bohnke J., Feldpausch M. u.c. 11beta-HSD gēnu regulēšana cilvēka taukaudos: centrālās aptaukošanās un svara zuduma ietekme. Obes Res 2004; 12:9-17.
44. Kim S., Whelan J., Claycombe K. u.c. Angiotenzīns II palielina leptīna sekrēciju ar 3T3-L1 un cilvēka adipocītiem, izmantojot no prostaglandīniem neatkarīgu mehānismu. J Nutr 2002; 132: 1135-40.
45. Cassis L.A., angļu V.L., Bharadwaj K., Boustany C.M. Vietējā un sistēmiskā angiotenzīna II atšķirīgā ietekme leptīna izdalīšanās regulēšanā no adipocītiem. Endokrinoloģija 2004; 145: 169-74.
46. Mancia G., Bousquet P., Elghozi J.L. u.c. Simpātiskā nervu sistēma un metaboliskais sindroms. J Hipertensijas 2007; 25: 909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Simpātiskās sistēmas aktivitāte aptaukošanās un metaboliskā sindroma gadījumā. Ann N Y Acad Sci 2006; 1083: 129-52.
48. Landsberg L., Troisi R., Parker D. u.c. Aptaukošanās, asinsspiediens un simpātiskā nervu sistēma. Ann Epidemiol 1991; 1: 295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Human adipose angiotensinogen gēnu ekspresiju un sekrēciju stimulē cikliskā AMP, palielinot DNS cikliskā AMP reaģējošo elementu saistīšanās aktivitāti. Endokrīnā 2004; 25: 97-104.
50. Cassis L.A. Angiotenzīna II loma brūnā tauku termoģenēzē aukstās aklimatizācijas laikā. Am J Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. Endogēnā angiotenzīna II neirotransmitera izdalīšanās presinaptiskā modulācija brūnajos taukaudos. J Neironu transmisija, 1991; 34: 129-37.
52. Reisin E., Weir M., Falkner B. u.c. Lizinoprils pret hidrohlortiazīdu pacientiem ar aptaukošanos ar hipertensiju: daudzcentru placebo kontrolēts pētījums. Ārstēšana aptaukošanās pacientiem ar hipertensiju (TROPHY) pētījuma grupa. Hipertensija 1997; 30(1): 2140-5.
53. Neutels J.M., Saunders E., Bakriss G.L. u.c. Irbesartāna/hidrohlortiazīda zemu un lielu devu fiksēto kombināciju efektivitāte un drošība pacientiem ar nekontrolētu sistolisko asinsspiedienu monoterapijas laikā: INCLUSIVE pētījums. Dž. Klins Hipertenss (Grīnviča) 2005. gads; 7(10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. IVF pētniecības grupas vārdā. Daudzcentru, randomizēts, atklāts pētījums par dzīvesveida izmaiņu un AKE inhibitoru (kvinaprila) terapijas efektivitāti pacientiem ar aptaukošanos ar arteriālo hipertensiju (IVF). Arteriālā hipertensija 2003; 9(6): 3-6.
55. Džeikobs S., Rets K., Henriksens E. Dž. Antihipertensīvā terapija un insulīna jutība: vai mums ir atkārtoti jādefinē beta blokatoru loma? Am J Hypertens 1998; 11(10): 1258-65.
56. Kaaja R, Kujala S, Manhem K u.c. Simpatolītiskās terapijas ietekme uz insulīna jutības rādītājiem hipertensīvām sievietēm pēcmenopauzes periodā. Int J Clin Pharmacol Ther 2007; 45(7): 394-401.
57. Kuperstein R., Sasson Z. Antihipertensīvās terapijas ietekme uz glikozes un insulīna metabolismu un kreisā kambara masu: randomizēts, dubultmaskēts, kontrolēts pētījums par 21 aptaukošanās hipertensijas slimnieku. Tirāža 2000; 102(15): 1802-6.
58. Halperins A.K., Cubeddu L.X. Kalcija kanālu blokatoru loma hipertensijas ārstēšanā. Am Heart J 1986; 111(2): 363-82.
59. Makalisters R.G. Jr. Lēnu kanālu bloķējošo līdzekļu klīniskā farmakoloģija. Prog Cardiovasc Dis 1982; 25(2): 83-102.
60. Binggeli C., Corti R., Sudano I. u.c. Hroniskas kalcija kanālu blokādes ietekme uz simpātisko nervu aktivitāti hipertensijas gadījumā. Hipertensija 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K. u.c. Dihidropiridīna un fenilalkilamīna kalcija antagonistu klašu ietekme uz autonomo funkciju hipertensijas gadījumā: VAMPHYRE pētījums. Am J Hipertensija 2001; 14(11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Atbilstības modeļi pacientiem, kuri ārstēti ar 2 atsevišķiem antihipertensīviem līdzekļiem, salīdzinot ar fiksētu devu kombinēto terapiju Am J Hypertens 2004; 175:223.
63. Dezii C.M. Retrospektīvs pētījums par noturību ar vienas tabletes kombinēto terapiju vs. vienlaicīga divu tablešu terapija pacientiem ar hipertensiju. Pārvaldīt aprūpi. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. Pieķeršanās modeļi pacientiem, kuri ārstēti ar fiksētu devu kombināciju, salīdzinot ar atsevišķiem antihipertensīviem līdzekļiem. Am J Health Syst Pharm 2007; 64(12): 1279-83.
65. Džeksons K. Fiksētas un brīvas kombinācijas ar valsartānu un HCTZ noturība pacientiem ar hipertensiju. Value Health Suppl 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Trandolaprila/verapamila kombinācijas kardiovaskulārie efekti pacientiem ar vieglu vai vidēji smagu esenciālo hipertensiju. Am J Cardiol 1997; 79(6): 826-8.
67. Reinoldss N.A., Vāgstafs A.J., Keams S.J. Trandolaprila/verapamila ilgstošā izdalīšanās: pārskats par tā lietošanu esenciālās hipertensijas ārstēšanā. Narkotikas 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Managing hipertensijas diabēta pacientiem - koncentrēties uz trandolaprila/verapamila kombinācija. Vasc Health Risk Manag 2007; 3(4): 453-65.
69. Bakriss G., Moličs M., Hjūkins A. u.c. Glikozes tolerances atšķirības starp fiksētu devu antihipertensīvo zāļu kombinācijām cilvēkiem ar metabolisko sindromu. Diabēta aprūpe 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q. u.c. Ar diurētiskiem līdzekļiem saistītās traucētas glikozes tolerances un jauna rašanās diabēta maiņa: STAR-LET pētījuma rezultāti. J Cardiometab sindroms 2008; 3(1): 18-25.
71. Bailey C.J., Day C. Jaunas farmakoloģiskās pieejas aptaukošanās novēršanai. Aptaukošanās prakse 2005; 1:2-5.
72. Yanovski S.Z., Yanovski J.A.Y. Aptaukošanās. N Engl J Med 2002; 346(8): 591-602.
73. Diena C, Beilija C.J. Sibutramīna atjauninājums. Br J Diabet Vasc Dis 2002; 2: 392-7.
74. James W.P., Astrup A., Finer N. u.c. Sibutramīna ietekme uz svara uzturēšanu pēc svara zaudēšanas: randomizēts pētījums. VĒTRAS studiju grupa. Sibutramīna izmēģinājums aptaukošanās samazināšanai un uzturēšanai. Lancets 2000; 356:2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W. u.c. Sirds un asinsvadu atbildes reakcija uz svara kontroli un sibutramīnu augsta riska subjektiem: SCOUT pētījuma analīze. Eur Sirds J 2007; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W. u.c. Asinsspiediena izmaiņas, kas saistītas ar sibutramīnu un svara pārvaldību – analīze no sibutramīna kardiovaskulāro iznākumu pētījuma (SCOUT) 6 nedēļu ievadperioda. Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N. u.c. Sibutramīna un verapamila ilgstošas darbības / trandolaprila kombinācijas ietekme uz asinsspiedienu un vielmaiņas mainīgajiem lielumiem pacientiem ar aptaukošanos un hipertensiju. Expert Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D. u.c. Optimāla ar aptaukošanos saistītas hipertensijas ārstēšana: hipertensijas-aptaukošanās-sibutramīna (HOS) pētījums. Tirāža 2007; 115(15): 1991-8.
79. Glezers M.G. Krievu pētījuma POLONESE (Efficacy and safety of enenen in patients with arterial hypertension) rezultāti. Terapeitiskais arhīvs 2006; 4: 44-50.
Lai saņemtu citātu: Leonova M.V. Jaunas un daudzsološas zāles, kas bloķē renīna-angiotenzīna-aldosterona sistēmu // Krūts vēzis. Medicīniskais apskats. 2013. 17.nr. 886. lpp
Renīna-angiotenzīna-aldosterona sistēmas (RAAS) loma arteriālās hipertensijas (AH) un citu sirds un asinsvadu slimību attīstībā pašlaik tiek uzskatīta par dominējošu. Sirds un asinsvadu kontinuumā hipertensija ir viens no riska faktoriem, un galvenais sirds un asinsvadu sistēmas bojājumu patofizioloģiskais mehānisms ir angiotenzīns II (ATII). ATII ir galvenā RAAS sastāvdaļa – efektors, kas īsteno vazokonstrikciju, nātrija aizturi, simpātiskās nervu sistēmas aktivizēšanu, šūnu proliferāciju un hipertrofiju, oksidatīvā stresa attīstību un asinsvadu sieniņu iekaisumu.
Šobrīd jau ir izstrādātas un klīniski plaši izmantotas divas zāļu klases, kas bloķē RAAS – AKE inhibitori un ATII receptoru blokatori. Šo klašu farmakoloģiskā un klīniskā iedarbība atšķiras. AKE ir peptidāze no cinka metaloproteināžu grupas, kas metabolizē ATI, AT1-7, bradikinīnu, vielu P un daudzus citus peptīdus. AKE inhibitoru darbības mehānisms galvenokārt ir saistīts ar ATII veidošanās novēršanu, kas veicina vazodilatāciju, natriurēzi un novērš ATII proinflammatorisko, proliferatīvo un citus efektus. Turklāt AKE inhibitori novērš bradikinīna noārdīšanos un paaugstina tā līmeni. Bradikinīns ir spēcīgs vazodilatators, tas pastiprina natriurēzi, un pats galvenais, tam ir kardioprotektīva iedarbība (novērš hipertrofiju, samazina miokarda išēmiskus bojājumus, uzlabo koronāro asins piegādi) un vazoprotektīva iedarbība, uzlabojot endotēlija darbību. Tajā pašā laikā augsts bradikinīna līmenis ir angioneirotiskās tūskas attīstības cēlonis, kas ir viens no nopietnajiem AKE inhibitoru trūkumiem, kas būtiski paaugstina kinīnu līmeni.
AKE inhibitori ne vienmēr spēj pilnībā bloķēt ATII veidošanos audos. Tagad ir noskaidrots, ka tās transformācijā audos var piedalīties arī citi ar AKE nesaistīti enzīmi, galvenokārt endopeptidāzes, ko AKE inhibitori neietekmē. Rezultātā AKE inhibitori nevar pilnībā novērst ATII ietekmi, kas var būt to neefektivitātes iemesls.
Šīs problēmas risinājumu veicināja ATII receptoru un pirmās klases zāļu atklāšana, kas selektīvi bloķē AT1 receptorus. Caur AT1 receptoriem tiek realizēta ATII nelabvēlīgā ietekme: vazokonstrikcija, aldosterona, vazopresīna, norepinefrīna sekrēcija, šķidruma aizture, gludo muskuļu šūnu un kardiomiocītu proliferācija, SAS aktivācija, kā arī negatīvās atgriezeniskās saites mehānisms - renīna veidošanās. . AT2 receptori veic “noderīgas” funkcijas, piemēram, vazodilatācijas, atjaunošanas un reģenerācijas procesus, antiproliferatīvu iedarbību, embrionālo audu diferenciāciju un attīstību. ATII receptoru blokatoru klīniskā iedarbība ir saistīta ar ATII “kaitīgās” ietekmes likvidēšanu AT1 receptoru līmenī, kas nodrošina pilnīgāku ATII nelabvēlīgās ietekmes bloķēšanu un ATII ietekmes uz AT2 receptoriem palielināšanos. , kas papildina vazodilatējošo un antiproliferatīvo iedarbību. ATII receptoru blokatoriem ir specifiska ietekme uz RAAS, neiejaucoties kinīna sistēmā. Ietekmes trūkums uz kinīna sistēmas darbību, no vienas puses, samazina nevēlamo blakusparādību smagumu (klepus, angioneirotiskā tūska), bet, no otras puses, atņem ATII receptoru blokatoriem nozīmīgu anti-išēmisku un vazoprotektīvu efektu, kas tos atšķir no AKE inhibitoriem. Šī iemesla dēļ indikācijas ATII receptoru blokatoru lietošanai pārsvarā atkārto AKE inhibitoru lietošanas indikācijas, padarot tās par alternatīvām zālēm.
Neskatoties uz RAAS blokatoru ieviešanu plaši izplatītā praksē hipertensijas ārstēšanā, joprojām pastāv problēmas ar rezultātu un prognozes uzlabošanu. Tie ietver: iespēju uzlabot iedzīvotāju asinsspiediena kontroli, rezistentas hipertensijas ārstēšanas efektivitāti un iespēju vēl vairāk samazināt sirds un asinsvadu slimību risku.
Turpinās aktīvi meklēt jaunus veidus, kā ietekmēt RAAS; Tiek pētītas citas cieši mijiedarbīgas sistēmas un tiek radīti medikamenti ar vairākiem darbības mehānismiem, piemēram, AKE un neitrālās endopeptidāzes (NEP) inhibitori, endotelīnu konvertējošā enzīma (ACE) un NEP inhibitori, AKE/NEP/EGT inhibitori.
Vasopeptidāzes inhibitori
Papildus labi zināmajam AKE vazopeptidāzes ietver divas citas cinka metaloproteināzes – neprilizīnu (neitrāla endopeptidāze, NEP) un endotelīnu konvertējošo enzīmu, kas var būt arī farmakoloģiskās iedarbības mērķi.
Neprilizīns ir enzīms, ko ražo asinsvadu endotēlijs un ir iesaistīts natriurētiskā peptīda, kā arī bradikinīna noārdīšanā.
Natriurētisko peptīdu sistēmu pārstāv trīs dažādas izoformas: priekškambaru natriurētiskais peptīds (A-tips), smadzeņu natriurētiskais peptīds (B-tips), kas tiek sintezēts ātrijā un miokardā, un endotēlija C-peptīds, kas savās bioloģiskajās funkcijās ir RAAS un endotelīna-1 endogēnie inhibitori (1. tabula). Natriurētiskā peptīda iedarbība uz sirdi un nierēm ietver asinsspiediena pazemināšanos, ietekmējot asinsvadu tonusu un ūdens-elektrolītu līdzsvaru, kā arī antiproliferatīvu un antifibrotisku iedarbību uz mērķa orgāniem. Jaunākie pierādījumi liecina, ka nātrijurētisko peptīdu sistēma ir iesaistīta vielmaiņas regulēšanā: lipīdu oksidācijā, adipocītu veidošanā un diferenciācijā, adiponektīna aktivācijā, insulīna sekrēcijā un ogļhidrātu tolerancē, kas var nodrošināt aizsardzību pret metaboliskā sindroma attīstību.
Tagad ir kļuvis zināms, ka sirds un asinsvadu slimību attīstība ir saistīta ar nātrijurētisko peptīdu sistēmas disregulāciju. Tādējādi hipertensijas gadījumā ir natriurētiskā peptīda deficīts, kas izraisa jutīgumu pret sāli un natriurēzes traucējumiem; hroniskas sirds mazspējas (CHF) gadījumā uz deficīta fona tiek novērota nātrijurētisko peptīdu sistēmas hormonu darbības traucējumi.
Tādēļ, lai pastiprinātu nātrijurētisko peptīdu sistēmu, lai panāktu papildu hipotensīvu un aizsargājošu kardiorenālo efektu, ir iespējams izmantot NEP inhibitorus. Neprilizīna inhibīcija pastiprina endogēnā natriurētiskā peptīda natriurētisko, diurētisko un vazodilatējošo iedarbību un rezultātā samazina asinsspiedienu. Tomēr NEP ir iesaistīts arī citu vazoaktīvo peptīdu, jo īpaši ATI, ATII un endotelīna-1, noārdīšanā. Tāpēc NEP inhibitoru ietekmes līdzsvars uz asinsvadu tonusu ir mainīgs un ir atkarīgs no konstriktora un paplašinošā efekta pārsvara. Ilgstoši lietojot, neprilizīna inhibitoru antihipertensīvā iedarbība ir vāja, jo tiek kompensēta ATII un endotelīna-1 veidošanās aktivācija.
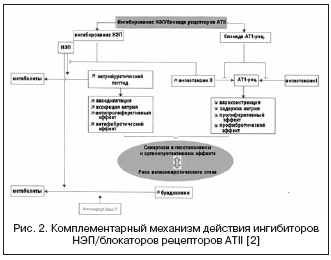
Šajā sakarā AKE inhibitoru un NEP inhibitoru iedarbības kombinācija var ievērojami pastiprināt hemodinamisko un antiproliferatīvo iedarbību, pateicoties papildu darbības mehānismam, kā rezultātā tika radītas zāles ar dubultu darbības mehānismu, ko kopā sauc par vazopeptidāzi. inhibitori (2. tabula, 1. att.).
Zināmiem vazopeptidāzes inhibitoriem ir raksturīga dažāda selektivitātes pakāpe pret NEP/ACE: omapatrilats - 8,9:0,5; fasidoprilāts - 5,1:9,8; Sampatrilat - 8,0:1,2. Rezultātā vazopeptidāzes inhibitori ir ieguvuši daudz lielāku potenciālu hipotensīvā efekta sasniegšanai neatkarīgi no RAAS aktivitātes un nātrija aiztures līmeņa, kā arī orgānu aizsardzībā (hipertrofijas regresija, albumīnūrija, asinsvadu stīvums). Klīniskajos pētījumos visvairāk pētītais bija omapatrilāts, kas uzrādīja augstāku antihipertensīvo efektivitāti salīdzinājumā ar AKE inhibitoriem, un pacientiem ar CHF palielinājās izsviedes frakcija un uzlabojās klīniskie rezultāti (IMPRESS, OVERTURE pētījumi), taču bez priekšrocībām salīdzinājumā ar AKE inhibitoriem.
Tomēr lielos klīniskos pētījumos, izmantojot omapatrilātu, tika konstatēts lielāks angioneirotiskās tūskas sastopamības biežums, salīdzinot ar AKE inhibitoriem. Ir zināms, ka angioneirotiskās tūskas sastopamība, lietojot AKE inhibitorus, svārstās no 0,1 līdz 0,5% iedzīvotāju, no kuriem 20% gadījumu ir dzīvībai bīstami, kas ir saistīts ar bradikinīna un tā metabolītu koncentrācijas daudzkārtēju palielināšanos. Lielā daudzcentru OCTAVE pētījuma (n = 25 302), kas bija īpaši izstrādāts, lai pētītu angioneirotiskās tūskas sastopamības biežumu, rezultāti parādīja, ka šīs blakusparādības biežums ārstēšanas ar omapatrilātu laikā pārsniedz enalaprila grupā — 2,17% pret 0,68% ( relatīvais risks 3.4) . Tas tika izskaidrots ar pastiprinātu ietekmi uz kinīna līmeni ar sinerģisku AKE un NEP inhibīciju, kas saistīta ar aminopeptidāzes P inhibīciju, kas ir iesaistīta bradikinīna noārdīšanā.
Jauns duālais vazopeptidāzes inhibitors, kas bloķē AKE/NEP, ir ilepatrils, kam ir augstāka afinitāte pret AKE, salīdzinot ar NEP. Pētot ilepatrila farmakodinamisko ietekmi uz RAAS un natriurētiskā peptīda aktivitāti veseliem brīvprātīgajiem, tika konstatēts, ka zāles atkarībā no devas (devās 5 un 25 mg) un būtiski (vairāk nekā 88%) nomāc AKE. asins plazmu ilgāk par 48 stundām, neatkarīgi no jutības pret sāli. Tajā pašā laikā zāles ievērojami palielināja plazmas renīna aktivitāti 48 stundu laikā un samazināja aldosterona līmeni. Šie rezultāti uzrādīja izteiktu un ilgstošu RAAS nomākšanu atšķirībā no AKE inhibitora ramiprila 10 mg devā, kas izskaidrojams ar nozīmīgāku ilepatrila ietekmi uz AKE un lielāku afinitāti pret AKE, kā arī salīdzināmu pakāpi. RAAS bloķēšanu, salīdzinot ar 150 mg irbesartāna + 10 mg ramiprila kombināciju. Atšķirībā no ietekmes uz RAAS, ilepatrila ietekme uz natriurētisko peptīdu izpaudās ar īslaicīgu tā izdalīšanās līmeņa paaugstināšanos 4-8 stundu laikā pēc 25 mg devas lietošanas, kas liecina par zemāku un vājāka afinitāte pret NEP un atšķir to no omapatrilata. Turklāt attiecībā uz elektrolītu izvadīšanas līmeni zālēm nav papildu natriurētiskas iedarbības salīdzinājumā ar ramiprilu vai irbesartānu, tāpat kā citiem vazopeptidāzes inhibitoriem. Maksimālā hipotensīvā iedarbība attīstās 6-12 stundas pēc zāļu lietošanas, un vidējā asinsspiediena pazemināšanās ir 5±5 un 10±4 mmHg. attiecīgi ar zemu un augstu sāls jutību. Saskaņā ar farmakokinētiskajām īpašībām ilepatrils ir priekšzāles ar aktīvu metabolītu, kas ātri veidojas, sasniedzot maksimālo koncentrāciju pēc 1-1,5 stundām un lēnām izdalās. Pašlaik notiek III fāzes klīniskie pētījumi.
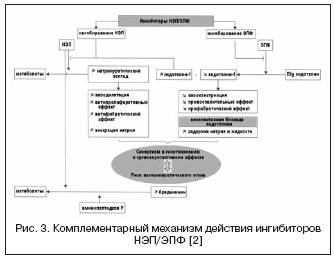
Alternatīvs ceļš uz RAAS un NEP dubultu nomākšanu ir ATII un NEP receptoru blokādes kombinācija (2. attēls). Atšķirībā no AKE inhibitoriem ATII receptoru blokatori neietekmē kinīnu metabolismu, un tāpēc tiem potenciāli ir mazāks angioneirotiskās tūskas komplikāciju attīstības risks. Pašlaik pirmās zāles, ATII receptoru blokators, kas inhibē NEP proporcijā 1: 1, LCZ696, tiek III fāzes klīniskajos pētījumos. Kombinētā zāļu molekula satur valsartānu un NEP inhibitoru (AHU377) priekšzāļu formā. Plašā pētījumā ar hipertensijas pacientiem (n=1328) LCZ696 200-400 mg devās uzrādīja hipotensīvās iedarbības priekšrocības salīdzinājumā ar valsartānu 160-320 mg devās, kas papildus pazemināja asinsspiedienu par 5 /3 un 6/3 mmHg . . LCZ696 hipotensīvo efektu pavadīja izteiktāks pulsa asinsspiediena pazemināšanās: par 2,25 un 3,32 mmHg. attiecīgi 200 un 400 mg devās, kas pašlaik tiek uzskatīts par pozitīvu prognostisku faktoru ietekmei uz asinsvadu sieniņu stīvumu un kardiovaskulārajiem rezultātiem. Tajā pašā laikā neirohumorālo biomarķieru pētījums, ārstējot ar LCZ696, parādīja natriurētiskā peptīda līmeņa paaugstināšanos ar salīdzināmu renīna un aldosterona līmeņa paaugstināšanos salīdzinājumā ar valsartānu. Pacientiem ar hipertensiju panesamība bija laba, un netika konstatēti angioneirotiskās tūskas gadījumi. PARAMOUMT pētījums tagad ir pabeigts, iesaistot 685 pacientus ar CHF un nebojātu EF. Pētījuma rezultāti parādīja, ka LCZ696 ātrāk un būtiskāk samazina NT-proBNP līmeni (primārais galapunkts ir natriurētiskā peptīda paaugstinātas aktivitātes un sliktas prognozes marķieris CHF gadījumā), salīdzinot ar valsartānu, kā arī samazina kreisās puses izmēru. ātrijs, kas norāda uz tā remodelācijas regresiju. Pašlaik tiek veikts pētījums ar pacientiem ar CHF un samazinātu EF (pētījums PARADIGM-HF).
Endotelīna sistēmas inhibitori
Endotelīna sistēmai ir svarīga loma asinsvadu tonusa un reģionālās asinsrites regulēšanā. No trim zināmajām izoformām endotelīns-1 ir visaktīvākais. Papildus zināmajai vazokonstriktora iedarbībai endotelīns stimulē starpšūnu matricas proliferāciju un sintēzi, kā arī, pateicoties tā tiešai ietekmei uz nieru asinsvadu tonusu, ir iesaistīts ūdens-elektrolītu homeostāzes regulēšanā. Endotelīna iedarbība tiek realizēta mijiedarbībā ar specifiskiem A un B tipa receptoriem, kuru funkcijas ir savstarpēji pretējas: caur A tipa receptoriem notiek vazokonstrikcija, bet caur B tipa receptoriem notiek vazodilatācija. Pēdējos gados ir konstatēts, ka endotelīna-1 klīrensā liela nozīme ir B tipa receptoriem, t.i. kad šie receptori tiek bloķēti, no receptoriem atkarīgais endotelīna-1 klīrenss tiek traucēts un tā koncentrācija palielinās. Turklāt B tipa receptori ir iesaistīti endotelīna-1 ietekmes uz nierēm regulēšanā un šķidruma un elektrolītu homeostāzes uzturēšanā, kas ir svarīgi.
Šobrīd ir pierādīta endotelīna loma vairāku slimību attīstībā, t.sk. hipertensija, CHF, plaušu hipertensija, hroniska nieru slimība; ir pierādīta cieša saistība starp endotelīna līmeni un metabolisko sindromu, endotēlija disfunkciju un ateroģenēzi. Kopš 1990. gadiem notiek klīniskai lietošanai piemērotu endotelīna receptoru antagonistu meklēšana; Jau ir zināmas 10 zāles (“sentāni”) ar dažādu selektivitātes pakāpi pret A/B tipa receptoriem. Pirmais neselektīvais endotelīna receptoru antagonists, bosentāns, klīniskā pētījumā ar pacientiem ar hipertensiju uzrādīja antihipertensīvo efektivitāti, kas ir salīdzināma ar AKE inhibitora enalaprila efektivitāti. Turpmākie pētījumi par endotelīna antagonistu lietošanas efektivitāti hipertensijas gadījumā parādīja to klīnisko nozīmi rezistentas hipertensijas un augsta kardiovaskulāra riska ārstēšanā. Šie dati tika iegūti no diviem lieliem klīniskiem pētījumiem, DORADO (n=379) un DORADO-AC (n=849), kuros darusentāns tika pievienots trīskāršai kombinētai terapijai pacientiem ar rezistentu hipertensiju. DORADO pētījumā pacientiem ar rezistentu hipertensiju kombinācijā ar hronisku nieru slimību un proteīnūriju darusentāna pievienošanas rezultātā tika novērota ne tikai būtiska asinsspiediena pazemināšanās, bet arī olbaltumvielu izdalīšanās samazināšanās. Endotelīna receptoru antagonistu antiproteīniskā iedarbība pēc tam tika apstiprināta pētījumā ar pacientiem ar diabētisku nefropātiju, lietojot avosentānu. Tomēr DORADO-AS pētījumā netika konstatētas nekādas priekšrocības papildu asinsspiediena pazemināšanai salīdzinājumā ar salīdzināmajām zālēm un placebo, kas bija iemesls turpmāko pētījumu pārtraukšanai. Turklāt 4 lieli pētījumi par endotelīna antagonistiem (bosentāns, darusentāns, enrasentāns) pacientiem ar CHF uzrādīja pretrunīgus rezultātus, kas tika skaidrots ar endotelīna-1 koncentrācijas palielināšanos. Turpmāka endotelīna receptoru antagonistu izpēte tika apturēta ar šķidruma aizturi saistītās negatīvās ietekmes dēļ (perifēra tūska, tilpuma pārslodze). Šo efektu attīstība ir saistīta ar endotelīna antagonistu iedarbību uz B tipa receptoriem, kas ir mainījis tādu zāļu meklēšanu, kas ietekmē endotelīna sistēmu pa citiem ceļiem; un endotelīna receptoru antagonistiem šobrīd ir tikai viena indikācija – pulmonālās hipertensijas ārstēšana.
Ņemot vērā endotelīna sistēmas lielo nozīmi asinsvadu tonusa regulēšanā, tiek meklēts cits darbības mehānisms caur vazopeptidāzi - EPF, kas ir iesaistīts aktīvā endotelīna-1 veidošanā (3. att.). AKE bloķēšana un apvienošana ar NEP inhibīciju var efektīvi nomākt endotelīna-1 veidošanos un pastiprināt natriurētiskā peptīda iedarbību. Duālā darbības mehānisma priekšrocības, no vienas puses, ir novērst NEP inhibitoru trūkumus, kas saistīti ar iespējamu vazokonstrikciju, ko izraisa endotelīna aktivācija, no otras puses, NEP inhibitoru natriurētiskā aktivitāte ļauj kompensēt šķidruma aizturi, kas saistīta ar endotelīna receptoru neselektīva bloķēšana. Daglutrils ir dubults NEP un AKE inhibitors, kas atrodas II fāzes klīniskajos pētījumos. Pētījumi ir parādījuši izteiktu zāļu kardioprotektīvo iedarbību sirds un asinsvadu remodelācijas samazināšanās, hipertrofijas un fibrozes regresijas dēļ.
Tiešie renīna inhibitori
Ir zināms, ka AKE inhibitori un ATII receptoru blokatori paaugstina renīna aktivitāti, izmantojot atgriezeniskās saites mehānismu, kas ir iemesls, kāpēc RAAS blokatoru efektivitāte izzūd. Renin ir pats pirmais RAAS kaskādes solis; to ražo nieru jukstaglomerulārās šūnas. Renīns ar angiotenzinogēna starpniecību veicina ATII veidošanos, vazokonstrikciju un aldosterona sekrēciju, kā arī regulē atgriezeniskās saites mehānismus. Tāpēc renīna inhibīcija ļauj mums panākt pilnīgāku RAAS sistēmas blokādi. Renīna inhibitoru meklēšana turpinās kopš 1970. gadiem; Ilgu laiku nebija iespējams iegūt perorālu renīna inhibitoru formu to zemās biopieejamības dēļ kuņģa-zarnu traktā (mazāk nekā 2%). Pirmais tiešais renīna inhibitors, kas piemērots iekšķīgai lietošanai, aliskirēns, tika reģistrēts 2007. gadā. Aliskirēnam ir zema biopieejamība (2,6%), ilgs pusperiods (24-40 stundas) un ekstrarenāls eliminācijas ceļš. Aliskirēna farmakodinamika ir saistīta ar ATII līmeņa pazemināšanos par 80%. Klīniskajos pētījumos pacientiem ar hipertensiju aliskirēns devās 150-300 mg/dienā izraisīja SBP pazemināšanos par 8,7-13 un 14,1-15,8 mmHg. attiecīgi un DBP - par 7,8-10,3 un 10,3-12,3 mm Hg. . Aliskirēna hipotensīvā iedarbība tika novērota dažādās pacientu apakšgrupās, tostarp pacientiem ar metabolisko sindromu, aptaukošanos; pēc smaguma pakāpes tā bija salīdzināma ar AKE inhibitoru, ATII receptoru blokatoru iedarbību, un tika novērota aditīva iedarbība arī kombinācijā ar valsartānu, hidrohlortiazīdu un amlodipīnu. Vairākos klīniskos pētījumos ir pierādīta zāļu organoprotektīvā iedarbība: antiproteīniskais efekts pacientiem ar diabētisko nefropātiju (AVOID pētījums, n=599), kreisā kambara hipertrofijas regresija pacientiem ar hipertensiju (ALLAY pētījums, n=465). Tādējādi pētījumā AVOID pēc 3 mēnešu ārstēšanas ar losartānu devā 100 mg/dienā un mērķa asinsspiediena līmeņa sasniegšanas (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Turklāt tiek veikta virkne klīnisko pētījumu par aliskirēnu citu sirds un asinsvadu slimību ārstēšanā, lai novērtētu ietekmi uz pacientu prognozi: ALOFT (n=320), ASTRONAUTS (n=1639), ATMOSFĒRA (n=7000). ) pētījumi pacientiem ar CHF, ALTITUDE pētījums pacientiem ar cukura diabētu un augstu kardiovaskulāro risku, ASPIRE pētījums pacientiem ar pēcinfarkta pārveidojumu.
Secinājums
Sirds un asinsvadu slimību profilakses problēmu risināšanai turpinās jaunu medikamentu radīšana ar sarežģītu daudzveidīgu darbības mehānismu, kas ļauj pilnīgāk bloķēt RAAS, izmantojot hemodinamisko un neirohumorālo regulēšanas mehānismu kaskādi. Šādu zāļu iespējamā iedarbība ļauj ne tikai nodrošināt papildu hipotensīvu efektu, bet arī panākt asinsspiediena kontroli augsta riska pacientiem, tostarp rezistentas hipertensijas gadījumā. Zāles ar vairākiem darbības mehānismiem demonstrē priekšrocības izteiktākā organoprotektīvā efektā, kas novērsīs turpmākus sirds un asinsvadu sistēmas bojājumus. Lai izpētītu jaunu RAAS bloķējošu zāļu ieguvumus, ir nepieciešama turpmāka izpēte un to ietekmes novērtējums uz hipertensijas un citu sirds un asinsvadu slimību pacientu prognozi.


Literatūra
1. Kempbels D.J. Vasopeptidāzes inhibīcija: abpusēji griezīgs zobens? // Hipertensija. 2003. sēj. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. Jaunas zāles, procedūras un ierīces hipertensijas ārstēšanai // Lancet. 2012. sēj. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. un citi. Vasopeptidāzes inhibitori: jauna terapeitiskā koncepcija sirds un asinsvadu slimībās? // Tirāža. 2001. sēj. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. un citi. Neitrāla endopeptidāzes inhibīcija un nātrijurētisko peptīdu sistēma: attīstoša stratēģija sirds un asinsvadu terapijā // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. un citi. Vasopeptidāzes inhibitora, omapatrilata un lizinoprila salīdzinājums ar slodzes toleranci un saslimstību pacientiem ar sirds mazspēju: IMPRESS randomizēts pētījums // Lancet. 2000. sēj. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. un citi. Omapatrilata un enalaprila salīdzinājums pacientiem ar hronisku sirds mazspēju: Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. sēj. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotenzīna II receptoru blokatori pacientiem ar AKE inhibitoru izraisītu angioedēmu // Ann. Pharmacother. 2000. sēj. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. un citi. Omapatrilats un enalaprils pacientiem ar hipertensiju: Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) pētījums // Am. J. Hipertenss. 2004. sēj. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Vazopeptidāzes inhibitora AVE7688 farmakokinētika un farmakodinamika cilvēkiem // Clin. Pharmacol. Tur. 2006. sēj. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. LCZ696, jauna divkāršas darbības angiotenzīna receptoru neprilizīna inhibitora (ARNi) farmakokinētika un farmakodinamika // J. Clin. Pharmacol. 2010. sēj. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Asinsspiediena samazināšana ar LCZ696, jaunu angiotenzīna II receptoru un neprilizīna divkāršas darbības inhibitoru: randomizēts, dubultmaskēts, placebo kontrolēts, aktīvs salīdzinājuma pētījums // Lancet. 2010. sēj. 375. P. 1255-1266.
12. Solomon S.D., Zīle M., Pieske B. et al. Angiotenzīna receptoru neprilizīna inhibitors LCZ696 sirds mazspējas gadījumā ar saglabātu izsviedes frakciju: 2. fāzes dubultmaskēts randomizēts kontrolēts pētījums // Lancet. 2012. sēj. 380(9851). P. 1387-1395.
13. Levins E.R. Endotelīni // N. Engl. J. Med. 1995. sēj. 333. lpp. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. un citi. Endotelīna-1 loma klīniskajā hipertensijā: 20 gadus pēc // Hipertensija. 2008. sēj. 52. P. 452-459.
15. Burnier M., Forni V. Endotelīna receptoru antagonisti: vieta esenciālās hipertensijas ārstēšanā? // Nefrols. Zvanīt. Transplantācija. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R. J., Lacourciere Y. et al. Endotelīna receptoru antagonista bosentāna ietekme uz asinsspiedienu pacientiem ar esenciālu hipertensiju. Bosentāna hipertensijas pētnieki // N. Engl. J. Med. 1998. sēj. 338. lpp. 784-790.
17. Vēbers M.A., Bleks H., Bakriss G. u.c. Selektīvs endotelīna receptoru antagonists asinsspiediena pazemināšanai pacientiem ar pret ārstēšanu rezistentu hipertensiju: randomizēts, dubultmaskēts, placebo kontrolēts pētījums // Lancet. 2009. sēj. 374. P. 1423-1431.
18. Bakris G.L., Lindholms L.H., Black H.R. un citi. Atšķirīgi rezultāti, izmantojot klīnikas un ambulatoro asinsspiedienu: ziņojums par daruzentāna rezistentu hipertensijas pētījumu // Hipertensija. 2010. sēj. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentāns atklātai diabētiskai nefropātijai // J. Am. Soc. Nefrols. 2010. sēj. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endotēlīnu konvertējošā enzīma / neitrālas endopeptidāzes inhibitors SLV338 novērš hipertensīvu sirds remodelāciju neatkarīgi no asinsspiediena // Hipertensija. 2011. sēj. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotenzīna II nomākums cilvēkiem ar teorētiski aktīvo renīna inhibitoru Aliskirenu (SPP100): salīdzinājums ar enalaprilu // Hipertensija. 2002. sēj. 39(1). P.E1-8.
22. Alreja G., Džozefs J. Renīns un sirds un asinsvadu slimības: nolietots ceļš vai jauns virziens? // Pasaule Dž. Kardiols. 2011. sēj. 3(3). 72-83 lpp.
23. Ingelfinger J.R. Aliskirēns un duālā terapija 2. tipa cukura diabēta gadījumā // N. Engl. J. Med. 2008. sēj. 358(23). P. 2503-2505.
24. Pouleur A.S., Uno H., Prescott M.F., Desai A. (ALLAY izmeklētājiem). Aldosterona nomākšana veicina kreisā kambara hipertrofijas regresiju pacientiem ar hipertensiju // J. Renīna-angiotenzīna-aldosterona sistēma. 2011. sēj. 12. P. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskirens, jauns renīna inhibitors, ir renoprotektīvs progresējošas diabētiskās nefropātijas modelī žurkām // Diabetol. 2007. sēj. 50. P. 2398-2404.


