Aldosteron je pri ljudeh glavni predstavnik mineralokortikoidnih hormonov, pridobljenih iz holesterola.
Sinteza
Izvaja se v glomerularni coni nadledvične skorje. Progesteron, ki nastane iz holesterola, je podvržen zaporedni oksidaciji na poti do aldosterona. 21-hidroksilaza, 11-hidroksilaza in 18-hidroksilaza. Na koncu nastane aldosteron.

Shema sinteze steroidnih hormonov (celotna shema)
Regulacija sinteze in izločanja
Aktiviraj:
- angiotenzin II sprošča med aktivacijo sistema renin-angiotenzin,
- povečana koncentracija kalijevi ioni v krvi (povezano z depolarizacijo membrane, odpiranjem kalcijevih kanalčkov in aktivacijo adenilat ciklaze).
Aktivacija renin-angiotenzinskega sistema
- Obstajata dve izhodiščni točki za aktiviranje tega sistema:
- zmanjšanje tlaka v aferentnih arteriolah ledvic, ki se določi baroreceptorji celice jukstaglomerularnega aparata. Razlog za to je lahko kakršna koli kršitev ledvičnega pretoka krvi - ateroskleroza. ledvične arterije, povečana viskoznost krvi, dehidracija, izguba krvi itd.
- zmanjšanje koncentracije Na + ionov v primarnem urinu v distalnih tubulih ledvic, ki ga določajo osmoreceptorji celic jukstaglomerularnega aparata. Pojavi se kot posledica diete brez soli, ob dolgotrajni uporabi diuretikov.
Izločanje renina (bazičnega) vzdržuje simpatični živčni sistem, stalno in neodvisno od ledvičnega krvnega pretoka.
- Pri izvajanju ene ali obeh postavk celice jukstaglomerularni aparat se aktivirajo in iz njih se encim izloči v krvno plazmo renin.
- V plazmi je substrat za renin - protein frakcije α2-globulina angiotenzinogen. Kot rezultat proteolize nastane dekapeptid, imenovan angiotenzin I. Nadalje, angiotenzin I s sodelovanjem angiotenzinska konvertaza(ACE) spremeni v angiotenzin II.
- Glavne tarče angiotenzina II so gladki miociti. krvne žile in glomerularni korteks nadledvične žleze:
- stimulacija krvnih žil povzroči njihov spazem in okrevanje krvni pritisk.
- po stimulaciji izločajo nadledvične žleze aldosteron ki delujejo na distalne tubule ledvic.
Ko so izpostavljeni aldosteronu, tubuli ledvic povečajo reabsorpcijo Na + ioni, po premikih natrija vodo. Posledično se ponovno vzpostavi tlak v krvnem obtoku in poveča koncentracija natrijevih ionov v krvni plazmi in s tem v primarnem urinu, kar zmanjša aktivnost RAAS.

Aktivacija sistema renin-angiotenzin-aldosteron
Mehanizem delovanja
citosolna.
Tarče in učinki
Vpliva žleze slinavke, na distalnih tubulih in zbiralnih kanalih ledvic. Krepi v ledvicah reabsorpcijo natrijevih ionov in izguba kalijevih ionov zaradi naslednjih učinkov:
- poveča količino Na +,K + -ATPaze za bazalna membrana epitelne celice,
- spodbuja sintezo mitohondrijskih proteinov in povečanje količine proizvedene energije v celici za delovanje Na +, K + -ATPaze,
- stimulira tvorbo Na-kanalčkov na apikalni membrani epitelijskih celic ledvic.
Patologija
hiperfunkcija
Connov sindrom (primarni aldosteronizem) - pojavi se pri adenomih glomerularne cone. Zanjo je značilna triada znakov: hipertenzija, hipernatremija, alkaloza.
Sekundarno hiperaldosteronizem – hiperplazija in hiperfunkcija jukstaglomerularnih celic ter čezmerno izločanje renina in angiotenzina II. Obstaja zvišanje krvnega tlaka in pojav edema.
Sistem renin-angiotenzin-aldosteron je kompleks encimov in hormonov, ki vzdržujejo homeostazo. Uravnava ravnovesje soli in vode v telesu ter raven krvnega tlaka.
Delovni mehanizem
Fiziologija sistema renin-angiotenzin-aldosteron izvira iz meje korteksa in tam, kjer so jukstaglomerularne celice, ki proizvajajo peptidazo (encim) - renin.
Renin je hormon in začetni člen RAAS.
Situacije, v katerih se renin sprosti v kri
Obstaja več pogojev, v katerih hormon vstopi v krvni obtok:
- Zmanjšan pretok krvi v ledvičnem tkivu - z vnetnimi procesi (glomerulonefritis itd.), z diabetična nefropatija, tumorji ledvic.
- Zmanjšanje (s krvavitvijo, ponavljajočim se bruhanjem, drisko, opeklinami).
- Padec krvnega tlaka. V arterijah ledvic so baroreceptorji, ki se odzivajo na spremembe sistemskega tlaka.
- Sprememba koncentracije natrijevih ionov. V človeškem telesu so kopičenja celic, ki se odzivajo na spremembe v ionski sestavi krvi s spodbujanjem proizvodnje renina. Sol se izgubi obilno znojenje pa tudi bruhanje.
- Stres, psiho-čustveni stres. Ledvice inervirajo simpatični živci, ki se aktivirajo ob negativnih psiholoških vplivih.
V krvi se renin sreča z beljakovino - angiotenzinogenom, ki ga proizvajajo jetrne celice in iz njega vzamejo delček. Nastane angiotenzin I, ki je vir delovanja angiotenzinske konvertaze (ACE). Rezultat je angiotenzin II, ki služi kot drugi člen in je močan vazokonstriktor. arterijski sistem(zožuje krvne žile).
Učinki angiotenzina II
Namen: povečati arterijski tlak.
- Spodbuja sintezo aldosterona v glomerularni coni nadledvične skorje.
- Vpliva na center za lakoto in žejo v možganih, kar povzroča apetit po "slani". Človeško vedenje postane motivirano za iskanje vode in slane hrane.
- Vpliva simpatični živci, ki spodbuja sproščanje norepinefrina, ki je prav tako vazokonstriktor, vendar deluje manj šibko.
- Vpliva na krvne žile in povzroča njihov krč.
- Sodeluje pri razvoju kroničnega srčnega popuščanja: spodbuja proliferacijo, vaskularno in miokardno fibrozo.
- Zmanjšuje
- Zavira nastajanje bradikinina.

Aldosteron je tretja komponenta, ki deluje na terminalne tubule ledvic in spodbuja izločanje kalijevih in magnezijevih ionov iz telesa ter reabsorpcijo (reabsorpcijo) natrija, klora in vode. Zaradi tega se poveča volumen krožeče tekočine, zvišajo se vrednosti krvnega tlaka in poveča pretok krvi skozi ledvice. Receptorji za aldosteron niso le v ledvicah, ampak tudi v srcu in krvnih žilah.
Ko telo doseže homeostazo, začnejo nastajati vazodilatatorji (snovi, ki širijo krvne žile) – bradikinin in kalidin. In komponente RAAS se uničijo v jetrih.
Shema sistema renin-angiotenzin-aldosteron

Kot vsak sistem lahko tudi RAAS odpove. Patofiziologija sistema renin-angiotenzin-aldosteron se kaže v naslednjih pogojih:
- Poškodba skorje nadledvične žleze (okužba, krvavitev in travma). Razvije se stanje pomanjkanja aldosterona, telo začne izgubljati natrij, klorid in vodo, kar vodi do zmanjšanja volumna krožeče tekočine in znižanja krvnega tlaka. Pogoj se kompenzira z uvodom solne raztopine in stimulansi aldosteronskih receptorjev.
- Tumor skorje nadledvične žleze povzroči presežek aldosterona, ki uresniči svoje učinke in poveča krvni tlak. Aktivirajo se tudi procesi delitve celic, pojavita se hipertrofija in fibroza miokarda, razvije se srčno popuščanje.
- Patologija jeter, ko je moteno uničenje aldosterona in pride do njegovega kopičenja. Patologijo zdravimo z zaviralci receptorjev aldosterona.
- Vnetne bolezni ledvic.

Pomen RAAS za življenje in medicino
Sistem renin-angiotenzin-aldosteron in njegova vloga v telesu:
- sprejme Aktivno sodelovanje pri vzdrževanju normalnega indikatorja krvnega tlaka;
- zagotavlja ravnovesje vode in soli v telesu;
- vzdržuje kislinsko-bazično ravnovesje krvi.
Sistem se lahko zruši. Z delovanjem na njegove sestavine se lahko borite proti hipertenziji. Mehanizem nastanka ledvične hipertenzije je prav tako tesno povezan z RAAS.
Zelo učinkovite skupine zdravil, ki so sintetizirane zahvaljujoč študiji RAAS
- "Prily". ACE. Angiotenzin I se ne pretvori v angiotenzin II. Brez vazokonstrikcije - brez zvišanja krvnega tlaka. Pripravki: Amprilan, Enalapril, Captopril itd. Zaviralci ACE bistveno izboljšajo kakovost življenja bolnikov s sladkorno boleznijo in preprečujejo odpoved ledvic. Zdravila se jemljejo v minimalnem odmerku, ki ne povzroči znižanja tlaka, ampak le izboljša lokalni pretok krvi in glomerularno filtracijo. Zdravila so nepogrešljiva pri odpovedi ledvic, kronična bolezen srca in služijo kot eno od sredstev za zdravljenje hipertenzije (če ni kontraindikacij).
- "Sartani". Zaviralci receptorjev angiotenzina II. Žile se nanj ne odzivajo in se ne krčijo. Zdravila: Losartan, Eprosartan itd.

Nasprotje renin-angiotenzin-aldosteronskega sistema je kininski sistem. Zato blokiranje RAAS povzroči povečanje krvnih komponent kininskega sistema (bradikinin itd.), Kar ugodno vpliva na tkiva srca in žilne stene. Miokard ne doživi stradanja, ker bradikinin poveča lokalni pretok krvi, spodbuja nastajanje naravnih vazodilatatorjev v celicah ledvične medule in mikrocitih zbiralnih kanalov - prostaglandinov E in I2. Nevtralizirajo presorsko delovanje angiotenzina II. Žile niso spazmodične, kar zagotavlja zadostno prekrvavitev organov in tkiv telesa, kri se ne zadržuje, zmanjša se nastajanje aterosklerotičnih plakov in krvnih strdkov. Kinini ugodno vplivajo na ledvice, povečajo diurezo (dnevno izločanje urina).
Renin
- encim, ki ga sintetizirajo jukstaglomerularne celice ledvičnih aferentnih arteriol, z MM približno 40 kDa. Zlasti intenzivna tvorba renina se pojavi med ishemijo ledvic. Zaradi lokalizacije jukstaglomerularnih celic so še posebej občutljive na spremembe krvnega tlaka, pa tudi na koncentracijo ionov Na + in K + v tekočini, ki teče skozi ledvične tubule. Zaradi teh lastnosti je vsaka kombinacija dejavnikov, ki povzroči zmanjšanje volumna tekočine (dehidracija, padec krvnega tlaka, izguba krvi itd.) ali zmanjšanje Koncentracija NaCl spodbuja sproščanje renina.
Hkrati deluje večina regulatorjev sinteze renina ledvičnih baroreceptorjih. Na sproščanje renina vpliva stanje centralnega živčnega sistema, pa tudi sprememba položaja telesa v prostoru. Zlasti pri prehodu iz ležečega v sedeči ali stoječi položaj (klinostatični test) se poveča izločanje renina. Ta refleksna reakcija je posledica povečanja tonusa simpatičnega dela avtonomnega živčnega sistema živčni sistem, ki prenaša impulze na b-adrenergične receptorje jukstaglomerularnih celic.
Glavni substrat, na katerega deluje renin, je angiotenzinogen- beljakovina, ki je del a 2-globulinske frakcije in jo tvorijo jetra. Pod vplivom glukokortikoidov in estrogenov se sinteza angiotenzinogena znatno poveča. Zaradi delovanja renina se angiotenzinogen pretvori v dekapeptid angiotenzinJAZ. Ta spojina ima izjemno šibek učinek in nima pomembnega vpliva na raven krvnega tlaka.
medtem angiotenzinjaz pod vplivom t.i angiotenzinska konvertaza (ACE) se spremeni v močan vazokonstriktorski faktor - angiotenzinII. ACE(dipeptidekarboksipeptidaza) je integralni protein, ki se nahaja predvsem na membrani endotelijskih celic, epiteliju, mononuklearnih celicah, živčnih končičih, celicah reproduktivnih organov itd. Topna oblika ACE je prisotna v skoraj vseh telesnih tekočinah.
Običajno ločimo dve izoformi ACE. Prvi od njih je dobil kodno ime "somatski". Ta izoforma ima MM 170 kDa in vključuje homologni domeni C in N. Druga oblika ACE ("reproduktivna") se nahaja v semenski tekočini, ima MM približno 100 kDa in ustreza C-domeni prve izooblike ACE. Vsaka od 2 navedenih domen vsebuje aminokislinske ostanke, ki lahko sodelujejo pri tvorbi vezi z atomom cinka. Takšne strukture Zn 2+ so značilne za številne metaloproteinaze in so glavna mesta encimske interakcije tako s substratom kot z zaviralci ACE.
Treba je opozoriti, da ACE ne vodi le do nastanka angiotenzin II, ampak tudi uničuje bradikinin - povezava, ki se širi krvne žile. Zato je zvišanje krvnega tlaka pod vplivom ACE povezano tako s tvorbo angiotenzina II kot z razpadom bradikinina (slika 32).
Pomembno vlogo pri delovanju ACE ima ionska sestava in zlasti vsebnost kloridnih ionov. Torej, pri visoki koncentraciji Cl - C-domena ACE hidrolizira bradikinin in angiotenzin-I hitreje kot N-domena. V zunajceličnih regijah, kjer je koncentracija kloridnih anionov visoka, je N-domena pretežno odgovorna za pretvorbo angiotenzina-I. Vendar znotrajcelično, kjer je koncentracija Cl nizka, lahko N-domena sodeluje pri hidrolizi drugih peptidnih snovi.
zadaj Zadnja leta ugotovljeno je bilo, da ima ACE pomembno vlogo pri hematopoezi, saj pod njegovim vplivom nastane hematopoetski peptid zaviranje tvorbe hematopoetskih celic v kostnem mozgu.
Vloga ACE v telesu je bila ugotovljena pri miših brez gena ACE. Pri takih živalih so opazili nizek krvni tlak, različne vaskularne disfunkcije, moteno strukturo in delovanje ledvic ter neplodnost samcev.
AngiotenzinII
zviša krvni tlak s povzročanjem zožitve arteriol in je najmočnejše znano vazoaktivno sredstvo. Poleg tega zavira tvorbo in sproščanje renina v jukstaglomerularnih celicah ledvic s povratnim mehanizmom, kar naj bi na koncu ponovno vzpostavilo normalne ravni krvnega tlaka. Pod vplivom angiotenzinII proizvodnja glavnega mineralokortikoida se močno poveča - aldosteron.Čeprav je to delovanje neposredno, angiotenzin II ne vpliva na proizvodnjo kortizola. Glavni namen aldosterona je zadrževanje Na + (s povečanjem njegove reabsorpcije v ledvičnih tubulih) in sproščanje K + in H + (predvsem skozi ledvice). Te reakcije potekajo na naslednji način.
Aldosteron
prodre iz zunajcelične tekočine v citoplazmo celice in se tam poveže s specifičnim receptorjem, nakar nastali kompleks (aldosteron + receptor) prodre v jedro. Aldosteron spodbuja tudi odpiranje Na + kanalov, zaradi česar Na + ioni vstopajo v celico skozi apikalno membrano iz lumna tubula.
Povečanje izločanja K + pod vplivom aldosterona je posledica povečanja prepustnosti apikalne membrane glede na te ione, zaradi česar K + vstopi iz celice v lumen tubula.
Zadrževanje Na + v telesu, tako kot angiotenzin II, prispeva k zvišanju krvnega tlaka.
AngiotenzinII se lahko veže na specifične receptorje na glomerularnih celicah nadledvične žleze. Vsebnost teh receptorjev je v veliki meri odvisna od koncentracije ionov K +. Torej, če se raven K + poveča, se poveča število receptorjev za angiotenzin II v glomerularnih celicah. Z zmanjšanjem koncentracije K + ionov opazimo nasprotni učinek. Zato imajo ioni K + glavno vlogo pri delovanju angiotenzina II na nadledvične žleze.
zadaj Zadnje čase določil, da angiotenzinII lahko aktivirajo makrofage, s čimer povečajo agregacijo trombocitov in pospešijo strjevanje krvi. Hkrati pa sprošča inhibitor aktivatorja plazminogen-jaz (IAP-1), ki ga lahko spremlja depresija fibrinolize. A ngiotenzinII je eden od dejavnikov, ki prispevajo k razvoju aterogeneze, zaviranju apoptoze in povečanemu oksidativnemu stresu v tkivih, s čimer izzovejo agregacijo trombocitov in trombozo.
AngiotenzinII je sposoben povečati delovanje miokarda, sodeluje pri biosintezi norepinefrina in drugih fiziološko aktivnih snovi. Hkrati lahko deluje kot rastni faktor, kar vodi v vaskularno in srčno hipertrofijo.
Nekatere živali in ljudje angiotenzinII pod vplivom encima aminopeptidaze pretvori v heptapeptid angiotenzinIII. Pri ljudeh je raven angiotenzina II približno 4-krat višja od ravni angiotenzina III. Obe spojini vplivata na krvni tlak in proizvodnjo aldosterona in ju encimi dokaj hitro razgradijo. angiotenzinaza.
Pri hudih boleznih ledvic, ki jih spremlja njihova ishemija, zaradi povečane tvorbe in izločanja renina opazimo vztrajno zvišanje krvnega tlaka ( ledvična hipertenzija). Uporaba zaviralcev ACE v teh pogojih vodi do hitre normalizacije krvnega tlaka.
Na koncu je treba še enkrat poudariti, da je sistem angiotenzin-renino-aldosteron tesno povezan z delovanjem sistema kalikrein-kinin, saj nastajanje angiotenzina II in uničenje bradikinina potekata pod vplivom istega. encim - ACE.
Catad_theme Arterijska hipertenzija- članki
Catad_tema Debelost - Članki
Debelost in arterijska hipertenzija
Objavljeno v reviji:PROBLEMI ZDRAVJA ŽENSK št. 4, letnik 3, 2008
E.I.Astaškin, M.G.Glezer
Moskovska medicinska akademija. I. M. Sechenov
POVZETEK
Pregled analizira vlogo debelosti pri razvoju arterijske hipertenzije in bolezni srca in ožilja, patofiziološki mehanizmi tega odnosa, prevladujoča vloga sistema renin-angiotenzin-aldosteron (RAAS). Obravnavana so vprašanja farmakološke korekcije visokega krvnega tlaka pri debelih bolnikih z uporabo fiksne kombinacije zaviralcev RAAS in verapamila. Prikazana je analiza učinkovitosti in varnosti uporabe sibutramina za hujšanje pri bolnikih z visokim krvnim tlakom.
Ključne besede: debelost, arterijska hipertenzija, zdravljenje.
POVZETEK
Avtorji so analizirali vlogo debelosti pri razvoju arterijske hipertenzije in srčno-žilnih bolezni, patofiziološke mehanizme te povezave in dominantno vlogo renin-angiotenzin-aldosteronskega sistema (RAAS). Dokazano je, da je farmakološka korekcija visokega krvnega tlaka pri bolnikih z debelostjo s fiksno kombinacijo zaviralcev RAAS in verapamila učinkovita. Prikazana je analiza učinkovitosti in varnosti sibutramina za hujšanje pri bolnikih z visokim krvnim tlakom.
ključne besede: debelost, arterijska hipertenzija, zdravljenje.
Pomen obravnavane teme je posledica dejstva, da se je v zadnjih letih po vsem svetu znatno povečalo število debelih ljudi. Debelost danes velja za enega glavnih dejavnikov, ki prispevajo k razvoju bolezni, ki so glavni vzroki v strukturi umrljivosti odraslega prebivalstva. Najprej pogovarjamo se o razvoju sladkorne bolezni tipa 2, pa tudi srčno-žilnih in onkološke bolezni. Povečanje telesne teže za 1 kg poveča tveganje za bolezni srca in ožilja za 3,1 % in sladkorno bolezen za 4,5-9 %.
Znano je, da je pri debelosti tveganje za nastanek arterijske hipertenzije – dejavnika, ki pomembno vpliva tudi na pojav srčno-žilnih bolezni, kot sta srčni infarkt in možganska kap – trikrat večje kot pri ljudeh z normalno telesno težo. Kot je razvidno iz študije INTERSALT, se za vsakih 4,5 kg povečanja telesne mase sistolični krvni tlak (KT) poveča za 4,5 mm Hg. Umetnost. .
Debelost kot dejavnik tveganja pri ženskah z arterijska hipertenzija, zlasti v starejših letih, je pogostejši kot pri moških. Eden od razlogov za to je hipoestrogenizem, ki se pojavi v obdobju po menopavzi. Opažene so nekatere značilnosti razširjenosti debelosti pri različnih vrstah arterijske hipertenzije. Torej pri starejših ženskah z izolirano sistolično hipertenzijo debelost ni tako pogosta in ni podatkov o vplivu izgube teže na to kategorijo bolnikov. Pri ženskah z abdominalno debelostjo, s sistolično-diastolično obliko arterijske hipertenzije je izguba teže pomembna točka pri obvladovanju bolezni.
Pri debelosti pride do številnih hemodinamskih sprememb, zlasti do povečanja volumna krvi v obtoku, utripnega volumna in minutnega volumna srca z relativno normalnim žilnim uporom. Menijo, da je visok krvni tlak pri debelih bolnikih predvsem posledica povečanega srčnega izliva z "neustrezno normalnim" perifernim uporom.
To hemodinamično stanje stimulira dva antagonistična regulatorna sistema, ki nadzorujeta volumen krvi in periferni upor- sistem renin-angiotenzin-aldosteron (RAAS) in sistem natriuretičnih peptidov srca. Njihova disregulacija lahko v veliki meri pojasni visok srčni utrip pri debelih hipertenzivnih bolnikih. Poleg tega so ti kardiovaskularni regulativni sistemi vključeni v presnovne spremembe, povezane s prekomerno telesno težo pri kardiovaskularnih boleznih.
Torej, pri debelosti v patogenezi arterijske hipertenzije igrajo pomembno vlogo trije glavni mehanizmi:
Patogeneza razvoja arterijske hipertenzije in bolezni srca in ožilja pri debelosti je shematsko prikazana na sliki 1.
Slika 1. Shema patogeneze arterijske hipertenzije in bolezni srca in ožilja pri debelosti
Sistemski in tkivni renin-angiotenzin-aldosteronski sistem in njegove spremembe pri debelosti
Sestava RAAS vključuje angiotenzinogen, renin, angiotenzin I, angiotenzin-konvertazo (ACE) in angiotenzin II (AT II). AT II ima raznolik učinek na različne celice, ki imajo specifične receptorje.
Po klasičnih konceptih se angiotenzinogen tvori v jetrih in pod vplivom renina, sintetiziranega v periglomerularnih celicah ledvic (jukstaglomerularne celice), se angiotenzinogen v krvi pretvori v angiotenzin I. ACE je odgovoren za razgradnjo AT I, kar povzroči nastanek AT II.
Pomembno je omeniti, da pri debelosti pride do kršitve mehanizmov regulacije RAAS. V fizioloških pogojih povečanje aktivnosti RAAS povzroči povečanje odpornosti perifernih žil in posledično zvišanje krvnega tlaka. Po načelu povratne informacije naj bi zvišanje krvnega tlaka povzročilo zmanjšanje izločanja renina, znižanje ravni AT II in zmanjšanje vsebnosti aldosterona. To pa zmanjša zastajanje tekočine in natrija ter vzdržuje krvni tlak na normalni ravni.
Vendar pa je pri bolnikih z visceralno debelostjo motena regulacija ravni komponent sistemskega obtoka RAAS. Kljub zvišanemu krvnemu tlaku, zadrževanju natrija in tekočine ter povečanju volumna cirkulirajoče krvi ostaneta aktivnosti renina in aldosterona v plazmi normalni ali celo rahlo povišani. Takšna disregulacija RAAS pri debelosti je lahko posledica povečane tvorbe komponent RAAS in/ali sekundarnega povečanja njihove koncentracije zaradi napak v sistemu natriuretičnih peptidov.
Ugotovljeno je bilo, da poleg krvnega RAAS obstaja še tkivni ali tako imenovani lokalni RAAS, ki so ga odkrili v številnih tkivih in organih, vključno z možgani, srcem, ožiljem, ledvicami, testisi, maščobnim tkivom itd. .
Kot je znano, imata pri nastanku AT II ključno vlogo dva dejavnika: aktivnost renina in koncentracija angiotenzinogena. Sinteza in izločanje angiotenzinogena v celicah drugačen tip ne le določa povečanje lokalne koncentracije AT II, ampak tudi poveča sistemsko aktivnost RAAS. Kronično infundiranje AT II mišim je spremljalo znatno povečanje vsebnosti mRNA angiotenzinogena v adipocitih. Ti rezultati kažejo na prisotnost pozitivne povratne informacije med AT II in angiotenzinogenom, ko povečanje ravni enega povzročitelja spodbudi nastanek drugega. Pri debelosti, zlasti visceralnega tipa, aktivnost renina v plazmi ostaja, kot že omenjeno, na normalni ali nekoliko povišana raven in ravni angiotenzinogena in AT II se povečajo.
Zgradba in fiziološke lastnosti maščobnega tkiva
Maščobno tkivo sestavljajo različne vrste celic, vključno z adipociti, makrofagi, fibroblasti, vaskularnimi endotelijskimi celicami in preadipociti (adipoblasti). Slednja vrsta celic izvira iz pluripotentnih matičnih celic mezoderma. Iz preadipocitov v telesu odraslega človeka nastanejo novi diferencirani (»majhni«) adipociti. Ti adipociti se povečajo ("veliki" adipociti) zaradi povečanega vnosa s hrano. maščobne kisline. Dolgoverižne maščobne kisline pridejo v adipocite iz krvi in se odložijo kot nevtralni triacilgliceroli. Maščobno tkivo je odgovorno za shranjevanje in izločanje dolgoverižnih maščobnih kislin, ki delujejo kot eden glavnih energijskih substratov za številne organe in tkiva, kot so srčne in skeletne mišice. "Veliki" adipociti izločajo bistveno več nasičenih maščobnih kislin. Hidroliza trigliceridov in sproščanje maščobnih kislin poteka pod vplivom intracelularne hormonsko občutljive lipaze, katere aktivnost nadzirajo kateholamini (pozitivna regulacija) in insulin (negativna regulacija).
Endokrina aktivnost maščobnega tkiva
Za razliko od podkožne maščobe, ki običajno predstavlja 75 % celotnega maščobnega tkiva v telesu in je glavno skladišče lipidov, se visceralna maščoba trenutno obravnava kot aktivno tkivo, ki proizvaja hormone.
Adipociti proizvajajo širok spekter hormoni in citokini, ki sodelujejo pri presnovi glukoze (adiponektin, rezistin itd.), lipidih (protein za prenos estra holesterola), vnetju (TNF-α, interlevkin-6), koagulaciji (zaviralec aktivatorja plazminogena-1), uravnavanju krvnega tlaka (angiotenzinogen, AT II), prehranjevalno vedenje(leptin), vpliva pa tudi na presnovo in funkcionalno aktivnost različnih organov in tkiv, vključno z mišicami, jetri, možgani in krvnimi žilami (glej tabelo).
Tabela. endokrina funkcija adipociti: adipocitokini
| Adipocitokini | Učinki adipocitokinov |
| Leptin | Absorpcija hrane, maščobna masa |
| Adiponektin | |
| resistin | Inzulinska rezistenca, vnetje |
| Visfatin | insulinska rezistenca |
| omentin | insulinska rezistenca |
| Serpin, sproščen iz maščobnega visceralnega tkiva (Vaspin) | insulinska rezistenca |
| Apelin | vazodilatacija |
| Protein za prenos estra holesterola (CETP) | metabolizem lipidov |
| Lipoproteinska lipaza (LPL) | metabolizem lipidov |
| Hormonsko občutljiva lipaza (HSL) | metabolizem lipidov |
| Maščobne kisline, ki vežejo beljakovine v adipocitih-4 (A-FABP-4 (aP2)) | metabolizem lipidov |
| Perlipin | metabolizem lipidov |
| Renitol binding protein (RBP) | metabolizem lipidov |
| Acilacija, ki spodbuja beljakovine (ASP) | metabolizem lipidov |
| Angiotenzin II (AT II) | Arterijski tlak |
| Angiotenzinska konvertaza (ACE) | Arterijski tlak |
| Angiotenzinogen (AGT) | Arterijski tlak |
| Faktor tumorske nekroze alfa (TNF-a) | Vnetje |
| Interlevkin, 6 (IL-6) | Vnetje |
| C-reaktivni protein (CRP) | Vnetje |
| Adipocitni tripsin/komplementni faktor D (Adipsin) | Vnetje |
| Makrofagni kemoatraktantni protein-1 (MCP-1) | Atraktant za makrofage |
| Medcelična adhezijska molekula-1 (ICAM-1) | Aktivacija makrofagov |
| Zaviralec aktivatorja plazminogena-1 (PAI-1) | fibrinoliza |
Pomembno je poudariti, da tudi majhno povečanje obsega visceralna maščoba ima pomembno vlogo pri presnovnih motnjah, uravnavanju ravnovesja vode in elektrolitov ter boleznih srca in ožilja.
S povečanjem mase maščobnega tkiva se poveča vsebnost skoraj vseh adipokinov v krvi. Izjema je adiponektin, katerega raven pod temi pogoji pade. Leptin in adiponektin sta trenutno najbolj raziskana adipokina.
Leptin. Proizvodnja leptina poteka predvsem v "velikih" adipocitih. Leptin se pogosto obravnava kot signalna molekula, ki posreduje v razmerju med vnosom hranil, maščobnim tkivom in centralnim živčnim sistemom (hipotalamus). Leptin poveča oksidacijo lipidov v jetrih ter lipolizo v adipocitih in skeletne mišice. Insulin spodbuja nastajanje leptina. Na ravni leptina vplivajo tudi proste maščobne kisline, TNF-α, estrogeni in rastni hormon.
Adiponektin. Nastajanje adiponektina poteka izključno v adipocitih. Adiponektin ima različne biološke učinke - deluje antiaterogeno, poveča občutljivost celic na inzulin, zavira sintezo glukoze v jetrih, pospeši njen transport do mišic in poveča oksidacijo maščobnih kislin. Raven adiponektina se zmanjša pri debelosti, insulinski rezistenci in sladkorni bolezni tipa 2.
Maščobno tkivo in aktivnost RAAS
Izkazalo se je, da je maščobno tkivo na drugem mestu po jetrih pri tvorbi angiotenzinogena. Na primer, količina mRNA angiotenzinogena v adipocitih je približno 70 % tiste v jetrih. Povezava med nivojem angiotenzinogena, debelostjo in arterijsko hipertenzijo je jasno prikazana v poskusih na modelu transgenih miši, ki izražajo čezmerne količine angiotenzinogena v maščobnem tkivu. Te miši imajo visceralno debelost in hipertenzijo. Preadipociti in diferencirani maščobne celice imajo celoten sklop komponent, potrebnih za lokalno sintezo AT II, kot tudi receptor AT 1 za AT II, ki zagotavlja znotrajcelični prenos aktivacijskih signalov, ki jih sproži AT II. Z debelostjo se volumen visceralnih diferenciranih adipocitov poveča za 20-30-krat. Za debelost je značilna disfunkcija adipocitov, kar razumemo kot povečanje tvorbe in izločanja različnih adipokinov, citokinov, kot tudi povečanje vsebnosti komponent RAAS, predvsem v visceralni maščobi.
Če povzamemo podatke različnih študij, lahko rečemo, da se z debelostjo poveča aktivnost RAAS, kar se odraža v naslednjih dejstvih:
visoka aktivnost RAAS pa vodi do povečanja mase maščobnega tkiva. Zlasti se je pokazalo, da transgene miši, ki prekomerno izražajo angiotenzinogen samo v maščobnih celicah, povečajo raven angiotenzinogena v krvi, razvijejo hipertenzijo in povečajo maso maščobnega tkiva. Tkivo AT II v bistvu deluje kot rastni faktor za adipocite. AT II z delovanjem na receptorje AT 1 povzroči povečanje proteina ciklina D 1, ki sodeluje pri regulaciji rasti in delitve maščobnih celic. Dokazano je, da AT II inducira prehod G 1 faze celični cikel v človeških preadipocitih. Ta učinek je bil povezan z učinkom na receptorje AT 1 in kasnejšo aktivacijo od ciklina D 1 odvisne kinaze.
Ugotovljeno je bilo, da AT II povzroči diferenciacijo preadipocitov, aktivira ključne encime tvorbe lipidov (lipogenezo) in poveča kopičenje trigliceridov v adipocitih.
Visceralno debelost spremlja povečana aktivnost 11-beta-hidroksisteroid dehidrogenaze tipa 1, kar povzroči nastanek kortizola, ključnega hormona pri diferenciaciji preadipocitov v adipocite.
Dejavnost tkivnega RAS je tesno povezana s proizvodnjo adipokinov v maščobnem tkivu. Na primer, pokazalo se je, da AT II inducira izražanje leptina v adipocitih. Predlagano je bilo, da je taka aktivnost značilna le za lokalno sintetiziran AT II, v nasprotju s sistemskim AT II.
Debelost in aktivnost simpatičnega živčnega sistema
Pri debelosti, zlasti pri njeni abdominalni različici, zelo pogosto opazimo aktivacijo simpatičnega živčnega sistema. Študija Normotesive Aging Study (NAS) je odkrila povečanje norepinefrina v urinu sorazmerno z indeksom telesne mase. S hujšanjem se aktivnost simpatičnega živčnega sistema zmanjša.
Povečana aktivnost simpatičnega živčnega sistema pri debelosti prispeva k prisotnosti hiperinzulinemije in insulinske rezistence. Insulin lahko sam po sebi poveča aktivnost simpatoadrenalnega sistema, vendar je to lahko delno posledica delovanja leptina. Znano je, da z večanjem stopnje debelosti na tešče narašča raven leptina, ki ga izločajo adipociti. Leptin poveča aktivnost simpatičnega živčnega sistema, zlasti v ledvicah. To po eni strani vodi do visokega izpusta in povečanja srčnega utripa, po drugi strani pa do povečanja reabsorpcije natrija in povečanja intravaskularnega volumna krvi.
Ugotovljena je bila prisotnost povezave med RAAS in simpatičnim živčnim sistemom. Povečano izločanje renina v ledvicah je povezano z aktivacijo simpatičnega živčnega sistema, kar se zgodi ne glede na intrarenalno senzorični sistem uravnavanje izločanja renina v ledvicah. Poleg tega povečanje cikličnega adenozin monofosfata pod vplivom kateholaminov stimulira izražanje angiotenzinogena v človeških adipocitih. Povečanje ravni AT II poveča aktivnost simpatičnega živčnega sistema pri ljudeh. Ugotovljeno je bilo, da AT II aktivira lokalni simpatični živčni sistem, ki sodeluje pri zvišanju telesne temperature (termogeneza). Hladno zdravljenje povzroči povečanje vsebnosti AT II v adipocitih brez sočasne spremembe ravni AT II v plazmi.
Tako lahko disregulacija RAAS pri debelosti stimulira tudi aktivnost simpatičnega živčnega sistema.
Metode farmakološke korekcije povišanega krvnega tlaka pri debelosti
Prispevek različnih patogenetskih mehanizmov k vzdrževanju visokega krvnega tlaka pri debelosti je lahko različen. Zato imajo lahko v tej situaciji antihipertenzivna zdravila z različnimi mehanizmi delovanja ugoden učinek.
V skladu z veljavnimi priporočili za zdravljenje arterijske hipertenzije je ključ do uspeha pomembnega znižanja krvnega tlaka uporaba kombiniranega zdravljenja. Za bolnike z debelostjo bi morale glavne sestavine takšne terapije najprej vsebovati kombinacijo zdravil, ki zmanjšujejo aktivnost RAAS (zaviralci ACE in sartani), zdravil, ki zmanjšujejo aktivnost simpatičnega živčnega sistema (β-blokatorji in nedihidropiridinski kalcijevi antagonisti) in diuretiki. Visoka učinkovitost Uporaba zdravil, ki blokirajo RAAS pri debelosti, je bila dokazana v številnih študijah. Glede uporabe zaviralcev β so si podatki zelo nasprotujoči, predvsem zaradi dvomov o njihovi uporabnosti za zdravljenje bolnikov z nezapleteno arterijsko hipertenzijo, drugič pa zaradi dejstva, da lahko zaviralci β, vsaj klasični, povečajo težo bolnikov in poveča odpornost proti insulinu. Če torej za zdravljenje bolnikov z debelostjo ali presnovnim sindromom izberemo zaviralce beta, potem morajo biti to zdravila s posebnimi lastnostmi, zlasti karvedilol in nebivolol.
Hkrati je bilo ugotovljeno, da lahko ne-dihidropiridinski kalcijev antagonist verapamil ne le znatno zniža krvni tlak, ampak tudi zmanjša aktivnost simpatičnega živčnega sistema.
Tako lahko v primeru debelosti za zdravljenje arterijske hipertenzije uporabimo kombinacijo zaviralcev RAAS in verapamila.
Treba je poudariti, da tovrstna kombinacija zdravila obstaja v obliki že pripravljene kombinacije dozirna oblika- zdravilo Tarka, ki vsebuje v maščobi topen zaviralec ACE - trandolapril in verapamil s počasnim sproščanjem (verapamil SR). Ta pristop je zelo pomemben za učinkovito terapijo, saj uporaba končnih farmacevtskih oblik izboljša adherenco bolnika pri zdravljenju.
Obstajajo dokazi, da Tarka znižuje krvni tlak v večji meri kot katera koli njegova sestavina, ima izrazito sposobnost zmanjšanja hipertrofije levega prekata, prispeva k normalizaciji endotelne funkcije in je presnovno nevtralen tudi pri bolnikih s sladkorno boleznijo.
dvojno delovanje- zmanjšanje aktivnosti RAAS pod vplivom trandolaprila in simpatičnega živčnega sistema zaradi podaljšanega delovanja verapamila - pomembno vpliva na patogeni mehanizmi razvoj arterijske hipertenzije pri debelosti in mehanizmi, ki izzovejo okvaro tarčnih organov pri tej vrsti hipertenzije.
Pri zdravljenju hipertenzije pri debelosti je treba posebno pozornost nameniti dejstvu, da lahko terapija, ki temelji na kombinaciji trandalaprila in dolgodelujočega verapamila, zmanjša tveganje za razvoj sladkorne bolezni v primerjavi z uporabo druge taktike zdravljenja - kombinacije sartana. z majhnim odmerkom tiazidnega diuretika. Rezultati študije STAR jasno kažejo, da se ob enoletni uporabi zdravila Tarka razvije manj ljudi s presnovnim sindromom, pri katerem ima abdominalna debelost prevladujočo vlogo. diabetes(slika 2).
Slika 2. Razvoj novih primerov sladkorne bolezni (glukoza na tešče > 126 mg/dl ali 2-urni test tolerance za glukozo > 200 mg/dl) glede na vrsto antihipertenzivne terapije pri ljudeh s presnovnim sindromom v študiji STAR

Poleg tega, glede na študijo STAR-LET, tudi če se diabetes mellitus pojavi v ozadju zdravljenje z zdravili prehod teh bolnikov na sprejem zdravila Tarka je omogočil normalizacijo polovice bolnikov presnova ogljikovih hidratov.
Zaradi rezultatov teh študij je treba ponovno razmisliti o priporočilih za zdravljenje z zdravili hipertenzijo pri osebah s presnovnim sindromom in uvesti zdravljenje s kombinacijo, ki vsebuje zaviralec ACE (ali sartan) in kalcijev antagonist, ali prevesti bolnike na takšno zdravljenje.
Kot je bilo že večkrat omenjeno, ima pri zdravljenju arterijske hipertenzije pomembno vlogo zmanjšanje telesne mase bolnikov in stopnje abdominalne debelosti. Seveda lahko hujšanje tako ali drugače pomembno vpliva na zmanjšanje pojavnosti srčno-žilnih bolezni. Trenutno obstajajo različni pristopi k zdravljenju debelosti z zdravili. Prvi je simptomatsko zdravljenje, in sicer zmanjšanje števila zaužitih kalorij z zmanjšanjem absorpcije maščobe iz hrane. Tak pristop lahko imenujemo kompenzacijski. Dejansko se s takšno terapijo bolezen ne odpravi (ker se bolnik še naprej prenajeda), ampak se z zdravilom le začasno kompenzira. Drug pristop k zdravljenju prekomerne telesne teže in debelosti je obravnava korena problema, namreč kroničnega prenajedanja. Tako deluje sibutramin (Meridiino zdravilo). Privede do hitrega nasičenja, zmanjša količino zaužite hrane z zaviranjem ponovnega privzema norepinefrina in serotonina v sinapsah nevronskih vezij. Danes je Meridia edina originalno zdravilo odprava vzroka debelosti.
Bistvena razlika med sibutraminom je, da ne povzroča zmanjšanja apetita, prispeva k zgodnejšemu pojavu občutka sitosti. Človek se znebi patološke navade prenajedanja, kar povzroči postopno in enakomerno zmanjšanje telesne teže. Pod vplivom sibutramina se vnos hrane zmanjša za približno 20%. Poleg tega sibutramin posredno vpliva na raven biogenih aminov v krvi, ki aktivirajo adrenoreceptorje v maščobnem tkivu in sprožijo lipolizo v adipocitih, kar spremlja sprememba vsebnosti energijskih substratov v krvi. Sibutramin zaradi aktivacije β2- in β3-adrenergičnih receptorjev izboljša procese termogeneze in poveča porabo energije v telesu.
Klinična učinkovitost in varnost sibutramina (Meridia) sta bili dokazani v v velikem številu multicentrične študije. Zlasti v študiji STORM (Sibutramine Trial on Obesity Reduction and Maintenance), ki je vključevala 605 debelih bolnikov, je bilo dokazano, da je dvoletno jemanje sibutramina zmanjšalo težo bolnikov za 3-krat, obseg pasu pa - 2-krat več. izrazitejši od placeba.. Pomembno je, da je 80 % bolnikov ohranilo svojo izgubo teže v dveh letih v primerjavi s 16 % bolnikov, ki so prejemali placebo (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов visoka gostota povečala za 21 % z znižanjem ravni lipoproteinov nizke gostote in trigliceridov.
Pozitiven učinek zmanjšanja telesne teže pri zdravljenju bolnikov z arterijsko hipertenzijo in drugimi srčno-žilnimi boleznimi je lahko tudi v tem, da lahko zmanjšanje intraabdominalne maščobe zmanjša mehansko stiskanje ledvic, kar lahko povzroči izboljšanje njihove prekrvavitve in zmanjšanje aktivnosti RAAS. Zmanjšanje maščobnega tkiva v ledvicah in okoli njih lahko povzroči zmanjšanje intersticijskega tlaka, stiskanje tankega dela Henleyeve zanke, povečanje pretoka krvi v vasa recta in zmanjšanje tubularne reabsorpcije Na + in vode. Tako lahko izguba teže, ki jo povzročijo metode korekcije brez zdravil ali zdravil, zmanjša višino krvnega tlaka.
Vendar do nedavnega v resnici klinična praksa sibutramin so uporabljali previdno, saj so se bali njegove možne negativen vpliv na krvni tlak in srčni utrip, kar bi lahko povzročilo, čeprav pri majhnem številu bolnikov, neprijetne subjektivni občutki. Da bi preučili učinek sibutramina na srčno-žilni sistem in dokazali varnost zdravila pri skupini bolnikov s povečanim tveganjem za srčno-žilne bolezni, je bila izvedena obsežna multicentrična, dvojno slepa, s placebom kontrolirana mednarodna študija SCOUT (Sibutramine Cardiovascular). OUTcomes), kjer je bilo opazovanih 10.742 bolnikov, od katerih jih je 97 % imelo bolezni srčno-žilnega sistema, 88 - arterijska hipertenzija in 84% - diabetes mellitus tipa 2. Glede na rezultate prve zaključene faze študije je bilo ugotovljeno, da je imenovanje sibutramina povzročilo pomembno (p< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Postavlja se naravno vprašanje, kako bo ta ali ona vrsta antihipertenzivne terapije povezana z zdravljenjem s sibutraminom. Za odgovor na to vprašanje je bilo izvedenih več študij. Na primer, pokazalo se je, da je uporaba kombinirane dozirne oblike, ki vsebuje verapamil 180 mg / trandolapril 2 mg v kombinaciji s sibutraminom 10 mg, povzročila bolj izrazito znižanje krvnega tlaka v 6 mesecih kot samo antihipertenzivno zdravljenje - sistolični krvni tlak se je znižal, za 21,9 ± 8,1 v primerjavi s 15,9 ± 12,3 mm Hg. Umetnost. in diastolični - za 15,7 ± 8,1 v primerjavi z 9,1 ± 9,9 mm Hg. Umetnost. (p = 0,03). Kombinirano zdravljenje je privedlo tudi do izrazitejšega izboljšanja antropometričnih parametrov; zanesljiv (str<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
V prospektivni, multicentrični, s placebom nadzorovani, dvojno slepi študiji HOS (Hypertension-Obesity-Sibutramine) za 16 tednov so primerjali učinkovitost različnih antihipertenzivnih režimov (felodipin 5 mg / ramipril 5 mg (n = 57) , verapamil 180 mg / dan).trandolapril 2 mg (n = 55), metoprololijev sukcinat 95 mg/hidroklorotiazid 12,5 mg n = 59) s sibutraminom in placebom. V tej študiji je bilo potrjeno, da lahko sibutramin zviša krvni tlak. Zato je seveda potrebno ustrezno izvajati antihipertenzivno terapijo v času uporabe sibutramina pri bolnikih z arterijsko hipertenzijo. Pokazalo se je tudi, da so bili pri zdravljenju s kombinacijo zaviralca β in hidroklorotiazida pozitivni učinki sibutramina na zmanjšanje telesne mase, obseg pasu in vpliv na presnovni profil bistveno manj izraziti kot pri kombinaciji kombiniranega zdravljenja z ACE. zaviralci in kalcijevi antagonisti s sibutraminom. To še enkrat potrjuje potrebo po skrbni izbiri antihipertenzivne terapije pri bolnikih z debelostjo, zlasti pri izvajanju programov za zmanjšanje telesne mase. Za zaključek je treba poudariti, da je z našega vidika eden od pomembnih problemov, ki zmanjšujejo učinkovitost boja proti debelosti, ta, da niti zdravniki niti javnost debelosti ne obravnavajo kot pomembnega dejavnika tveganja. Poleg tega se bolniki pogosto ne ocenjujejo kot debeli. Na primer, v raziskavi POLONEZ je bila po oceni zdravnikov na podlagi BMI debelost tako pri moških kot pri ženskah zabeležena trikrat pogosteje kot pri samooceni bolnikov. Zato je treba okrepiti in izvajati pojasnjevalno delo med prebivalstvom o potrebi po preprečevanju povečanja telesne teže, korekciji obstoječe debelosti in pomenu kontinuiranega zdravljenja arterijske hipertenzije. LITERATURA
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Razširjenost in trendi debelosti med odraslimi v ZDA, 1999-2000. JAMA 2002; 288:1723-7.
2. Pi-Sunyer F.X. Epidemiologija centralne porazdelitve maščobe v povezavi z boleznijo. Nutr Rev 2004; 62 (7): 120-6.
3. Arbeeny C.M. Obravnava neizpolnjene medicinske potrebe po varnih in učinkovitih terapijah hujšanja. Obes Res 2004; 12 (8): 1191-6.
4. Stamler J., Rose G., Stamler R., et al. Ugotovitve študije INTERSALT. Posledice javnega zdravja in zdravstvene oskrbe. Hipertenzija 1989; 14 (5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Prekomerna teža in hipertenzija pri starejših - rezultati skupnostne študije. Arch Gerontol Geriatr 1991; 13 (1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et al. Zmanjšanje intraabdominalne visceralne maščobe lahko zniža krvni tlak pri debelih ženskah s hipertenzijo. Hipertenzija 1996; 27 (1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et al. Ameriško združenje za srce; Odbor za debelost Sveta za prehrano, telesno dejavnost in presnovo. Debelost in kardiovaskularne bolezni: patofiziologija, ocena in učinek izgube teže: posodobitev znanstvene izjave Ameriškega združenja za srce iz leta 1997 o debelosti in boleznih srca Odbora za debelost Sveta za prehrano, telesno dejavnost in presnovo. Naklada 2006; 113: 898-918.
8 Alpert M.A. Kardiomiopatija zaradi debelosti; patofiziologija in razvoj kliničnega sindroma. Am J Med Sci 2001; 321:225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hipertenzija in debelost. Nedavni Progr Horm Res 2004; 59: 169-205.
10. Engeli S., Sharma A.M. Sistem renin-angiotenzin in natriuretični peptidi pri hipertenziji, povezani z debelostjo. J Mol Med 2001; 79:21-9.
11. Lafontan M., Moro C., Sengenes C., et al. Neslutena presnovna vloga atrijskih natriuretičnih peptidov: nadzor lipolize, mobilizacije lipidov in ravni sistemskih neesterificiranih maščobnih kislin pri ljudeh. Arterioscler Thromb Vasc Biol 2005; 25:2032-42.
12. Hall J.E. Ledvice, hipertenzija in debelost. Hipertenzija 2003; 41 (3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et al. ACE, angiotenzinogen in debelost: možna pot do hipertenzije. J Hum Hypertens 1997; 11:107-11.
14. Lu H., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotenzin II poveča izražanje angiotenzinogena v maščobnem tkivu. Am J Physiol Endocrinol Metab 2007; 292:1280-7.
15. Engeli S., Negrel R., Sharma A.M. Fiziologija in patofiziologija renin-angiotenzinskega sistema maščobnega tkiva. Hipertenzija 2000; 35 (6): 1270-7.
16. Otto T.C., Lane M.D. Razvoj maščobe: od izvorne celice do adipocita. Crit Rev Biochem Mol Biol 2005; 40:229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. Disfunkcija maščobnega tkiva pri debelosti, sladkorni bolezni in žilnih boleznih. Eur Heart J 2008; 29:2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A. et al. Adipokini in tveganje za sladkorno bolezen tipa 2 pri starejših moških. Diabetes Core 2007; 30:1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et al. Ravni plazemskega insulina, leptina in topnega receptorja TNF v povezavi z dejavniki tveganja za aterogene in trombogene srčno-žilne bolezni pri moških, povezanih z debelostjo. Aterosleroza 2001; 157:495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Razmerje med velikostjo adipocitov ter izražanjem in izločanjem adipokinov. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T., Fukui T., et al. Infuzija angiotenzina II zmanjša raven adiponektina v plazmi prek njegovega receptorja tipa 1 pri podganah: posledica za insulinsko rezistenco, povezano s hipertenzijo. Metabolizem 2006; 55:478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et al. Koncentracija imunoreaktivnega leptina v serumu pri ljudeh z normalno težo in debelostjo. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et al. Centralni živčni sistem nadzoruje vnos hrane. Narava 2000; 404 (6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanokortinski nevroni so neposredne tarče za leptrin v hipotalamusu. Endokrinologija 1997; 138; 4489-92.
25 Long Y.C., Zierath J.R. AMP-aktivirano signaliziranje proteinske kinaze pri presnovni regulaciji. J Clin Invest 2006; 116:1776-83.
26. Saladin R., De Vos P., Guerre-Millo M. et al. Prehodno povečanje izražanja genov za debelost po hrani ali dajanju insulina. Narava 1995; 377:527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Faktor tumorske nekroze alfa ima dvojne učinke na sintezo in sproščanje leptina v maščobnem tkivu. Mol Cell Endocrinol 2000; 159: 79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., et al. Adiponektin in razvoj sladkorne bolezni tipa 2 pri indijski populaciji Pima. Lancet 2002; 360:57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et al. Nizke ravni adiponektina v plazmi so povezane z majhnim tveganjem za prihodnje srčno-žilne dogodke pri bolnikih s klinično očitno žilno boleznijo. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D. et al. Adipozni angiotenzinogen sodeluje pri rasti maščobnega tkiva in uravnavanju krvnega tlaka. FASEB J 2001; 15:2727-9.
31. Paul M., Mehr A.P., Kreutz R. Fiziologija lokalnih sistemov renin-angiotenzin. Physiol Rev 2006; 86:747-803.
32. Karlsson C., Lindell K., Ottosson M. et al. Človeško maščobno tkivo izraža angiotenzinogen in encime, potrebne za njegovo pretvorbo v angiotenzin II. J Clin Endocrinol Metab 1998; 83:3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Hormonska regulacija renin-angiotenzinskega sistema človeškega maščobnega tkiva: odnos do debelosti in hipertenzije. J Hypertens 2002; 20:965-73.
34. Engeli S., Gorzelniak K., Kreutz R., et al. Sočasno izražanje genov sistema renin-angiotenzin v človeškem maščobnem tkivu. J Hypertens 1999; 17:555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., et al. Ekspresija reninskega receptorja v človeškem maščobnem tkivu. Am J Physiol Regul Integr Comp Physiol 2007; 292:274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Sistem renin-angiotenzin, natriuretični peptidi, debelost, presnovni sindrom in hipertenzija: celovit pogled pri ljudeh. J Hypertens 2008; 26:831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et al. Receptorji angiotenzina II v človeških preadipocitih: vloga pri regulaciji celičnega cikla. Endokrinologija 1999; 140:154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G., et al. Angiotenzin II kot trofični dejavnik belega maščobnega tkiva: stimulacija nastajanja maščobnih celic. Endokrinologija 2001; 142:487-92.
39. Watanabe G., Lee R.J., Albanese C. et al. Aktivacija angiotenzina II aktivnosti kinaze, odvisne od ciklina D1. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Diferenciacija preadipoznih celic: parakrina vloga prostaciklina pri stimulaciji maščobnih celic z angiotenzinom-II. Endokrinologija 1994; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotenzin II poveča lipogenezo v 3T3-L1 in človeških maščobnih celicah. Endokrinologija 1997; 138:1512-9.
42. Wake D.J., Walker B.R. Inhibicija 11beta-hidroksisteroid dehidrogenaze tipa 1 pri debelosti. Endokrine 2006; 29:101-8.
43. Engeli S., Bohnke J., Feldpausch M., et al. Regulacija genov 11beta-HSD v človeškem maščobnem tkivu: vpliv centralne debelosti in izgube teže. Obes Res 2004; 12:9–17.
44. Kim S., Whelan J., Claycombe K., et al. Angiotenzin II poveča izločanje leptina s 3T3-L1 in človeškimi adipociti prek od prostaglandina neodvisnega mehanizma. J Nutr 2002; 132:1135-40.
45. Cassis L.A., angleški V.L., Bharadwaj K., Boustany C.M. Različni učinki lokalnega in sistemskega angiotenzina II pri uravnavanju sproščanja leptina iz adipocitov. Endokrinologija 2004; 145:169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et al. Simpatični živčni sistem in metabolični sindrom. J Hypertens 2007; 25:909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Aktivnost simpatičnega sistema pri debelosti in presnovnem sindromu. Ann N Y Acad Sci 2006; 1083:129-52.
48. Landsberg L., Troisi R., Parker D., et al. Debelost, krvni tlak in simpatični živčni sistem. Ann Epidemiol 1991; 1:295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Izražanje in izločanje genov za človeški maščobni angiotenzinogen stimulira ciklični AMP preko povečane aktivnosti vezave elementa, odzivnega na ciklični AMP DNA. Endokrine 2004; 25:97-104.
50. Cassis L.A. Vloga angiotenzina II pri termogenezi rjave maščobe med prilagajanjem na mraz. Am J Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. Presinaptična modulacija sproščanja nevrotransmiterjev z endogenim angiotenzinom II v rjavem maščobnem tkivu. J Neural Transm 1991; 34:129-37.
52. Reisin E., Weir M., Falkner B. et al. Lizinopril v primerjavi s hidroklorotiazidom pri debelih hipertenzivnih bolnikih: multicentrično s placebom nadzorovano preskušanje. Študijska skupina za zdravljenje debelih bolnikov s hipertenzijo (TROPHY). Hipertenzija 1997; 30 (1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., et al. Učinkovitost in varnost nizkih in visokih odmerkov fiksnih kombinacij irbesartana/hidroklorotiazida pri bolnikih z nenadzorovanim sistoličnim krvnim tlakom pri monoterapiji: preskušanje INCLUSIVE. J Clin Hypertens (Greenwich) 2005; 7 (10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. v imenu raziskovalne skupine "ECO". Multicentrična, randomizirana, odprta študija o učinkovitosti sprememb življenjskega sloga in zdravljenja z zaviralci ACE (kvinapril) pri debelih bolnikih z arterijsko hipertenzijo (IVF). Arterijska hipertenzija 2003; 9 (6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Antihipertenzivna terapija in občutljivost na insulin: ali moramo ponovno opredeliti vlogo zaviralcev beta? Am J Hypertens 1998; 11 (10): 1258-65.
56. Kaaja R., Kujala S., Manhem K., et al. Učinki simpatikolitične terapije na indekse občutljivosti na insulin pri hipertenzivnih ženskah po menopavzi. Int J Clin Pharmacol Ther 2007; 45 (7): 394-401.
57. Kuperstein R., Sasson Z. Učinki antihipertenzivne terapije na presnovo glukoze in inzulina ter na maso levega prekata: randomizirana, dvojno slepa, kontrolirana študija 21 debelih hipertonikov. Naklada 2000; 102 (15): 1802-6.
58. Halperin A.K., Cubeddu L.X. Vloga zaviralcev kalcijevih kanalčkov pri zdravljenju hipertenzije. Am Heart J 1986; 111 (2): 363-82.
59. McAllister R.G. Jr. Klinična farmakologija zaviralcev počasnih kanalčkov. Prog Cardiovasc Dis 1982; 25 (2): 83-102.
60. Binggeli C., Corti R., Sudano I., et al. Učinki kronične blokade kalcijevih kanalčkov na aktivnost simpatičnega živca pri hipertenziji. Hipertenzija 2002; 39 (4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K., et al. Učinki razredov antagonistov kalcija dihidropiridina in fenilalkilamina na avtonomno funkcijo pri hipertenziji: študija VAMPHYRE. Am J Hypertens 2001; 14 (11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino PP, Shoheiber O. Vzorci skladnosti bolnikov, zdravljenih z 2 ločenima antihipertenzivoma, v primerjavi s kombinirano terapijo s fiksnimi odmerki Am J Hypertens 2004; 175:223.
63. Dezii C.M. Retrospektivna študija vztrajnosti pri kombiniranem zdravljenju z eno tableto v primerjavi z. sočasno zdravljenje z dvema tabletama pri bolnikih s hipertenzijo. Management Care. 2000; 9 (9): 2-6.
64. Gerbino P.P., Shoheiber O. Vzorci adherence med bolniki, zdravljenimi s kombinacijo fiksnih odmerkov, v primerjavi z ločenimi antihipertenzivi. Am J Health Syst Pharm 2007; 64 (12): 1279-83.
65. Jackson K. Vztrajnost fiksne proti prosti kombinaciji z valsartanom in HCTZ za bolnike s hipertenzijo. Value Health Suppl 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Kardiovaskularni učinki kombinacije trandolapril/verapamil pri bolnikih z blago do zmerno esencialno hipertenzijo. Am J Cardiol 1997; 79 (6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. Trandolapril/verapamil s podaljšanim sproščanjem: pregled njegove uporabe pri zdravljenju esencialne hipertenzije. Droge 2005; 65 (13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Obvladovanje hipertenzije pri bolnikih s sladkorno boleznijo - poudarek na kombinaciji trandolapril/verapamil. Vasc Health Risk Management 2007; 3 (4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et al. Razlike v toleranci za glukozo med kombinacijami antihipertenzivnih zdravil s fiksnim odmerkom pri ljudeh s presnovnim sindromom. Diabetes Care 2006; 29 (12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., et al. Odprava motene tolerance za glukozo, povezane z diuretiki, in novonastale sladkorne bolezni: rezultati študije STAR-LET. J Cardiometab Syndr 2008; 3 (1): 18-25.
71. Bailey C.J., Dan C. Novi farmakološki pristopi k debelosti. Obesity Practice 2005; 1:2-5.
72. Yanovski S.Z., Yanovski J.A.Y. debelost. N Engl J Med 2002; 346 (8): 591-602.
73. Dan C., Bailey C.J. Posodobitev sibutramina. Br J Diabetes Vasc Dis 2002; 2:392-7.
74. James W.P., Astrup A., Finer N., et al. Vpliv sibutramina na vzdrževanje telesne teže po izgubi teže: randomizirano preskušanje. Študijska skupina STORM. Preizkus sibutramina za zmanjšanje in vzdrževanje debelosti. Lancet 2000; 356:2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W. et al. Kardiovaskularni odzivi na uravnavanje telesne teže in sibutramin pri osebah z visokim tveganjem: analiza iz preskušanja SCOUT. Eur Heart J 2007; 28 (23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W. et al. Spremembe krvnega tlaka, povezane s sibutraminom in uravnavanjem telesne teže – analiza iz 6-tedenskega uvodnega obdobja preskušanja srčno-žilnih rezultatov sibutramina (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et al. Učinki kombinacije sibutramina in verapamila s podaljšanim sproščanjem/trandolaprila na krvni tlak in presnovne spremenljivke pri debelih hipertenzivnih bolnikih. Expert Opin Pharmacother 2008; 9 (10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., et al. Optimalno zdravljenje hipertenzije, povezane z debelostjo: študija hipertenzije-debelosti-sibutramina (HOS). Naklada 2007; 115 (15): 1991-8.
79. Glezer M.G. Rezultati ruske študije POLONEZ (UČINKOVITOST IN VARNOST ENARENALNE PRI BOLNIKIH Z ARTERIJSKO HIPERTENZIJO). Terapevtski arhiv 2006; 4:44-50.
Za citat: Leonova M.V. Nova in obetavna zdravila, ki blokirajo sistem renin-angiotenzin-aldosteron // RMJ. Zdravniški pregled. 2013. št. 17. S. 886
Vloga renin-angiotenzin-aldosteronskega sistema (RAAS) pri razvoju arterijske hipertenzije (AH) in drugih srčno-žilnih bolezni trenutno velja za prevladujočo. V kardiovaskularnem kontinuumu je hipertenzija med dejavniki tveganja, glavni patofiziološki mehanizem poškodbe srčno-žilnega sistema pa je angiotenzin II (ATII). ATII je ključna komponenta RAAS – efektor, ki izvaja vazokonstrikcijo, zadrževanje natrija, aktivacijo simpatičnega živčnega sistema, celično proliferacijo in hipertrofijo, razvoj oksidativnega stresa in vnetja žilne stene.
Trenutno sta že razvita in klinično široko uporabljena dva razreda zdravil, ki zavirajo RAAS - zaviralci ACE in zaviralci receptorjev ATII. Farmakološki in klinični učinki teh razredov se razlikujejo. ACE je peptidaza cinkove metaloproteinaze, ki presnavlja ATI, AT1-7, bradikinin, snov P in številne druge peptide. Mehanizem delovanja zaviralcev ACE je povezan predvsem s preprečevanjem nastajanja ATII, kar spodbuja vazodilatacijo, natriurezo in odpravlja provnetne, proliferativne in druge učinke ATII. Poleg tega zaviralci ACE preprečujejo razgradnjo bradikinina in zvišujejo njegovo raven. Bradikinin je močan vazodilatator, potencira natriurezo, predvsem pa ima kardioprotektivno (preprečuje hipertrofijo, zmanjšuje ishemično poškodbo miokarda, izboljša koronarno prekrvavitev) in vazoprotektivno delovanje, izboljšuje delovanje endotelija. Hkrati je visoka raven bradikinina vzrok za razvoj angioedema, kar je ena od resnih pomanjkljivosti zaviralcev ACE, ki znatno povečajo raven kininov.
Zaviralci ACE ne morejo vedno popolnoma blokirati tvorbe ATII v tkivih. Zdaj je ugotovljeno, da lahko pri njegovi transformaciji v tkivih sodelujejo tudi drugi encimi, ki niso povezani z ACE, predvsem endopeptidaze, na katere zaviralci ACE ne vplivajo. Zaradi tega zaviralci ACE ne morejo popolnoma odpraviti učinkov ATII, kar je lahko razlog za njihovo neučinkovitost.
Rešitev tega problema je olajšala odkritje receptorjev ATII in prvega razreda zdravil, ki selektivno blokirajo receptorje AT1. Preko AT1 receptorjev se uresničujejo neugodni učinki ATII: vazokonstrikcija, izločanje aldosterona, vazopresina, norepinefrina, zastajanje tekočine, proliferacija gladkih mišičnih celic in kardiomiocitov, aktivacija SAS, kot tudi mehanizem negativne povratne zveze - tvorba renina. . AT2 receptorji opravljajo "koristne" funkcije, kot so vazodilatacija, procesi popravljanja in regeneracije, antiproliferativno delovanje, diferenciacija in razvoj embrionalnih tkiv. Klinični učinki zaviralcev receptorjev ATII so posredovani z odpravo "škodljivih" učinkov ATII na ravni receptorjev AT1, kar zagotavlja popolnejšo blokado neželenih učinkov ATII in povečanje učinka ATII na receptorje AT2. , ki dopolnjuje vazodilatacijske in antiproliferativne učinke. Zaviralci receptorjev ATII imajo specifičen učinek na RAAS, ne da bi motili kininski sistem. Pomanjkanje vpliva na aktivnost kininskega sistema po eni strani zmanjša resnost neželenih učinkov (kašelj, angioedem), po drugi strani pa blokatorjem receptorjev ATII odvzame pomemben antiishemični in vazoprotektivni učinek, kar jih razlikuje od zaviralcev ACE. Zaradi tega indikacije za uporabo zaviralcev receptorjev ATII v večini ponavljajo indikacije za predpisovanje zaviralcev ACE, zaradi česar so alternativna zdravila.
Kljub uvedbi zaviralcev RAAS v široko prakso zdravljenja hipertenzije ostajajo težave z izboljšanjem izidov in prognoze. Sem spadajo: možnost izboljšanja nadzora krvnega tlaka v populaciji, učinkovitost zdravljenja rezistentne hipertenzije, možnost nadaljnjega zmanjševanja tveganja za srčno-žilne bolezni.
Iskanje novih načinov vplivanja na RAAS aktivno poteka; proučujejo se drugi tesno medsebojno povezani sistemi in razvijajo se zdravila z več mehanizmi delovanja, kot so zaviralci ACE in zaviralci nevtralne endopeptidaze (NEP), endotelin-konvertazni encim (EPF) in zaviralci NEP, zaviralci ACE/NEP/EPF.
Zaviralci vazopeptidaze
Vazopeptidaze poleg znanega ACE vključujejo še 2 drugi cinkovi metaloproteinazi - neprilizin (nevtralna endopeptidaza, NEP) in endotelin-konvertazni encim, ki sta prav tako lahko tarči farmakoloških učinkov.
Neprilysin je encim, ki ga proizvaja žilni endotelij in sodeluje pri razgradnji natriuretičnega peptida ter bradikinina.
Natriuretični peptidni sistem predstavljajo tri različne izooblike: atrijski natriuretični peptid (A-tip), možganski natriuretični peptid (B-tip), ki se sintetizirajo v atriju in miokardu, in endotelijski C-peptid, ki so endogeni zaviralci RAAS v njihove biološke funkcije in endotelin-1 (tabela 1). Kardiovaskularni in ledvični učinki natriuretičnega peptida so znižanje krvnega tlaka z učinkom na žilni tonus ter ravnovesje vode in elektrolitov ter antiproliferativni in antifibrotični učinek na ciljne organe. V zadnjem času je natriuretični peptidni sistem vključen v presnovno regulacijo oksidacije lipidov, tvorbo in diferenciacijo adipocitov, aktivacijo adiponektina, izločanje insulina in toleranco za ogljikove hidrate, kar lahko zagotovi zaščito pred razvojem presnovnega sindroma.
Do danes je postalo znano, da je razvoj bolezni srca in ožilja povezan z disregulacijo sistema natriuretičnih peptidov. Torej, pri hipertenziji obstaja pomanjkanje natriuretičnega peptida, kar vodi do občutljivosti na sol in oslabljene natriureze; pri kroničnem srčnem popuščanju (CHF) v ozadju pomanjkanja opazimo nenormalno delovanje hormonov natriuretičnega peptidnega sistema.
Zato lahko zaviralce NEP uporabimo za potenciranje natriuretičnega peptidnega sistema, da dosežemo dodatne hipotenzivne in zaščitne kardiorenalne učinke. Zaviranje neprilizina vodi do povečanja natriuretičnega, diuretičnega in vazodilatatornega učinka endogenega natriuretičnega peptida in posledično do znižanja krvnega tlaka. Vendar pa je NEP vključen tudi v razgradnjo drugih vazoaktivnih peptidov, zlasti ATI, ATII in endotelina-1. Zato je ravnotežje učinkov zaviralcev NEP na žilni tonus spremenljivo in odvisno od prevlade konstriktorskih in dilatacijskih učinkov. Pri dolgotrajni uporabi je antihipertenzivni učinek zaviralcev neprilizina šibko izražen zaradi kompenzacijske aktivacije tvorbe ATII in endotelina-1.
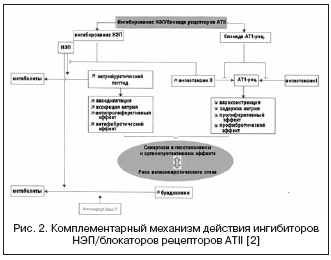
V zvezi s tem lahko kombinacija učinkov zaviralcev ACE in zaviralcev NEP bistveno okrepi hemodinamske in antiproliferativne učinke zaradi komplementarnega mehanizma delovanja, kar je privedlo do nastanka zdravil z dvojnim mehanizmom delovanja, združenih pod imenom - zaviralci vazopeptidaze (tabela 2, slika 1) .
Za znane zaviralce vazopeptidaz so značilne različne stopnje selektivnosti za NEP/ACE: omapatrilat - 8,9:0,5; fazidoprilat - 5,1:9,8; sampatrilat - 8,0:1,2. Posledično so zaviralci vazopeptidaze dobili veliko večje možnosti za doseganje hipotenzivnega učinka, ne glede na aktivnost RAAS in stopnjo zadrževanja natrija ter pri zaščiti organov (regresija hipertrofije, albuminurije, vaskularne togosti). V kliničnih študijah je bil najbolj raziskan omapatrilat, ki je pokazal večjo antihipertenzivno učinkovitost v primerjavi z zaviralci ACE, pri bolnikih s CHF pa je povzročil povečanje iztisnega deleža in izboljšanje kliničnih izidov (študije IMPRESS, OVERTURE), vendar brez prednosti pred zaviralci ACE.
Vendar so v velikih kliničnih preskušanjih z uporabo omapatrilata ugotovili večjo incidenco angioedema v primerjavi z zaviralci ACE. Znano je, da je incidenca angioedema pri uporabi zaviralcev ACE v populaciji od 0,1 do 0,5%, od tega je 20% primerov življenjsko nevarnih, kar je povezano z večkratnim povečanjem koncentracije bradikinina in njegovih presnovkov. Rezultati velike multicentrične študije OCTAVE (n=25.302), ki je bila posebej zasnovana za preučevanje incidence angioedema, so pokazali, da je incidenca tega neželenega učinka med zdravljenjem z omapatrilatom večja kot v skupini z enalaprilom - 2,17 % proti 0,68 %. (relativno tveganje 3,4). To so pojasnili s povečanim učinkom na raven kininov med sinergistično inhibicijo ACE in NEP, povezano z inhibicijo aminopeptidaze P, ki sodeluje pri razgradnji bradikinina.
Nov zaviralec vazopeptidaze z dvojnim blokiranjem ACE/NEP, ilepatril, ima večjo afiniteto za ACE kot NEP. Pri proučevanju farmakodinamičnih učinkov ilepatrila na učinek na aktivnost RAAS in natriuretičnega peptida pri zdravih prostovoljcih je bilo ugotovljeno, da zdravilo odvisno od odmerka (v odmerkih 5 in 25 mg) in pomembno (več kot 88 %) zavira ACE v plazmi več kot 48 ur, ne glede na občutljivost na sol. Hkrati je zdravilo znatno povečalo aktivnost renina v plazmi za 48 ur in zmanjšalo raven aldosterona. Ti rezultati so pokazali izrazito in daljšo supresijo RAAS v nasprotju z zaviralcem ACE ramiprilom v odmerku 10 mg, kar so pojasnili z izrazitejšim tkivnim učinkom ilepatrila na ACE in večjo afiniteto za ACE ter primerljivo stopnjo blokade RAAS v primerjavi s kombinacijo 150 mg irbesartana + 10 mg ramiprila. V nasprotju z učinkom na RAAS se je učinek ilepatrila na natriuretični peptid pokazal s prehodnim povečanjem stopnje njegovega izločanja v obdobju 4-8 ur po zaužitju odmerka 25 mg, kar kaže na nižjo in šibkejšo afiniteto za NEP in ga razlikuje od omapatrilata. Poleg tega glede stopnje izločanja elektrolitov zdravilo nima dodatnega natriuretičnega učinka v primerjavi z ramiprilom ali irbesartanom ter drugimi zaviralci vazopeptidaze. Največji hipotenzivni učinek se razvije 6-12 ur po zaužitju zdravila, znižanje povprečnega krvnega tlaka pa je 5 ± 5 in 10 ± 4 mm Hg. pri nizki oziroma visoki občutljivosti na sol. Po farmakokinetičnih značilnostih je ilepatril predzdravilo z aktivnim presnovkom, ki se hitro tvori z največjo koncentracijo v 1-1,5 urah in se počasi izloča. Trenutno potekajo klinična preskušanja faze III.
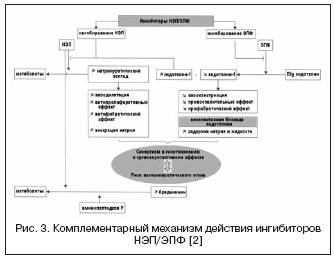
Alternativno pot k dvojni supresiji RAAS in NEP predstavlja kombinacija blokade receptorjev ATII in NEP (slika 2). Zaviralci receptorjev ATII za razliko od zaviralcev ACE ne vplivajo na presnovo kininov, zato imajo potencialno manjše tveganje za razvoj angioedema. Trenutno je prvo zdravilo, zaviralec receptorjev ATII z učinkom zaviranja NEP v razmerju 1:1, LCZ696, v kliničnih preskušanjih faze III. Kombinirana molekula zdravila vsebuje valsartan in inhibitor NEP (AHU377) v obliki predzdravila. V veliki študiji pri bolnikih s hipertenzijo (n=1328) je LCZ696 v odmerkih 200-400 mg pokazal prednost v hipotenzivnem učinku pred valsartanom v odmerkih 160-320 mg v obliki dodatnega znižanja krvnega tlaka za 5 /3 in 6/3 mmHg. . Hipotenzivni učinek LCZ696 je spremljalo izrazitejše znižanje pulznega tlaka: za 2,25 in 3,32 mm Hg. v odmerkih 200 oziroma 400 mg, kar trenutno velja za pozitiven prognostični dejavnik za učinek na togost žilne stene in srčno-žilne izide. Hkrati je študija nevrohumoralnih biomarkerjev med zdravljenjem z LCZ696 pokazala povečanje ravni natriuretičnega peptida s primerljivo stopnjo povečanja ravni renina in aldosterona v primerjavi z valsartanom. Prenašanje pri bolnikih s hipertenzijo je bilo dobro in niso opazili nobenega primera angioedema. Preskušanje PARAMOUMT je zdaj zaključeno pri 685 bolnikih s kongestivnim srčnim popuščanjem in neoporečno EF. Rezultati študije so pokazali, da LCZ696 hitreje in izraziteje zmanjša raven NT-proBNP (primarni opazovani dogodek je marker povečane aktivnosti natriuretičnega peptida in slabe prognoze pri CHF) v primerjavi z valsartanom, zmanjša pa tudi velikost levega atrija. , kar kaže na nazadovanje njegove preoblikovanja . Študija pri bolnikih s kongestivnim srčnim popuščanjem in zmanjšano EF je v teku (študija PARADIGM-HF).
Zaviralci endotelinskega sistema
Endotelinski sistem ima pomembno vlogo pri uravnavanju žilnega tonusa in regionalnega pretoka krvi. Med tremi znanimi izooblikami je endotelin-1 najbolj aktiven. Poleg znanih vazokonstriktorskih učinkov endotelin spodbuja proliferacijo in sintezo medceličnega matriksa, poleg tega pa zaradi neposrednega vpliva na tonus ledvičnih žil sodeluje pri uravnavanju homeostaze vode in elektrolitov. Učinki endotelina se uresničujejo z interakcijo s specifičnimi receptorji tipa A in B, katerih funkcije so med seboj nasprotne: vazokonstrikcija poteka preko receptorjev tipa A, vazodilatacija pa preko receptorjev tipa B. V zadnjih letih je bilo ugotovljeno, da imajo receptorji tipa B pomembno vlogo pri očistku endotelina-1, tj. blokada teh receptorjev poruši od receptorja odvisen očistek endotelina-1 in poveča njegovo koncentracijo. Poleg tega so receptorji tipa B vključeni v regulacijo ledvičnih učinkov endotelina-1 in vzdrževanje homeostaze vode in elektrolitov, kar je pomembno.
Trenutno je dokazana vloga endotelina pri razvoju številnih bolezni, vklj. AH, CHF, pljučna hipertenzija, kronična ledvična bolezen; kaže tesno povezavo med nivojem endotelina in presnovnim sindromom, endotelijsko disfunkcijo in aterogenezo. Od leta 1990 poteka iskanje antagonistov endotelinskih receptorjev, primernih za klinično uporabo; Znanih je že 10 zdravil ("sentanov") z različnimi stopnjami selektivnosti za receptorje tipa A / B. Prvi neselektivni antagonist endotelinskih receptorjev - bosentan - je v klinični študiji pri bolnikih s hipertenzijo pokazal hipotenzivno učinkovitost, primerljivo z zaviralcem ACE enalaprilom. Nadaljnje študije o učinkovitosti antagonistov endotelina pri hipertenziji so pokazale njihov klinični pomen pri zdravljenju rezistentne hipertenzije in visokega srčno-žilnega tveganja. Ti podatki so bili pridobljeni v dveh velikih kliničnih preskušanjih DORADO (n=379) in DORADO-AC (n=849), v katerih je bil darusentan dodan trojni kombinirani terapiji pri bolnikih z rezistentno hipertenzijo. V študiji DORADO so bolnike z rezistentno hipertenzijo povezovali s kronično ledvično boleznijo in proteinurijo, zaradi dodajanja darusentana pa niso opazili le pomembnega znižanja krvnega tlaka, temveč tudi zmanjšanje izločanja beljakovin. Antiproteinurični učinek antagonistov endotelinskih receptorjev je bil nato potrjen v študiji pri bolnikih z diabetično nefropatijo, ki so uporabljali avocentan. V študiji DORADO-AC pa ni bilo nobene prednosti pri dodatnem znižanju KT pred primerjalnimi zdravili in placebom, kar je bil razlog za prekinitev nadaljnjih študij. Poleg tega so v 4 velikih študijah antagonistov endotelina (bosentan, darusentan, enrasentan) pri bolnikih s CHF dobili nasprotujoče si rezultate, kar je bilo razloženo s povečanjem koncentracije endotelina-1. Nadaljnja študija antagonistov endotelinskih receptorjev je bila prekinjena zaradi neželenih učinkov, povezanih z zastajanjem tekočine (periferni edem, volumska preobremenitev). Razvoj teh učinkov je povezan z delovanjem antagonistov endotelina na receptorje tipa B, kar je spremenilo iskanje zdravil, ki vplivajo na endotelinski sistem po drugih poteh; in antagonisti endotelinskih receptorjev imajo trenutno samo eno indikacijo, zdravljenje pljučne hipertenzije.
Ob upoštevanju velikega pomena endotelinskega sistema pri regulaciji žilnega tonusa poteka iskanje drugega mehanizma delovanja preko vazopeptidaze - EPF, ki sodeluje pri tvorbi aktivnega endotelina-1 (slika 3). Blokiranje ACE in kombinacija z inhibicijo NEP lahko učinkovito zavreta tvorbo endotelina-1 in okrepita učinke natriuretičnega peptida. Prednosti dvojnega mehanizma delovanja so na eni strani v preprečevanju pomanjkljivosti zaviralcev NEP, povezanih z možno vazokonstrikcijo, ki jo posreduje aktivacija endotelina, po drugi strani pa natriuretična aktivnost zaviralcev NEP omogoča kompenzacijo zastajanja tekočine. povezana z neselektivno blokado endotelinskih receptorjev. Daglutril je dvojni zaviralec NEP in EPF, ki je v fazi II kliničnih preskušanj. Študije so pokazale izrazite kardioprotektivne učinke zdravila zaradi zmanjšanja preoblikovanja srca in ožilja, regresije hipertrofije in fibroze.
Neposredni zaviralci renina
Znano je, da zaviralci ACE in zaviralci receptorjev ATII povečajo aktivnost renina po mehanizmu povratne zveze, kar je razlog za bežanje učinkovitosti zaviralcev RAAS. Renin predstavlja prvi korak v kaskadi RAAS; proizvajajo ga jukstaglomerularne celice ledvic. Renin prek angiotenzinogena pospešuje nastanek ATII, vazokonstrikcijo in izločanje aldosterona ter uravnava povratne mehanizme. Zato inhibicija renina omogoča doseganje popolnejše blokade sistema RAAS. Iskanje zaviralcev renina poteka že od sedemdesetih let prejšnjega stoletja; dolgo časa ni bilo mogoče dobiti peroralne oblike zaviralcev renina zaradi njihove nizke biološke uporabnosti v prebavilih (manj kot 2 %). Prvi neposredni zaviralec renina, primeren za peroralno uporabo, aliskiren, je bil registriran leta 2007. Aliskiren ima nizko biološko uporabnost (2,6 %), dolgo razpolovno dobo (24-40 ur), zunajledvično pot izločanja. Farmakodinamika aliskirena je povezana z 80-odstotnim znižanjem ravni ATII. V kliničnih študijah pri bolnikih s hipertenzijo je aliskiren v odmerkih 150-300 mg / dan povzročil znižanje SBP za 8,7-13 in 14,1-15,8 mm Hg. in DBP - za 7,8-10,3 in 10,3-12,3 mm Hg. . Hipotenzivni učinek aliskirena so opazili pri različnih podskupinah bolnikov, vključno z bolniki s presnovnim sindromom, debelostjo; po resnosti je bil primerljiv z učinkom zaviralcev ACE, blokatorjev receptorjev ATII, aditivni učinek pa je bil opažen v kombinaciji z valsartanom, hidroklorotiazidom in amlodipinom. Številne klinične študije so pokazale organoprotektivne učinke zdravila: antiproteinuričen učinek pri bolnikih z diabetično nefropatijo (študija AVOID, n=599), regresijo hipertrofije levega prekata pri bolnikih s hipertenzijo (študija ALLAY, n=465). Tako so v študiji AVOID po 3 mesecih zdravljenja z losartanom v odmerku 100 mg/dan in doseganju ciljne ravni krvnega tlaka (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Poleg tega poteka serija kliničnih študij aliskirena pri zdravljenju drugih srčno-žilnih bolezni z oceno vpliva na prognozo bolnikov: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n =7000) študij pri bolnikih s kongestivnim srčnim popuščanjem, študija ALTITUDE pri bolnikih s sladkorno boleznijo in visokim srčno-žilnim tveganjem, študija ASPIRE pri bolnikih s postinfarktno remodelacijo.
Zaključek
Za reševanje težav pri preprečevanju bolezni srca in ožilja se nadaljuje ustvarjanje novih zdravil s kompleksnim večkratnim mehanizmom delovanja, ki omogoča popolnejšo blokado RAAS s pomočjo kaskade mehanizmov hemodinamične in nevrohumoralne regulacije. Potencialni učinki takšnih zdravil omogočajo ne le zagotavljanje dodatnega antihipertenzivnega učinka, temveč tudi doseganje nadzora ravni krvnega tlaka pri bolnikih z visokim tveganjem, vključno z odporno hipertenzijo. Zdravila z večkratnim mehanizmom delovanja kažejo prednosti v izrazitejšem organoprotektivnem učinku, ki bo preprečil nadaljnje poškodbe srčno-žilnega sistema. Preučevanje koristi novih zdravil, ki blokirajo RAAS, zahteva nadaljnje raziskave in vrednotenje njihovega vpliva na prognozo bolnikov s hipertenzijo in drugimi srčno-žilnimi boleznimi.


Literatura
1 Campbell D.J. Inhibicija vazopeptidaze: dvorezen meč? // Hipertenzija. 2003 letnik 41. Str. 383-389.
2. Laurent S., Schlaich M., Esler M. Nova zdravila, postopki in naprave za hipertenzijo // Lancet. 2012. letnik 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Zaviralci vazopeptidaze: nov terapevtski koncept pri boleznih srca in ožilja? // Naklada. 2001 letnik 104. Str. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Inhibicija nevtralne endopeptidaze in natriuretični peptidni sistem: razvijajoča se strategija v terapevtiki srca in ožilja // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Primerjava zaviralca vazopeptidaze, omapatrilata in lizinoprila na toleranco za vadbo in obolevnost pri bolnikih s srčnim popuščanjem: randomizirano preskušanje IMPRESS // Lancet. 2000 Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Primerjava omapatrilata in enalaprila pri bolnikih s kroničnim srčnim popuščanjem: Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 letnik 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Zaviralci receptorjev angiotenzina II pri bolnikih z angioedemom, povzročenim z zaviralci ACE // Ann. Pharmacother. 2000 Vol. 34. Str. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat in enalapril pri bolnikih s hipertenzijo: preskušanje Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hipertenzija. 2004 letnik 17. Str. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Farmakokinetika in farmakodinamika zaviralca vazopeptidaze AVE7688 pri ljudeh // Clin. Pharmacol. Ther. 2006 letnik 79. Str. 49-61.
10. Gu J., Noe A., Chandra P. et al. Farmakokinetika in farmakodinamika LCZ696, novega dvojnega zaviralca angiotenzinskega receptorja prilizina (ARNi) // J. Clin. Pharmacol. 2010 Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Znižanje krvnega tlaka z LCZ696, novim dvojnim zaviralcem receptorja angiotenzina II in neprilizinom: randomizirana, dvojno slepa, s placebom nadzorovana študija aktivnega primerjalnega zdravila // Lancet. 2010 Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. Zaviralec neprilizina angiotenzinskega receptorja LCZ696 pri srčnem popuščanju z ohranjenim iztisnim deležem: dvojno slepo randomizirano kontrolirano preskušanje faze 2 // Lancet. 2012. letnik 380 (9851). Str. 1387-1395.
13. Levin E.R. Endotelini // N. Engl. J. Med. 1995 letnik 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Vloga endotelina-1 pri klinični hipertenziji: 20 let pozneje // Hipertenzija. 2008 letnik 52. Str. 452-459.
15. Burnier M., Forni V. Antagonisti endotelinskih receptorjev: mesto pri zdravljenju esencialne hipertenzije? // Nephrol. Dial. presaditev. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. Učinek antagonista endotelinskega receptorja, bosentana, na krvni tlak pri bolnikih z esencialno hipertenzijo. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998 letnik 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. Selektivni antagonist endotelinskih receptorjev za znižanje krvnega tlaka pri bolnikih s hipertenzijo, odporno na zdravljenje: randomizirano, dvojno slepo, s placebom kontrolirano preskušanje // Lancet. 2009 letnik 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Različni rezultati z uporabo kliničnih in ambulantnih krvnih tlakov: poročilo o preskušanju hipertenzije, odporne na darusentan // Hipertenzija. 2010 Vol. 56. Str. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan za očitno diabetično nefropatijo // J. Am. soc. Nefrol. 2010 Vol. 21. Str. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Encim za pretvorbo endotelina/nevtralni zaviralec endopeptidaze SLV338 preprečuje hipertenzivno preoblikovanje srca na način, neodvisen od krvnega tlaka // Hipertenzija. 2011 Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Zaviranje angiotenzina II pri ljudeh s teoretično aktivnim zaviralcem renina aliskirenom (SPP100): primerjava z enalaprilom // Hipertenzija. 2002 letnik 39(1). P.E1-8.
22. Alreja G., Joseph J. Renin in srčno-žilne bolezni: izrabljena pot ali nova smer? // World J. Cardiol. 2011 Vol. 3(3). Str. 72-83.
23. Ingelfinger J.R. Aliskiren in dvojna terapija pri sladkorni bolezni tipa 2 // N. Engl. J. Med. 2008 letnik 358(23). P. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (za preiskovalce ALLAY). Supresija aldosterona posreduje regresijo hipertrofije levega prekata pri bolnikih s hipertenzijo // J. Renin-angiotenzin-aldosteronski sistem. 2011 Vol. 12. Str. 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, nov zaviralec renina, deluje renoprotektivno v modelu napredovale diabetične nefropatije pri podganah // Diabetol. 2007 letnik 50. P. 2398-2404.


