Aldosterón u ľudí je hlavným predstaviteľom mineralokortikoidných hormónov odvodených od cholesterolu.
Syntéza
Vykonáva sa v glomerulárnej zóne kôry nadobličiek. Progesterón, ktorý sa tvorí z cholesterolu, podlieha postupnej oxidácii na ceste k aldosterónu. 21-hydroxyláza, 11-hydroxyláza a 18-hydroxyláza. V konečnom dôsledku sa tvorí aldosterón.

Schéma syntézy steroidných hormónov (úplná schéma)
Regulácia syntézy a sekrécie
Aktivovať:
- angiotenzín II uvoľnené počas aktivácie renín-angiotenzínového systému,
- zvýšená koncentrácia draselné ióny v krvi (spojené s depolarizáciou membrány, otvorením vápnikových kanálov a aktiváciou adenylátcyklázy).
Aktivácia renín-angiotenzínového systému
- Na aktiváciu tohto systému existujú dva východiskové body:
- zníženie tlaku v aferentných arteriolách obličiek, ktorý je určený baroreceptory bunky juxtaglomerulárneho aparátu. Dôvodom môže byť akékoľvek porušenie prietoku krvi obličkami - ateroskleróza. renálnych artériách, zvýšená viskozita krvi, dehydratácia, strata krvi atď.
- zníženie koncentrácie iónov Na + v primárnom moči v distálnych tubuloch obličiek, ktorý je určený osmoreceptormi buniek juxtaglomerulárneho aparátu. Vyskytuje sa v dôsledku diéty bez soli, pri dlhodobom užívaní diuretík.
Sekrécia renínu (základná) je udržiavaná sympatickým nervovým systémom, konštantná a nezávislá od prietoku krvi obličkami.
- Pri vykonávaní jednej alebo oboch položiek bunky juxtaglomerulárny aparát sa aktivujú a z nich sa enzým vylučuje do krvnej plazmy renin.
- V plazme je substrát pre renín - proteín frakcie α2-globulínu angiotenzinogén. V dôsledku proteolýzy vzniká dekapeptid tzv angiotenzín I. Ďalej angiotenzín I s účasťou angiotenzín konvertujúci enzým(ACE) sa zmení na angiotenzín II.
- Hlavnými cieľmi angiotenzínu II sú hladké myocyty. cievy A glomerulárna kôra nadobličky:
- stimulácia krvných ciev spôsobuje ich kŕč a zotavenie krvný tlak.
- vylučované z nadobličiek po stimulácii aldosterón pôsobiace na distálne tubuly obličiek.
Keď sú obličkové tubuly vystavené pôsobeniu aldosterónu, zvyšujú reabsorpciu Na+ ióny po pohyboch sodíka voda. Výsledkom je obnovenie tlaku v obehovom systéme a zvýšenie koncentrácie sodíkových iónov v krvnej plazme a tým aj v primárnom moči, čo znižuje aktivitu RAAS.

Aktivácia systému renín-angiotenzín-aldosterón
Mechanizmus akcie
Cytosolic.
Ciele a efekty
Ovplyvňuje slinné žľazy na distálnych tubuloch a zberných kanáloch obličiek. Posilňuje v obličkách reabsorpcia sodných iónov a strata draslíkových iónov prostredníctvom nasledujúcich účinkov:
- zvyšuje množstvo Na + ,K + -ATPázy o bazálnej membrány epitelové bunky,
- stimuluje syntézu mitochondriálnych proteínov a zvyšuje množstvo energie produkovanej v bunke pre činnosť Na+, K+ -ATPázy,
- stimuluje tvorbu sodíkových kanálov na apikálnej membráne renálnych epitelových buniek.
Patológia
hyperfunkcia
Connov syndróm (primárny aldosteronizmus) - vyskytuje sa pri adenómoch glomerulárnej zóny. Je charakterizovaná triádou znakov: hypertenzia, hypernatriémia, alkalóza.
Sekundárne hyperaldosteronizmus - hyperplázia a hyperfunkcia juxtaglomerulárnych buniek a nadmerná sekrécia renínu a angiotenzínu II. Dochádza k zvýšeniu krvného tlaku a vzniku edému.
Systém renín-angiotenzín-aldosterón je komplex enzýmov a hormónov, ktoré udržiavajú homeostázu. Reguluje rovnováhu soli a vody v tele a hladinu krvného tlaku.
Pracovný mechanizmus
Fyziológia systému renín-angiotenzín-aldosterón vzniká na hranici kôry a tam, kde sa nachádzajú juxtaglomerulárne bunky, ktoré produkujú peptidázu (enzým) - renín.
Renín je hormón a počiatočné spojenie RAAS.
Situácie, v ktorých sa renín uvoľňuje do krvi
Existuje niekoľko stavov, pri ktorých hormón vstupuje do krvného obehu:
- Znížený prietok krvi v tkanive obličiek - so zápalovými procesmi (glomerulonefritída atď.), S diabetická nefropatia, nádory obličiek.
- Zníženie (s krvácaním, opakovaným vracaním, hnačkou, popáleninami).
- Pokles krvného tlaku. V tepnách obličiek sú baroreceptory, ktoré reagujú na zmeny systémového tlaku.
- Zmena koncentrácie iónov sodíka. V ľudskom tele sa hromadia bunky, ktoré reagujú na zmeny v iónovom zložení krvi stimuláciou tvorby renínu. Soľ sa stráca hojné potenie ako aj zvracanie.
- Stres, psycho-emocionálny stres. Obličky sú inervované sympatickými nervami, ktoré sú aktivované negatívnymi psychickými vplyvmi.
V krvi sa renín stretáva s proteínom – angiotenzinogénom, ktorý produkujú pečeňové bunky a berie si z neho fragment. Vzniká angiotenzín I, ktorý je zdrojom účinku enzýmu konvertujúceho angiotenzín (ACE). Výsledkom je angiotenzín II, ktorý slúži ako druhý článok a je silným vazokonstriktorom. arteriálny systém(sťahuje krvné cievy).
Účinky angiotenzínu II
Účel: zvýšiť arteriálny tlak.
- Podporuje syntézu aldosterónu v glomerulárnej zóne kôry nadobličiek.
- Ovplyvňuje centrum hladu a smädu v mozgu, čo spôsobuje „slanú“ chuť do jedla. Ľudské správanie sa stáva motivované vyhľadávať vodu a slané jedlá.
- Ovplyvňuje sympatické nervy, podporujúce uvoľňovanie norepinefrínu, ktorý je tiež vazokonstriktor, ale menej slabý v účinku.
- Ovplyvňuje krvné cievy a spôsobuje ich kŕče.
- Podieľa sa na vzniku chronického srdcového zlyhania: podporuje proliferáciu, vaskulárnu a myokardiálnu fibrózu.
- Znižuje
- Inhibuje produkciu bradykinínu.

Aldosterón je tretia zložka, ktorá pôsobí na koncové tubuly obličiek a podporuje vylučovanie iónov draslíka a horčíka z tela a spätnú absorpciu (reabsorpciu) sodíka, chlóru a vody. V dôsledku toho sa zvyšuje objem cirkulujúcej tekutiny, stúpajú čísla krvného tlaku a zvyšuje sa prietok krvi obličkami. Receptory pre aldosterón sú prítomné nielen v obličkách, ale aj v srdci a cievach.
Keď telo dosiahne homeostázu, začnú sa produkovať vazodilatanciá (látky rozširujúce cievy) – bradykinín a kallidín. A zložky RAAS sú zničené v pečeni.
Schéma systému renín-angiotenzín-aldosterón

Ako každý systém, aj RAAS môže zlyhať. Patofyziológia systému renín-angiotenzín-aldosterón sa prejavuje za nasledujúcich podmienok:
- Poškodenie kôry nadobličiek (infekcia, krvácanie a trauma). Vyvíja sa stav nedostatku aldosterónu a telo začína strácať sodík, chlorid a vodu, čo vedie k zníženiu objemu cirkulujúcej tekutiny a zníženiu krvného tlaku. Stav je kompenzovaný úvodom soľné roztoky a stimulanty aldosterónového receptora.
- Nádor kôry nadobličiek vedie k nadbytku aldosterónu, ktorý si uvedomuje svoje účinky a zvyšuje krvný tlak. Aktivujú sa aj procesy bunkového delenia, dochádza k hypertrofii a fibróze myokardu, vzniká srdcové zlyhanie.
- Patológia pečene, keď je narušená deštrukcia aldosterónu a dochádza k jeho akumulácii. Patológia sa lieči blokátormi aldosterónových receptorov.
- Zápalové ochorenia obličiek.

Význam RAAS pre život a medicínu
Renín-angiotenzín-aldosterónový systém a jeho úloha v tele:
- prijíma Aktívna účasť pri udržiavaní normálneho indikátora krvného tlaku;
- zabezpečuje rovnováhu vody a solí v tele;
- udržiava acidobázickú rovnováhu krvi.
Systém môže zlyhať. Pôsobením na jeho zložky môžete bojovať s hypertenziou. S RAAS úzko súvisí aj mechanizmus výskytu renálnej hypertenzie.
Vysoko účinné skupiny liekov, ktoré sú syntetizované vďaka štúdiu RAAS
- "Prily". ACE. Angiotenzín I sa nekonvertuje na angiotenzín II. Žiadna vazokonstrikcia – žiadne zvýšenie krvného tlaku. Prípravky: Amprilan, Enalapril, Captopril atď. ACE inhibítory výrazne zlepšujú kvalitu života diabetických pacientov, poskytujú prevenciu zlyhania obličiek. Lieky sa užívajú v minimálnom dávkovaní, ktoré nespôsobuje pokles tlaku, ale len zlepšuje lokálny prietok krvi a glomerulárnu filtráciu. Lieky sú nevyhnutné pri zlyhaní obličiek, chronické ochorenie srdcia a slúžia ako jeden z prostriedkov na liečbu hypertenzie (ak neexistujú žiadne kontraindikácie).
- "Sartáni". Blokátory receptorov angiotenzínu II. Cievy na to nereagujú a nesťahujú sa. Lieky: Losartan, Eprosartan atď.

Opakom renín-angiotenzín-aldosterónového systému je kinínový systém. Preto blokáda RAAS vedie k zvýšeniu krvných zložiek kinínového systému (bradykinín a pod.), čo priaznivo ovplyvňuje tkanivá srdca a cievnych stien. V myokarde nedochádza k hladovaniu, pretože bradykinín zvyšuje lokálny prietok krvi, stimuluje produkciu prirodzených vazodilatátorov v bunkách obličkovej drene a mikrocytoch zberných kanálikov - prostaglandínov E a I2. Neutralizujú presorický účinok angiotenzínu II. Cievy nie sú kŕčovité, čo zaisťuje dostatočné prekrvenie orgánov a tkanív tela, krv nezdržuje a znižuje sa tvorba aterosklerotických plátov a krvných zrazenín. Kiníny priaznivo pôsobia na obličky, zvyšujú diurézu (denný výdaj moču).
Renin
- enzým syntetizovaný juxtaglomerulárnymi bunkami renálnych aferentných arteriol, ktorý má MM približne 40 kDa. Obzvlášť intenzívna tvorba renínu nastáva pri renálnej ischémii. Vďaka lokalizácii juxtaglomerulárnych buniek sú obzvlášť citlivé na zmeny krvného tlaku, ako aj na koncentráciu iónov Na + a K + v tekutine pretekajúcej obličkovými tubulmi. Vďaka týmto vlastnostiam môže každá kombinácia faktorov, ktorá spôsobuje zníženie objemu tekutín (dehydratácia, pokles krvného tlaku, strata krvi a pod.) alebo zníženie koncentrácia NaCl stimuluje uvoľňovanie renínu.
Zároveň väčšina regulátorov syntézy renínu pôsobí prostredníctvom renálne baroreceptory. Uvoľňovanie renínu je ovplyvnené stavom centrálneho nervového systému, ako aj zmenou polohy tela v priestore. Najmä pri prechode z ľahu do sedu alebo státia (klinostatický test) sa sekrécia renínu zvyšuje. Táto reflexná reakcia je spôsobená zvýšením tónu sympatickej časti autonómneho nervový systém, ktorý prenáša impulzy na b-adrenergné receptory juxtaglomerulárnych buniek.
Hlavným substrátom, na ktorý renín pôsobí, je angiotenzinogén- bielkovina, ktorá je súčasťou 2-globulínovej frakcie a tvorí ju pečeň. Pod vplyvom glukokortikoidov a estrogénov sa výrazne zvyšuje syntéza angiotenzinogénu. V dôsledku pôsobenia renínu sa angiotenzinogén premieňa na dekapeptid angiotenzínja Táto zlúčenina má extrémne slabý účinok a nemá významný vplyv na hladinu krvného tlaku.
Medzitým angiotenzínja pod vplyvom tzv angiotenzín konvertujúci enzým (ACE) mení sa na silný vazokonstrikčný faktor - angiotenzínII. ACE(dipeptidkarboxypeptidáza) je integrálny proteín nachádzajúci sa najmä na membráne endotelových buniek, epitelu, mononukleárnych bunkách, nervových zakončeniach, bunkách reprodukčných orgánov atď. Rozpustná forma ACE je prítomná takmer vo všetkých telesných tekutinách.
Je obvyklé rozlišovať dve izoformy ACE. Prvý z nich dostal krycí názov „somatic“. Táto izoforma má MM 170 kDa a zahŕňa homológne C a N domény. Druhá forma ACE ("reprodukčná") sa nachádza v semennej tekutine, má MM približne 100 kDa a zodpovedá C-doméne prvej izoformy ACE. Každá z 2 uvedených domén obsahuje aminokyselinové zvyšky, ktoré sa môžu podieľať na tvorbe väzby s atómom zinku. Takéto štruktúry Zn2+ sú typické pre mnohé metaloproteinázy a sú hlavnými miestami interakcie enzýmov so substrátom aj s ACE inhibítormi.
Treba poznamenať, že ACE nevedie len k tvorbe angiotenzín II, ale aj ničí bradykinín - spojenie, ktoré sa rozširuje cievy. Preto je zvýšenie krvného tlaku pod vplyvom ACE spojené s tvorbou angiotenzínu II aj s rozkladom bradykinínu (obr. 32).
Dôležitú úlohu pre pôsobenie ACE zohráva iónové zloženie a najmä obsah chloridových iónov. Takže pri vysokej koncentrácii Cl - C-doména ACE hydrolyzuje bradykinín aj angiotenzín-I rýchlejšie ako N-doména. V extracelulárnych oblastiach, kde je koncentrácia chloridových aniónov vysoká, je N-doména prevažne zodpovedná za konverziu angiotenzínu-I. Avšak intracelulárne, kde je koncentrácia Cl nízka, sa N-doména môže podieľať na hydrolýze iných peptidových látok.
vzadu posledné roky zistilo sa, že ACE hrá významnú úlohu pri krvotvorbe, pretože pod jeho vplyvom sa tvorí hematopoetický peptid inhibícia tvorby hematopoetických buniek v kostnej dreni.
Úloha ACE v tele bola identifikovaná u myší, ktorým chýbal gén ACE. U takýchto zvierat bol zaznamenaný nízky krvný tlak, rôzne cievne dysfunkcie, narušená štruktúra a funkcia obličiek a u samcov neplodnosť.
angiotenzínII
zvyšuje krvný tlak spôsobením arteriolovej konstrikcie a je najsilnejším známym vazoaktívnym činidlom. Okrem toho inhibuje tvorbu a uvoľňovanie renínu juxtaglomerulárnymi bunkami obličiek mechanizmom spätnej väzby, čo by malo v konečnom dôsledku obnoviť normálne hladiny krvného tlaku. Pod vplyvom angiotenzínII produkcia hlavného mineralokortikoidu prudko stúpa - aldosterón. Hoci je tento účinok priamy, angiotenzín II neovplyvňuje produkciu kortizolu. Hlavným účelom aldosterónu je zadržiavanie Na + (zvýšenie jeho reabsorpcie v obličkových tubuloch) a uvoľňovanie K + a H + (hlavne cez obličky). Tieto reakcie sa uskutočňujú nasledovne.
aldosterón
preniká z extracelulárnej tekutiny do cytoplazmy bunky a tam sa spája so špecifickým receptorom, po čom vzniknutý komplex (aldosterón + receptor) preniká do jadra. Aldosterón tiež stimuluje otváranie Na+ kanálov, vďaka čomu ióny Na+ vstupujú do bunky cez apikálnu membránu z lúmenu tubulu.
Zvýšenie sekrécie K + pod vplyvom aldosterónu je spôsobené zvýšením permeability apikálnej membrány vo vzťahu k týmto iónom, vďaka čomu K + vstupuje z bunky do lumenu tubulu.
Zadržiavanie Na + v tele, podobne ako angiotenzín II, prispieva k zvýšeniu krvného tlaku.
angiotenzínII schopný viazať sa na špecifické receptory na glomerulárnych bunkách nadobličiek. Obsah týchto receptorov do značnej miery závisí od koncentrácie iónov K +. Takže ak sa zvýši hladina K +, potom sa počet receptorov pre angiotenzín II v glomerulárnych bunkách zvýši. S poklesom koncentrácie iónov K + je zaznamenaný opačný účinok. Preto ióny K + hrajú hlavnú úlohu pri pôsobení angiotenzínu II na nadobličky.
vzadu V poslednej dobe to určil angiotenzínII schopný aktivovať makrofágy, čím zvyšuje agregáciu krvných doštičiek a urýchľuje zrážanie krvi. Zároveň sa uvoľňuje inhibítor aktivátora plazminogén-ja (IAP-1), ktorý môže byť sprevádzaný depresiou fibrinolýzy. A ngiotenzínII je jedným z faktorov prispievajúcich k rozvoju aterogenézy, inhibície apoptózy a zvýšeného oxidačného stresu v tkanivách, čím vyvoláva agregáciu krvných doštičiek a trombózu.
angiotenzínII je schopný posilniť funkciu myokardu, podieľa sa na biosyntéze norepinefrínu a iných fyziologicky aktívnych látok. Zároveň môže pôsobiť ako rastový faktor, čo vedie k vaskulárnej a srdcovej hypertrofii.
Niektoré zvieratá a ľudia angiotenzínII pod vplyvom enzýmu aminopeptidázy premenený na heptapeptid angiotenzínIII. U ľudí je hladina angiotenzínu II približne 4-krát vyššia ako hladina angiotenzínu III. Obe tieto zlúčeniny ovplyvňujú krvný tlak a produkciu aldosterónu a sú pomerne rýchlo degradované enzýmami. angiotenzinázu.
Pri závažných ochoreniach obličiek sprevádzaných ich ischémiou sa v dôsledku zvýšenej tvorby a sekrécie renínu pozoruje trvalé zvýšenie krvného tlaku ( renálna hypertenzia). Použitie ACE inhibítorov pri týchto stavoch vedie k rýchlej normalizácii krvného tlaku.
Na záver treba ešte raz zdôrazniť, že angiotenzín-renino-aldosterónový systém úzko súvisí s funkciou kalikreín-kinínového systému, pretože tvorba angiotenzínu II a deštrukcia bradykinínu prebieha pod jeho vplyvom. enzým - ACE.
Catad_theme Arteriálna hypertenzia- články
Catad_tema Obezita - články
Obezita a arteriálna hypertenzia
Publikované v časopise:PROBLÉMY ZDRAVIA ŽIEN № 4, ročník 3, 2008
E.I.Astashkin, M.G.Glezer
Moskovská lekárska akadémia. I. M. Sechenov
SÚHRN
Prehľad analyzuje úlohu obezity pri rozvoji arteriálnej hypertenzie a srdcovo-cievne ochorenia, patofyziologické mechanizmy tohto vzťahu, dominantná úloha systému renín-angiotenzín-aldosterón (RAAS). Rozoberá sa problematika farmakologickej korekcie vysokého krvného tlaku u obéznych pacientov fixnou kombináciou liekov blokujúcich RAAS a verapamilu. Uvádza sa analýza účinnosti a bezpečnosti použitia sibutramínu na zníženie hmotnosti u pacientov s vysokým krvným tlakom.
Kľúčové slová: obezita, arteriálna hypertenzia, liečba.
ABSTRAKT
Autori analyzovali úlohu obezity pri rozvoji arteriálnej hypertenzie a kardiovaskulárnych ochorení, patofyziologické mechanizmy tohto vzťahu a dominantnú úlohu systému renín-angiotenzín-aldosterón (RAAS). Ukázalo sa, že farmakologická korekcia vysokého krvného tlaku u pacientov s obezitou fixnou kombináciou blokátorov RAAS a verapamilu je účinná. Uvádza sa analýza účinnosti a bezpečnosti sibutramínu na zníženie hmotnosti u pacientov s vysokým krvným tlakom.
Kľúčové slová: obezita, arteriálna hypertenzia, liečba.
Aktuálnosť skúmanej témy je daná tým, že na celom svete v posledných rokoch výrazne pribúda obéznych ľudí. Obezita sa dnes považuje za jeden z hlavných faktorov prispievajúcich k rozvoju chorôb, ktoré sú hlavnými príčinami v štruktúre úmrtnosti dospelej populácie. Po prvé rozprávame sa o vývoji diabetes mellitus 2. typu, ako aj kardiovaskulárnych a onkologické ochorenia. Zvýšenie hmotnosti o 1 kg zvyšuje riziko kardiovaskulárnych ochorení o 3,1 % a cukrovky o 4,5 – 9 %.
Je známe, že pri obezite je riziko vzniku arteriálnej hypertenzie – faktora, ktorý výrazne ovplyvňuje aj výskyt srdcovo-cievnych ochorení, akými sú infarkt a mŕtvica – trikrát vyššie ako u ľudí s normálnou telesnou hmotnosťou. Ako sa ukázalo v štúdii INTERSALT, na každých 4,5 kg prírastku hmotnosti sa systolický krvný tlak (BP) zvýši o 4,5 mm Hg. čl. .
Obezita ako rizikový faktor u žien s arteriálnej hypertenzie, najmä vo vyššom veku, je častejšia ako u mužov. Jedným z dôvodov je hypoestrogénia, ktorá sa vyskytuje počas postmenopauzálneho obdobia. Zaznamenávajú sa niektoré znaky prevalencie obezity pri rôznych typoch arteriálnej hypertenzie. U starších žien s izolovanou systolickou hypertenziou je teda obezita menej častá a neexistujú žiadne údaje o vplyve úbytku hmotnosti na túto kategóriu pacientov. U žien s abdominálnou obezitou, so systolicko-diastolickými formami arteriálnej hypertenzie dochádza k úbytku hmotnosti dôležitý bod pri kontrole chorôb.
Pri obezite dochádza k množstvu hemodynamických zmien, najmä k zvýšeniu objemu cirkulujúcej krvi, tepového objemu a srdcového výdaja s relatívne normálnou cievnou rezistenciou. Predpokladá sa, že vysoký krvný tlak u obéznych pacientov je spôsobený najmä zvýšeným srdcovým výdajom s "nedostatočne normálnym" periférnym odporom.
Tento hemodynamický stav stimuluje dva antagonistické regulačné systémy, ktoré riadia objem krvi a periférny odpor- systém renín-angiotenzín-aldosterón (RAAS) a systém natriuretických peptidov srdca. Ich dysregulácia môže do značnej miery vysvetliť vysoký srdcový výdaj u obéznych hypertonikov. Okrem toho sa tieto kardiovaskulárne regulačné systémy podieľajú na metabolických zmenách spojených s nadmernou telesnou hmotnosťou pri kardiovaskulárnych ochoreniach.
Takže pri obezite v patogenéze arteriálnej hypertenzie hrajú významnú úlohu tri hlavné mechanizmy:
Patogenéza rozvoja arteriálnej hypertenzie a kardiovaskulárnych ochorení pri obezite je schematicky znázornená na obrázku 1.
Obrázok 1. Schéma patogenézy arteriálnej hypertenzie a kardiovaskulárnych ochorení pri obezite
Systémový a tkanivový renín-angiotenzín-aldosterónový systém a jeho zmeny pri obezite
Zloženie RAAS zahŕňa angiotenzinogén, renín, angiotenzín I, angiotenzín-konvertujúci enzým (ACE) a angiotenzín II (AT II). AT II má rôznorodý účinok na rôzne bunky, ktoré majú špecifické receptory.
Podľa klasických koncepcií sa angiotenzinogén tvorí v pečeni a vplyvom renínu syntetizovaného v periglomerulárnych bunkách obličiek (juxtaglomerulárne bunky) sa angiotenzinogén v krvi premieňa na angiotenzín I. ACE je zodpovedný za rozklad AT I, čo má za následok vznik AT II.
Je dôležité poznamenať, že pri obezite dochádza k porušeniu mechanizmov regulácie RAAS. Za fyziologických podmienok vedie zvýšenie aktivity RAAS k zvýšeniu rezistencie periférne cievy a v dôsledku toho zvýšenie krvného tlaku. Podľa princípu spätnej väzby by zvýšenie krvného tlaku malo spôsobiť zníženie sekrécie renínu, zníženie hladiny AT II a zníženie obsahu aldosterónu. To zase znižuje zadržiavanie tekutín a sodíka a udržiava krvný tlak na normálnej úrovni.
U pacientov s viscerálnou obezitou je však narušená regulácia hladiny systémových cirkulujúcich zložiek RAAS. Napriek zvýšenému krvnému tlaku, retencii sodíka a tekutín a zvýšeniu objemu cirkulujúcej krvi zostáva aktivita plazmatického renínu a aldosterónu normálna alebo dokonca mierne zvýšená. Takáto dysregulácia RAAS pri obezite môže byť spôsobená zvýšenou tvorbou zložiek RAAS a/alebo sekundárnym zvýšením ich koncentrácie v dôsledku defektov v natriuretickom peptidovom systéme.
Zistilo sa, že okrem krvného RAAS existuje tkanivo, alebo takzvaný lokálny RAAS, ktorý bol zistený v mnohých tkanivách a orgánoch, vrátane mozgu, srdca, ciev, obličiek, semenníkov, tukového tkaniva atď. .
Ako je známe, pri tvorbe AT II hrajú kľúčovú úlohu dva faktory: aktivita renínu a koncentrácia angiotenzinogénu. Syntéza a sekrécia angiotenzinogénu v bunkách iný typ nielenže určuje zvýšenie lokálnej koncentrácie AT II, ale tiež zvyšuje systémovú aktivitu RAAS. Chronická infúzia AT II myšiam bola sprevádzaná významným zvýšením obsahu angiotenzinogénnej mRNA v adipocytoch. Tieto výsledky naznačujú prítomnosť pozitívnej spätnej väzby medzi AT II a angiotenzinogénom, keď zvýšenie hladiny jedného činidla stimuluje tvorbu druhého. Pri obezite, najmä viscerálneho typu, plazmatická renínová aktivita pretrváva, ako už bolo uvedené, na normálnej alebo miernej úrovni. zvýšená hladina a hladiny angiotenzinogénu a AT II sú zvýšené.
Štruktúra a fyziologické vlastnosti tukového tkaniva
Tukové tkanivo je tvorené rôznymi typmi buniek, vrátane adipocytov, makrofágov, fibroblastov, vaskulárnych endotelových buniek a preadipocytov (adipoblastov). Posledný typ buniek pochádza z pluripotentných mezodermálnych kmeňových buniek. Z preadipocytov v tele dospelého človeka vznikajú nové diferencované („malé“) adipocyty. Tieto adipocyty sa zväčšujú ("veľké" adipocyty) v dôsledku zvýšeného príjmu potravy. mastné kyseliny. Mastné kyseliny s dlhým reťazcom vstupujú do adipocytov z krvi a ukladajú sa ako neutrálne triacylglyceroly. Tukové tkanivo je zodpovedné za ukladanie a vylučovanie mastných kyselín s dlhým reťazcom, ktoré pôsobia ako jeden z hlavných energetických substrátov pre mnohé orgány a tkanivá, ako sú srdcové a kostrové svaly. „Veľké“ adipocyty vylučujú podstatne viac nasýtených mastných kyselín. K hydrolýze triglyceridov a uvoľňovaniu mastných kyselín dochádza pod vplyvom intracelulárnej hormonálne senzitívnej lipázy, ktorej aktivita je riadená katecholamínmi (pozitívna regulácia) a inzulínom (negatívna regulácia).
Endokrinná aktivita tukového tkaniva
Na rozdiel od podkožného tuku, ktorý zvyčajne tvorí 75 % celkového tukového tkaniva tela a je hlavnou zásobárňou lipidov, sa v súčasnosti viscerálny tuk považuje za aktívne tkanivo produkujúce hormóny.
Adipocyty produkujú veľký rozsah hormóny a cytokíny zapojené do metabolizmu glukózy (adiponektín, rezistín atď.), lipidy (proteín prenášajúci estery cholesterolu), zápal (TNF-α, interleukín-6), koagulácia (inhibítor aktivátora plazminogénu-1), regulácia krvného tlaku (angiotenzinogén, AT II), stravovacie správanie(leptín), ako aj ovplyvňujúce metabolizmus a funkčnú aktivitu rôznych orgánov a tkanív, vrátane svalov, pečene, mozgu a krvných ciev (pozri tabuľku).
Tabuľka. endokrinná funkcia adipocyty: adipocytokíny
| Adipocytokíny | Účinky adipocytokínov |
| Leptín | Absorpcia potravy, tuková hmota |
| adiponektín | |
| odpor | Inzulínová rezistencia, zápal |
| Visfatin | rezistencia na inzulín |
| omentin | rezistencia na inzulín |
| Serpín uvoľnený z tukového viscerálneho tkaniva (Vaspin) | rezistencia na inzulín |
| Apelin | Vazodilatácia |
| Cholesterol ester transfer protein (CETP) | metabolizmus lipidov |
| Lipoproteínová lipáza (LPL) | metabolizmus lipidov |
| Hormonálne citlivá lipáza (HSL) | metabolizmus lipidov |
| Mastné kyseliny viažuce bielkoviny v adipocytoch-4 (A-FABP-4 (aP2)) | metabolizmus lipidov |
| Perlipin | metabolizmus lipidov |
| Renitol viažuci proteín (RBP) | metabolizmus lipidov |
| Proteín stimulujúca acylácia (ASP) | metabolizmus lipidov |
| Angiotenzín II (AT II) | Arteriálny tlak |
| Angiotenzín konvertujúci enzým (ACE) | Arteriálny tlak |
| Angiotenzinogén (AGT) | Arteriálny tlak |
| Tumor nekrotizujúci faktor alfa (TNF-a) | Zápal |
| Interleukín, 6 (IL-6) | Zápal |
| C-reaktívny proteín (CRP) | Zápal |
| Adipocytový trypsín/doplnkový faktor D (adipsín) | Zápal |
| Makrofágový chemoatraktant proteín-1 (MCP-1) | Atraktant pre makrofágy |
| Intercelulárna adhézna molekula-1 (ICAM-1) | Aktivácia makrofágov |
| Inhibítor aktivátora plazminogénu-1 (PAI-1) | fibrinolýza |
Je dôležité zdôrazniť, že aj malý nárast objemu viscerálny tuk zohráva významnú úlohu pri poruchách metabolizmu, regulácii vodnej a elektrolytovej rovnováhy a kardiovaskulárnych ochoreniach.
S nárastom hmoty tukového tkaniva sa zvyšuje obsah takmer všetkých adipokínov v krvi. Výnimkou je adiponektín, ktorého hladina za týchto podmienok spadá. Leptín a adiponektín sú v súčasnosti najviac skúmanými adipokínmi.
Leptín. K produkcii leptínu dochádza najmä vo „veľkých“ adipocytoch. Leptín je často vnímaný ako signálna molekula, ktorá sprostredkováva vzťah medzi príjmom živín, tukovým tkanivom a centrálnym nervovým systémom (hypotalamus). Leptín zvyšuje oxidáciu lipidov v pečeni ako aj lipolýzu v adipocytoch a kostrové svaly. Inzulín stimuluje produkciu leptínu. Hladinu leptínu ovplyvňujú aj voľné mastné kyseliny, TNF-α, estrogény a rastový hormón.
adiponektín. K tvorbe adiponektínu dochádza výlučne v adipocytoch. Adiponektín má rôzne biologické účinky - pôsobí antiaterogénne, zvyšuje citlivosť buniek na inzulín, inhibuje syntézu glukózy v pečeni, podporuje jej transport do svalov a zvyšuje oxidáciu mastných kyselín. Hladiny adiponektínu sú znížené pri obezite, inzulínovej rezistencii a diabetes mellitus 2. typu.
Aktivita tukového tkaniva a RAAS
Ukázalo sa, že tukové tkanivo je v tvorbe angiotenzinogénu na druhom mieste po pečeni. Napríklad množstvo mRNA angiotenzinogénu v adipocytoch je asi 70 % množstva v pečeni. Vzťah medzi hladinou angiotenzinogénu, obezitou a arteriálnou hypertenziou je jasne demonštrovaný v experimentoch na modeli transgénnych myší exprimujúcich nadmerné množstvo angiotenzinogénu v tukovom tkanive. Tieto myši majú viscerálnu obezitu a hypertenziu. Preadipocyty a diferencované tukové bunky majú kompletnú sadu komponentov potrebných na lokálnu syntézu AT II, ako aj AT 1 receptor pre AT II, ktorý zabezpečuje vnútrobunkový prenos aktivačných signálov spúšťaných AT II. Pri obezite sa objem viscerálnych diferencovaných adipocytov zvyšuje 20-30 krát. Obezita je charakterizovaná dysfunkciou adipocytov, čo je chápané ako zvýšenie tvorby a sekrécie rôznych adipokinov, cytokínov, ako aj zvýšenie obsahu zložiek RAAS predovšetkým vo viscerálnom tuku.
Zhrnutím údajov rôznych štúdií možno konštatovať, že s obezitou dochádza k zvýšeniu aktivity RAAS, čo sa odráža v nasledujúcich skutočnostiach:
vysoká aktivita RAAS zase vedie k nárastu hmoty tukového tkaniva. Konkrétne sa ukázalo, že transgénne myši nadmerne exprimujúce angiotenzinogén iba v tukových bunkách zvyšujú hladiny angiotenzinogénu v krvi, vyvíjajú sa hypertenzia a zvyšujú hmotnosť tukového tkaniva. Tkanivo AT II v podstate funguje ako rastový faktor pre adipocyty. AT II pôsobiaci na AT 1 receptory spôsobuje zvýšenie proteínu cyklínu D 1 , ktorý sa podieľa na regulácii rastu a delenia tukových buniek . Ukázalo sa, že AT II indukuje prechod G1 fázy bunkový cyklus v ľudských preadipocytoch. Tento účinok bol spojený s účinkom na ATi receptory a následnou aktiváciou cyklín D1-dependentnej kinázy.
Zistilo sa, že AT II spôsobuje diferenciáciu preadipocytov, aktivuje kľúčové enzýmy tvorby lipidov (lipogenézu) a zvyšuje akumuláciu triglyceridov v adipocytoch.
Viscerálna obezita je sprevádzaná zvýšením aktivity 11-beta-hydroxysteroid dehydrogenázy typu 1, čo vedie k tvorbe kortizolu, kľúčového hormónu pri diferenciácii preadipocytov na adipocyty.
Aktivita tkanivového RAS úzko súvisí s produkciou adipokínov tukovým tkanivom. Napríklad sa ukázalo, že AT II indukuje expresiu leptínu v adipocytoch. Predpokladá sa, že takáto aktivita je charakteristická len pre lokálne syntetizovaný AT II, na rozdiel od systémového AT II.
Obezita a činnosť sympatického nervového systému
Pri obezite, najmä pri jej abdominálnom variante, sa veľmi často pozoruje aktivácia sympatického nervového systému. Normotesive Ageing Study (NAS) zistila zvýšenie hladiny norepinefrínu v moči úmerné indexu telesnej hmotnosti. S úbytkom hmotnosti klesá aktivita sympatického nervového systému.
Zvýšená aktivita sympatického nervového systému pri obezite prispieva k prítomnosti hyperinzulinémie a inzulínovej rezistencie. Inzulín môže sám o sebe zvýšiť aktivitu sympatoadrenálneho systému, ale to môže byť čiastočne spôsobené pôsobením leptínu. Je známe, že so zvyšujúcim sa stupňom obezity sa zvyšuje hladina leptínu, ktorý je vylučovaný adipocytmi. Leptín zvyšuje aktivitu sympatického nervového systému, najmä v obličkách. To vedie na jednej strane k vysokému výdaju a zvýšeniu srdcovej frekvencie a na druhej strane k zvýšeniu reabsorpcie sodíka a zvýšeniu intravaskulárneho objemu krvi.
Bola preukázaná prítomnosť vzťahu medzi RAAS a sympatickým nervovým systémom. Zvýšenie sekrécie renínu v obličkách je spojené s aktiváciou sympatického nervového systému, a to bez ohľadu na intrarenálny zmyslový systém regulácia sekrécie renínu obličkami. Okrem toho zvýšenie cyklického adenozínmonofosfátu pod vplyvom katecholamínov stimuluje expresiu angiotenzinogénu v ľudských adipocytoch. Zvýšenie hladiny AT II zvyšuje aktivitu sympatického nervového systému u ľudí. Zistilo sa, že AT II aktivuje lokálny sympatický nervový systém, ktorý sa podieľa na zvýšení telesnej teploty (termogenéze). Liečba chladom vedie k zvýšeniu obsahu AT II v adipocytoch bez súčasnej zmeny hladiny AT II v plazme.
Dysregulácia RAAS pri obezite je teda schopná stimulovať aj aktivitu sympatického nervového systému.
Metódy farmakologickej korekcie zvýšeného krvného tlaku pri obezite
Príspevok rôznych patogenetických mechanizmov k udržaniu vysokého krvného tlaku pri obezite môže byť rôzny. Preto v tejto situácii môžu mať antihypertenzíva s rôznymi mechanizmami účinku priaznivý účinok.
V súlade s aktuálnymi odporúčaniami pre liečbu arteriálnej hypertenzie je kľúčom k úspechu výrazného zníženia krvného tlaku použitie kombinovanej liečby. U pacientov s obezitou by hlavné zložky takejto terapie mali v prvom rade obsahovať kombináciu liekov, ktoré znižujú aktivitu RAAS (ACE inhibítory a sartany), liekov, ktoré znižujú aktivitu sympatiku (β-blokátory a nedihydropyridínové antagonisty vápnika) a diuretiká. Vysoká účinnosť Použitie liekov, ktoré blokujú RAAS pri obezite, bolo preukázané v mnohých štúdiách. Čo sa týka použitia β-blokátorov, údaje sú veľmi rozporuplné, a to predovšetkým z dôvodu pochybností o ich užitočnosti pri liečbe pacientov s nekomplikovanou arteriálnou hypertenziou a v druhom rade z dôvodu, že β-blokátory, prinajmenšom klasické, môžu zvýšiť hmotnosť pacientov a zvýšenie inzulínovej rezistencie. Ak sa teda na liečbu pacientov s obezitou alebo metabolickým syndrómom vyberú β-blokátory, potom by to mali byť lieky so špeciálnymi vlastnosťami, najmä karvedilol a nebivolol.
Zároveň sa zistilo, že nedihydropyridínový antagonista vápnika verapamil môže nielen výrazne znížiť krvný tlak, ale aj znížiť aktivitu sympatického nervového systému.
V prípade obezity sa teda na liečbu arteriálnej hypertenzie môže použiť kombinácia liekov blokujúcich RAAS a verapamilu.
Je potrebné zdôrazniť, že tento typ kombinácie lieky existuje vo forme hotového kombinovaného lieková forma- liek Tarka, obsahujúci vo svojom zložení ACE inhibítor rozpustný v tukoch - trandolapril a verapamil s pomalým uvoľňovaním (verapamil SR). Tento prístup je veľmi dôležitý pre účinnú terapiu, pretože použitie hotových liekových foriem zlepšuje adherenciu pacienta k liečbe.
Existujú dôkazy, že Tarka znižuje krvný tlak vo väčšej miere ako ktorákoľvek z jej zložiek, má výraznú schopnosť znižovať hypertrofiu ľavej komory, prispieva k normalizácii endotelovej funkcie a je metabolicky neutrálna, dokonca aj u pacientov s diabetes mellitus.
dvojitá akcia- zníženie aktivity RAAS pod vplyvom trandolaprilu a sympatického nervového systému v dôsledku predĺženého účinku verapamilu - má významný vplyv na patogenetické mechanizmy rozvoj arteriálnej hypertenzie pri obezite a mechanizmy, ktoré vyvolávajú poškodenie cieľových orgánov pri tomto type hypertenzie.
Pri diskusii o liečbe hypertenzie pri obezite je potrebné venovať osobitnú pozornosť skutočnosti, že terapia založená na kombinácii trandalaprilu s dlhodobo pôsobiacim verapamilom môže znížiť riziko vzniku diabetes mellitus v porovnaní s použitím inej liečebnej taktiky - kombinácie sartanu s nízkou dávkou tiazidového diuretika. Výsledky štúdie STAR jasne ukazujú, že pri užívaní Tarky po dobu jedného roka vzniká menej ľudí s metabolickým syndrómom, v ktorom má dominantnú úlohu abdominálna obezita. cukrovka(obr. 2).
Obrázok 2. Vývoj nových prípadov diabetes mellitus (glukóza nalačno > 126 mg/dl alebo 2-hodinový glukózový tolerančný test > 200 mg/dl) podľa typu antihypertenznej liečby u ľudí s metabolickým syndrómom v štúdii STAR

Navyše, podľa štúdie STAR-LET, aj keď sa diabetes mellitus vyskytuje na pozadí o medikamentózna terapia presun týchto pacientov na príjem lieku Tarka umožnil polovici pacientov normalizovať sa metabolizmus uhľohydrátov.
Na základe výsledkov týchto štúdií je potrebné prehodnotiť odporúčania pre medikamentózna terapia hypertenzie u osôb s metabolickým syndrómom a začať liečbu kombináciou obsahujúcou inhibítor ACE (alebo sartan) a antagonistu vápnika alebo previesť pacientov na takúto liečbu.
Ako už bolo viackrát spomenuté, pri liečbe arteriálnej hypertenzie hrá dôležitú úlohu znižovanie hmotnosti pacientov a stupňa abdominálnej obezity. Samozrejme, chudnutie tak či onak môže mať významný vplyv na zníženie výskytu kardiovaskulárnych ochorení. V súčasnosti existujú rôzne prístupy k medikamentóznej terapii obezity. Prvým je symptomatická liečba, menovite zníženie počtu spotrebovaných kalórií znížením absorpcie tuku z potravy. Takýto prístup možno nazvať kompenzačným. Pri takejto terapii sa ochorenie skutočne neodstráni (keďže pacient sa naďalej prejedá), ale liekom sa len dočasne kompenzuje. Ďalším prístupom k liečbe nadváhy a obezity je riešiť koreň problému, a to chronické prejedanie sa. Takto funguje sibutramín (liek od Meridie). Vedie k nástupu rýchlej saturácie, znižuje množstvo skonzumovanej potravy potlačením spätného vychytávania norepinefrínu a serotonínu v synapsiách neurónových okruhov. Dnes je Meridia jediná originálny liek odstránenie príčiny obezity.
Zásadný rozdiel medzi sibutramínom je v tom, že bez toho, aby spôsobil zníženie chuti do jedla, prispieva k skoršiemu nástupu pocitu sýtosti. Človek sa zbaví patologického zvyku prejedať sa, čo má za následok postupné a trvalé znižovanie telesnej hmotnosti. Pod vplyvom sibutramínu sa príjem potravy zníži asi o 20 %. Spolu s tým sibutramín nepriamo ovplyvňuje hladinu biogénnych amínov v krvi, ktoré aktivujú adrenoreceptory v tukovom tkanive a iniciujú lipolýzu v adipocytoch, čo je sprevádzané zmenou obsahu energetických substrátov v krvi. Sibutramín v dôsledku aktivácie β 2 - a β 3 - adrenergných receptorov zosilňuje procesy termogenézy a zvyšuje spotrebu energie v tele.
Klinická účinnosť a bezpečnosť sibutramínu (Meridia) bola preukázaná v vo veľkom počte multicentrické štúdie. Najmä v štúdii STORM (Sibutramin Trial on Obesity Reduction and Maintenance), ktorá zahŕňala 605 obéznych pacientov, sa ukázalo, že dvojročný príjem sibutramínu znížil hmotnosť pacientov 3-krát a obvod pása - 2-krát viac. výraznejšie ako placebo.. Dôležité je, že 80 % pacientov si udržalo úbytok hmotnosti počas dvoch rokov v porovnaní so 16 % pacientov s placebom (str< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов vysoká hustota zvýšil o 21 % so znížením hladín lipoproteínov s nízkou hustotou a triglyceridov.
Pozitívnym efektom redukcie hmotnosti pri liečbe pacientov s arteriálnou hypertenziou a inými kardiovaskulárnymi ochoreniami môže byť aj to, že redukciou intraabdominálneho tuku sa môže znížiť mechanická kompresia obličiek, čo môže viesť k zlepšeniu ich prekrvenia a zníženie aktivity RAAS. Redukcia tukového tkaniva v obličkách a okolo nich môže viesť k zníženiu intersticiálneho tlaku, stlačeniu tenkej časti Henleyovej slučky, zvýšeniu prietoku krvi vo vasa recta a zníženiu tubulárnej reabsorpcie Na + a vody. Takže strata hmotnosti spôsobená metódami neliekovej alebo liekovej korekcie môže znížiť výšku krvného tlaku.
Avšak až donedávna v reálnom klinickej praxi sibutramín sa používal opatrne, pretože sa obával, že je to možné negatívny vplyv na krvný tlak a srdcovú frekvenciu, čo by naopak mohlo viesť, aj keď u malého počtu pacientov, k nepríjemným subjektívne pocity. Na štúdium účinku sibutramínu na kardiovaskulárny systém a dokázanie bezpečnosti lieku na skupine pacientov so zvýšeným rizikom kardiovaskulárnych ochorení bola realizovaná rozsiahla multicentrická, dvojito zaslepená, placebom kontrolovaná medzinárodná štúdia SCOUT (Sibutramin Cardiovascular OUTcomes), kde bolo pozorovaných 10 742 pacientov, z ktorých 97 % malo choroby kardiovaskulárneho systému, 88 - arteriálna hypertenzia a 84% - diabetes mellitus 2. typu. Podľa výsledkov prvej ukončenej fázy štúdie sa zistilo, že vymenovanie sibutramínu viedlo k významnému (p.< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
Prirodzene vzniká otázka, ako bude ten či onen typ antihypertenzívnej terapie korelovať s liečbou sibutramínom. Na zodpovedanie tejto otázky bolo vykonaných niekoľko štúdií. Napríklad sa ukázalo, že použitie kombinovanej liekovej formy obsahujúcej verapamil 180 mg / trandolapril 2 mg v kombinácii so sibutramínom 10 mg viedlo k výraznejšiemu poklesu krvného tlaku v priebehu 6 mesiacov ako samotná antihypertenzívna liečba - znížil sa systolický krvný tlak, o 21,9 ± 8,1 oproti 15,9 ± 12,3 mm Hg. čl. a diastolický - o 15,7 ± 8,1 oproti 9,1 ± 9,9 mm Hg. čl. (p = 0,03). Kombinovaná liečba viedla aj k výraznejšiemu zlepšeniu antropometrických parametrov; spoľahlivý (str<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
V prospektívnej, multicentrickej, placebom kontrolovanej, dvojito zaslepenej štúdii HOS (Hypertension-Obesity-Sibutramin) počas 16 týždňov sa porovnala účinnosť rôznych antihypertenzných režimov (felodipín 5 mg / ramipril 5 mg (n = 57) verapamil 180 mg/deň), trandolapril 2 mg (n = 55), metoprolol sukcinát 95 mg/hydrochlorotiazid 12,5 mg n = 59) so sibutramínom a placebom. V tejto štúdii sa potvrdilo, že sibutramín môže zvyšovať krvný tlak. Preto je samozrejme potrebné adekvátne viesť antihypertenzívnu liečbu počas obdobia užívania sibutramínu u pacientov s arteriálnou hypertenziou. Ukázalo sa tiež, že pri liečbe kombináciou β-blokátora a hydrochlorotiazidu boli pozitívne účinky sibutramínu na chudnutie, obvod pása a vplyv na metabolický profil výrazne menej výrazné ako pri kombinácii kombinovanej liečby s ACE. inhibítory a antagonisty vápnika so sibutramínom. To opäť potvrdzuje potrebu starostlivého výberu antihypertenzívnej liečby u pacientov s obezitou, najmä pri realizácii programov zameraných na zníženie hmotnosti. Na záver treba uviesť, že z nášho pohľadu jedným z významných problémov, ktoré znižujú efektivitu boja proti obezite, je to, že lekári ani verejnosť nepovažujú obezitu za významný rizikový faktor. Okrem toho sa pacienti často nehodnotia ako obézni. Napríklad v štúdii POLONEZ bola podľa hodnotenia lekárov na základe BMI obezita u mužov aj žien zaznamenaná trikrát častejšie ako u pacientov, ktorí sami uviedli. Preto by sa medzi obyvateľstvom mala posilniť a vykonávať vysvetľujúca práca o potrebe predchádzať prírastku hmotnosti, náprave existujúcej obezity a dôležitosti nepretržitej liečby arteriálnej hypertenzie. LITERATÚRA
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. Prevalencia a trendy obezity medzi dospelými v USA, 1999-2000. JAMA 2002; 288:1723-7.
2. Pi-Sunyer F.X. Epidemiológia centrálnej distribúcie tuku vo vzťahu k chorobe. Nutr Rev 2004; 62(7): 120-6.
3. Arbeeny C.M. Riešenie nenaplnenej lekárskej potreby bezpečných a účinných terapií na zníženie hmotnosti. Obes Res 2004; 12(8): 1191-6.
4. Stamler J., Rose G., Stamler R. a kol. Výsledky štúdie INTERSALT. Dôsledky verejného zdravia a lekárskej starostlivosti. Hypertenzia 1989; 14(5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. Nadváha a hypertenzia u starších ľudí – výsledky komunitnej štúdie. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., a kol. Zníženie intraabdominálneho viscerálneho tuku môže znížiť krvný tlak u obéznych hypertonikov. Hypertension 1996; 27(1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., a kol. American Heart Association; Výbor pre obezitu Rady pre výživu, fyzickú aktivitu a metabolizmus. Obezita a kardiovaskulárne choroby: patofyziológia, hodnotenie a účinok chudnutia: aktualizácia vedeckého vyhlásenia American Heart Association z roku 1997 o obezite a srdcových chorobách od Výboru pre obezitu Rady pre výživu, fyzickú aktivitu a metabolizmus. Náklad 2006; 113: 898-918.
8 Alpert M.A. Obezita kardiomyopatia; patofyziológia a vývoj klinického syndrómu. Am J Med Sci 2001; 321:225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. Hypertenzia a obezita. Nedávny program Progr Horm Res 2004; 59:169-205.
10. Engeli S., Sharma A.M. Systém renín-angiotenzín a natriuretické peptidy pri hypertenzii spojenej s obezitou. J Mol Med 2001; 79:21-9.
11. Lafontan M., Moro C., Sengenes C., a kol. Nepredpokladaná metabolická úloha atriálnych natriuretických peptidov: kontrola lipolýzy, mobilizácie lipidov a systémových hladín neesterifikovaných mastných kyselín u ľudí. Arterioscler Thromb Vasc Biol 2005; 25:2032-42.
12. Hala J.E. Obličky, hypertenzia a obezita. Hypertenzia 2003; 41(3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., a kol. ACE, angiotenzinogén a obezita: potenciálna cesta vedúca k hypertenzii. J Hum Hypertens 1997; 11:107-11.
14. Lu H., Boustany-Kari C.M., Daugherty A., Cassis L.A. Angiotenzín II zvyšuje expresiu tukového angiotenzinogénu. Am J Physiol Endocrinol Metab 2007; 292:1280-7.
15. Engeli S., Negrel R., Sharma A.M. Fyziológia a patofyziológia renín-angiotenzínového systému tukového tkaniva. Hypertenzia 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. Vývoj tukového tkaniva: od kmeňových buniek k adipocytom. Crit Rev Biochem Mol Biol 2005; 40:229-42.
17. Hajer G.R., van Haeften T.W., Viseren F.L.J. Dysfunkcia tukového tkaniva pri obezite, cukrovke a cievnych ochoreniach. Eur Heart J 2008; 29:2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A. a kol. Adipokíny a riziko cukrovky 2. typu u starších mužov. Diabetes Core 2007; 30:1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., a kol. Hladiny plazmatického inzulínu, leptínu a rozpustného TNF receptora vo vzťahu k rizikovým faktorom aterogénnych a trombogénnych kardiovaskulárnych ochorení u mužov súvisiacimi s obezitou. Ateroskleróza 2001; 157:495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. Vzťah medzi veľkosťou adipocytov a expresiou a sekréciou adipokínu. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T., Fukui T. a kol. Infúzia angiotenzínu II znižuje hladinu adiponektínu v plazme prostredníctvom svojho receptora typu 1 u potkanov: dôsledok inzulínovej rezistencie súvisiacej s hypertenziou. Metabolizmus 2006; 55:478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et al. Koncentrácia imunoreaktívneho leptínu v sére u ľudí s normálnou hmotnosťou a obéznych ľudí. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., a kol. Kontrola príjmu potravy centrálnym nervovým systémom. Nature 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. Proopiomelanokortínové neuróny sú priamymi cieľmi pre leptrín v hypotalame. Endokrinológia 1997; 138; 4489-92.
25 Long Y.C., Zierath J.R. AMP-aktivovaná proteínkinázová signalizácia v metabolickej regulácii. J Clin Invest 2006; 116:1776-83.
26. Saladin R., De Vos P., Guerre-Millo M. a kol. Prechodné zvýšenie expresie obéznych génov po podaní jedla alebo inzulínu. Nature 1995; 377:527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. Tumor nekrotizujúci faktor-alfa má dvojaký účinok na syntézu a uvoľňovanie ľudského tukového leptínu. Mol Cell Endocrinol 2000; 159:79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., a kol. Adiponektín a vývoj cukrovky typu 2 v indickej populácii Pima. Lancet 2002; 360:57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et al. Nízke plazmatické hladiny adiponektínu sú spojené s nízkym rizikom budúcich kardiovaskulárnych príhod u pacientov s klinicky evidentným vaskulárnym ochorením. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D. a kol. Tukový angiotenzinogén sa podieľa na raste tukového tkaniva a regulácii krvného tlaku. FASEB J 2001; 15:2727-9.
31. Paul M., Mehr A.P., Kreutz R. Fyziológia lokálnych renín-angiotenzínových systémov. Physiol Rev 2006; 86:747-803.
32. Karlsson C., Lindell K., Ottosson M. a kol. Ľudské tukové tkanivo exprimuje angiotenzinogén a enzýmy potrebné na jeho konverziu na angiotenzín II. J Clin Endocrinol Metab 1998; 83:3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. Hormonálna regulácia renín-angiotenzínového systému ľudského tukového tkaniva: vzťah k obezite a hypertenzii. J Hypertens 2002; 20:965-73.
34. Engeli S., Gorzelniak K., Kreutz R., a kol. Koexpresia génov renín-angiotenzínového systému v ľudskom tukovom tkanive. J Hypertens 1999; 17:555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R. a kol. Expresia renínového receptora v ľudskom tukovom tkanive. Am J Physiol Regul Integr Comp Physiol 2007; 292:274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Renín-angiotenzínový systém, natriuretické peptidy, obezita, metabolický syndróm a hypertenzia: integrovaný pohľad u človeka. J Hypertens 2008; 26:831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., a kol. Receptory angiotenzínu II v ľudských preadipocytoch: úloha v regulácii bunkového cyklu. Endokrinológia 1999; 140:154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G. a kol. Angiotenzín II ako trofický faktor bieleho tukového tkaniva: stimulácia tvorby tukových buniek. Endokrinológia 2001; 142:487-92.
39. Watanabe G., Lee R.J., Albanese C., a kol. Aktivácia aktivity kinázy závislej od cyklínu D1 angiotenzínom II. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. Diferenciácia preadipóznych buniek: parakrinná úloha prostacyklínu pri stimulácii tukových buniek angiotenzínom-II. Endokrinológia 1994; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotenzín II zvyšuje lipogenézu v 3T3-L1 a ľudských tukových bunkách. Endokrinológia 1997; 138:1512-9.
42. Wake D.J., Walker B.R. Inhibícia 11beta-hydroxysteroid dehydrogenázy typu 1 pri obezite. Endokrinné 2006; 29:101-8.
43. Engeli S., Bohnke J., Feldpausch M. a kol. Regulácia génov 11beta-HSD v ľudskom tukovom tkanive: vplyv centrálnej obezity a chudnutia. Obes Res 2004; 12:9-17.
44. Kim S., Whelan J., Claycombe K. a kol. Angiotenzín II zvyšuje sekréciu leptínu 3T3-L1 a ľudskými adipocytmi prostredníctvom mechanizmu nezávislého od prostaglandínov. J Nutr 2002; 132:1135-40.
45. Cassis L.A., anglický V.L., Bharadwaj K., Boustany C.M. Diferenciálne účinky lokálneho verzus systémového angiotenzínu II pri regulácii uvoľňovania leptínu z adipocytov. Endokrinológia 2004; 145:169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et al. Sympatický nervový systém a metabolický syndróm. J Hypertens 2007; 25:909-20.
47. Tentolouris N., Liatis S., Katsilambros N. Aktivita sympatického systému pri obezite a metabolickom syndróme. Ann N Y Acad Sci 2006; 1083:129-52.
48. Landsberg L., Troisi R., Parker D. a kol. Obezita, krvný tlak a sympatický nervový systém. Ann Epidemiol 1991; 1:295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. Expresia a sekrécia génu ľudského tukového angiotenzinogénu sú stimulované cyklickým AMP prostredníctvom zvýšenej väzbovej aktivity prvku DNA cyklického AMP. Endokrinné 2004; 25:97-104.
50. Cassis L.A. Úloha angiotenzínu II v termogenéze hnedého tuku počas aklimatizácie na chlad. Am J Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. Presynaptická modulácia uvoľňovania neurotransmiterov endogénnym angiotenzínom II v hnedom tukovom tkanive. J Neural Transm 1991; 34:129-37.
52. Reisin E., Weir M., Falkner B. a kol. Lizinopril versus hydrochlorotiazid u obéznych pacientov s hypertenziou: multicentrická placebom kontrolovaná štúdia. Liečba obéznych pacientov s hypertenziou (TROPHY) študijná skupina. Hypertension 1997; 30(1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., a kol. Účinnosť a bezpečnosť nízkych a vysokých dávok fixných kombinácií irbesartan/hydrochlorotiazid u pacientov s nekontrolovaným systolickým krvným tlakom pri monoterapii: štúdia INCLUSIVE. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. v mene výskumnej skupiny „ECO“. Multicentrická, randomizovaná, otvorená štúdia účinnosti zmien životného štýlu a liečby ACE inhibítormi (quinapril) u obéznych pacientov s arteriálnou hypertenziou (IVF). Arteriálna hypertenzia 2003; 9(6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. Antihypertenzívna liečba a citlivosť na inzulín: musíme predefinovať úlohu beta-blokátorov? Am J Hypertens 1998; 11(10): 1258-65.
56. Kaaja R., Kujala S., Manhem K., et al. Účinky sympatolytickej liečby na indexy citlivosti na inzulín u hypertenzných žien po menopauze. Int J Clin Pharmacol Ther 2007; 45(7): 394-401.
57. Kuperstein R., Sasson Z. Účinky antihypertenznej terapie na metabolizmus glukózy a inzulínu a na hmotu ľavej komory: randomizovaná, dvojito zaslepená, kontrolovaná štúdia 21 obéznych hypertonikov. Náklad 2000; 102(15): 1802-6.
58. Halperin A.K., Cubeddu L.X. Úloha blokátorov vápnikových kanálov pri liečbe hypertenzie. Am Heart J 1986; 111(2): 363-82.
59. McAllister R.G. ml. Klinická farmakológia látok blokujúcich pomalé kanály. Prog Cardiovasc Dis 1982; 25(2): 83-102.
60. Binggeli C., Corti R., Sudano I. a kol. Účinky chronickej blokády vápnikového kanála na aktivitu sympatického nervu pri hypertenzii. Hypertenzia 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K. a kol. Účinky tried antagonistov vápnika dihydropyridínu a fenylalkylamínu na autonómnu funkciu pri hypertenzii: štúdia VAMPHYRE. Am J Hypertens 2001; 14(11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. Vzory compliance pacientov liečených 2 samostatnými antihypertenzívami oproti kombinovanej terapii s fixnou dávkou Am J Hypertens 2004; 175:223.
63. Dezii C.M. Retrospektívna štúdia perzistencie s jednopilulkovou kombinovanou liečbou vs. súbežná terapia dvomi tabletami u pacientov s hypertenziou. Starostlivosť o manažment. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. Vzory priľnavosti medzi pacientmi liečenými kombináciou fixnej dávky oproti samostatným antihypertenzívam. Am J Health Syst Pharm 2007; 64(12): 1279-83.
65. Jackson K. Pretrvávanie fixnej versus voľnej kombinácie s valsartanom a HCTZ u pacientov s hypertenziou. Príloha pre zdravie hodnoty 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. Kardiovaskulárne účinky kombinácie trandolapril / verapamil u pacientov s miernou až stredne ťažkou esenciálnou hypertenziou. Am J Cardiol 1997; 79(6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. Trandolapril / verapamil s predĺženým uvoľňovaním: prehľad jeho použitia pri liečbe esenciálnej hypertenzie. Drugs 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. Manažment hypertenzie u diabetických pacientov – zameranie na kombináciu trandolapril/verapamil. Vasc Manažment zdravotných rizík 2007; 3(4): 453-65.
69. Bakris G., Molitch M., Hewkin A., a kol. Rozdiely v tolerancii glukózy medzi kombináciami fixných dávok antihypertenzív u ľudí s metabolickým syndrómom. Diabetes Care 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., a kol. Zvrátenie poruchy glukózovej tolerancie spojenej s diuretikami a novovzniknutý diabetes: výsledky štúdie STAR-LET. J Cardiometab Syndr 2008; 3(1): 18-25.
71. Bailey C.J., Deň C. Nové farmakologické prístupy k obezite. Prax obezity 2005; 1:2-5.
72. Yanovski S.Z., Yanovski J.A.Y. obezita. N Engl J Med 2002; 346(8): 591-602.
73. Deň C., Bailey C.J. Aktualizácia sibutramínu. Br J Diabetes Vasc Dis 2002; 2:392-7.
74. James W.P., Astrup A., Finer N., a kol. Účinok sibutramínu na udržanie hmotnosti po strate hmotnosti: randomizovaná štúdia. Študijná skupina STORM. Sibutramínová skúška na zníženie a udržiavanie obezity. Lancet 2000; 356:2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W., a kol. Kardiovaskulárne reakcie na riadenie hmotnosti a sibutramín u vysokorizikových subjektov: analýza zo štúdie SCOUT. Eur Heart J 2007; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W., a kol. Zmeny krvného tlaku spojené so sibutramínom a reguláciou hmotnosti – analýza zo 6-týždňového úvodného obdobia štúdie sibutramínových kardiovaskulárnych výsledkov (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., a kol. Účinky kombinácie sibutramín plus verapamil s predĺženým uvoľňovaním/trandolaprilom na krvný tlak a metabolické premenné u obéznych pacientov s hypertenziou. Expert Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., a kol. Optimálna liečba hypertenzie súvisiacej s obezitou: štúdia Hypertension-Obesity-Sibutramin (HOS). Náklad 2007; 115(15): 1991-8.
79. Glezer M.G. Výsledky ruskej štúdie POLONEZ (ÚČINNOSŤ A BEZPEČNOSŤ ENARENÁLU U PACIENTOV S ARTERIÁLNOU HYPERTENZIOU). Terapeutický archív 2006; 4:44-50.
Pre citáciu: Leonová M.V. Nové a sľubné lieky, ktoré blokujú systém renín-angiotenzín-aldosterón // RMJ. Lekárska recenzia. 2013. Číslo 17. S. 886
Úloha renín-angiotenzín-aldosterónového systému (RAAS) pri vzniku arteriálnej hypertenzie (AH) a iných kardiovaskulárnych ochorení sa v súčasnosti považuje za dominantnú. V kardiovaskulárnom kontinuu patrí medzi rizikové faktory hypertenzia a hlavným patofyziologickým mechanizmom poškodenia kardiovaskulárneho systému je angiotenzín II (ATII). ATII je kľúčovou zložkou RAAS - efektor, ktorý realizuje vazokonstrikciu, retenciu sodíka, aktiváciu sympatického nervového systému, bunkovú proliferáciu a hypertrofiu, rozvoj oxidačného stresu a zápal cievnej steny.
V súčasnosti už boli vyvinuté a klinicky široko používané dve skupiny liekov, ktoré blokujú RAAS – ACE inhibítory a blokátory ATII receptorov. Farmakologické a klinické účinky týchto tried sa líšia. ACE je zinková metaloproteináza peptidáza, ktorá metabolizuje ATI, AT1-7, bradykinín, substanciu P a mnoho ďalších peptidov. Mechanizmus účinku ACE inhibítorov je spojený najmä s prevenciou tvorby ATII, ktorá podporuje vazodilatáciu, natriurézu a eliminuje prozápalové, proliferatívne a iné účinky ATII. Okrem toho ACE inhibítory zabraňujú degradácii bradykinínu a zvyšujú jeho hladinu. Bradykinín je silný vazodilatátor, potencuje natriurézu, a čo je najdôležitejšie, má kardioprotektívny (zabraňuje hypertrofii, znižuje ischemické poškodenie myokardu, zlepšuje zásobovanie koronárnymi cievami) a vazoprotektívny účinok, zlepšuje funkciu endotelu. Vysoká hladina bradykinínu je zároveň príčinou rozvoja angioedému, ktorý je jednou z vážnych nevýhod ACE inhibítorov, ktoré výrazne zvyšujú hladinu kinínov.
ACE inhibítory nie sú vždy schopné úplne blokovať tvorbu ATII v tkanivách. Teraz sa zistilo, že na jeho transformácii v tkanivách sa môžu podieľať aj iné enzýmy, ktoré nie sú spojené s ACE, predovšetkým endopeptidázy, ktoré nie sú ovplyvnené ACE inhibítormi. V dôsledku toho ACE inhibítory nedokážu úplne eliminovať účinky ATII, čo môže byť dôvodom ich nedostatočnej účinnosti.
Riešenie tohto problému bolo uľahčené objavením receptorov ATII a prvej triedy liekov, ktoré selektívne blokujú receptory AT1. Prostredníctvom AT1 receptorov sa realizujú nepriaznivé účinky ATII: vazokonstrikcia, sekrécia aldosterónu, vazopresínu, norepinefrínu, retencia tekutín, proliferácia buniek hladkého svalstva a kardiomyocytov, aktivácia SAS, ako aj mechanizmus negatívnej spätnej väzby - tvorba renínu . AT2 receptory vykonávajú "prospešné" funkcie, ako je vazodilatácia, reparačné a regeneračné procesy, antiproliferatívny účinok, diferenciácia a vývoj embryonálnych tkanív. Klinické účinky blokátorov ATII receptorov sú sprostredkované elimináciou „škodlivých“ účinkov ATII na úrovni AT1 receptorov, čo poskytuje kompletnejšie blokovanie nežiaducich účinkov ATII a zvýšenie účinku ATII na AT2 receptory. , ktorý dopĺňa vazodilatačné a antiproliferatívne účinky. Blokátory ATII receptorov majú špecifický účinok na RAAS bez toho, aby zasahovali do kinínového systému. Nedostatok ovplyvnenia aktivity kinínového systému na jednej strane znižuje závažnosť nežiaducich účinkov (kašeľ, angioedém), na druhej strane však zbavuje blokátory ATII receptorov dôležitého antiischemického a vazoprotektívneho účinku, čo ich odlišuje od ACE inhibítorov. Z tohto dôvodu indikácie na použitie blokátorov receptorov ATII vo väčšine opakujú indikácie na vymenovanie ACE inhibítorov, čo z nich robí alternatívne lieky.
Napriek zavedeniu blokátorov RAAS do rozšírenej praxe liečby hypertenzie pretrvávajú problémy so zlepšovaním výsledkov a prognózou. Patria sem: možnosť zlepšenia kontroly krvného tlaku v populácii, účinnosť liečby rezistentnej hypertenzie, možnosť ďalšieho zníženia rizika kardiovaskulárnych ochorení.
Hľadanie nových spôsobov, ako ovplyvniť RAAS, aktívne pokračuje; skúmajú sa ďalšie úzko interagujúce systémy a vyvíjajú sa lieky s viacerými mechanizmami účinku, ako sú inhibítory ACE a neutrálnej endopeptidázy (NEP), enzým konvertujúci endotelín (EPF) a inhibítory NEP, inhibítory ACE/NEP/EPF.
Inhibítory vazopeptidázy
K vazopeptidázám patria okrem dobre známeho ACE aj ďalšie 2 metaloproteinázy zinku – neprilyzín (neutrálna endopeptidáza, NEP) a enzým konvertujúci endotelín, ktoré môžu byť tiež terčom farmakologických účinkov.
Neprilyzín je enzým produkovaný vaskulárnym endotelom a podieľa sa na degradácii natriuretického peptidu, ako aj bradykinínu.
Natriuretický peptidový systém predstavujú tri rôzne izoformy: atriálny natriuretický peptid (typ A), mozgový natriuretický peptid (typ B), ktoré sa syntetizujú v predsieni a myokarde, a endoteliálny C-peptid, ktoré sú endogénnymi inhibítormi RAAS v ich biologické funkcie a endotelín-1 (tabuľka 1). Kardiovaskulárne a renálne účinky natriuretického peptidu spočívajú v znížení krvného tlaku prostredníctvom účinku na vaskulárny tonus a rovnováhu vody a elektrolytov, ako aj v antiproliferatívnych a antifibrotických účinkoch na cieľové orgány. Najnovšie sa natriuretický peptidový systém podieľa na metabolickej regulácii oxidácie lipidov, tvorbe a diferenciácii adipocytov, aktivácii adiponektínu, sekrécii inzulínu a tolerancii sacharidov, čo môže poskytnúť ochranu pred rozvojom metabolického syndrómu.
K dnešnému dňu je známe, že rozvoj kardiovaskulárnych ochorení je spojený s dysreguláciou natriuretického peptidového systému. Takže pri hypertenzii je nedostatok natriuretického peptidu, čo vedie k citlivosti na soľ a zhoršenej natriuréze; pri chronickom srdcovom zlyhaní (CHF) sa na pozadí nedostatku pozoruje abnormálne fungovanie hormónov natriuretického peptidového systému.
Preto sa inhibítory NEP môžu použiť na zosilnenie natriuretického peptidového systému, aby sa dosiahli ďalšie hypotenzívne a ochranné kardiorenálne účinky. Inhibícia neprilyzínu vedie k zosilneniu natriuretického, diuretického a vazodilatačného účinku endogénneho natriuretického peptidu a v dôsledku toho k zníženiu krvného tlaku. Avšak NEP sa podieľa aj na degradácii iných vazoaktívnych peptidov, najmä ATI, ATII a endotelínu-1. Preto je rovnováha účinkov na vaskulárny tonus inhibítorov NEP variabilná a závisí od prevahy konstrikčných a dilatačných účinkov. Pri dlhodobom používaní je antihypertenzívny účinok inhibítorov neprilyzínu slabo vyjadrený v dôsledku kompenzačnej aktivácie tvorby ATII a endotelínu-1.
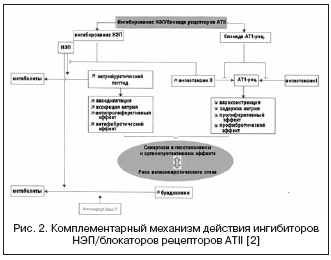
V tomto smere môže kombinácia účinkov ACE inhibítorov a NEP inhibítorov výrazne zosilniť hemodynamické a antiproliferatívne účinky ako výsledok komplementárneho mechanizmu účinku, čo viedlo k vytvoreniu liekov s duálnym mechanizmom účinku, zjednotených pod názvom - inhibítory vazopeptidázy (tabuľka 2, obr. 1).
Známe inhibítory vazopeptidáz sa vyznačujú rôznym stupňom selektivity pre NEP/ACE: omapatrilát - 8,9:0,5; fazidoprilát - 5,1:9,8; sampatrilát - 8,0:1,2. V dôsledku toho dostali inhibítory vazopeptidáz oveľa väčšie možnosti na dosiahnutie hypotenzného účinku bez ohľadu na aktivitu RAAS a úroveň retencie sodíka a pri ochrane orgánov (regresia hypertrofie, albuminúria, stuhnutosť ciev). Najviac študovaným v klinických štúdiách bol omapatrilát, ktorý preukázal vyššiu antihypertenznú účinnosť v porovnaní s ACE inhibítormi a u pacientov s CHF viedol k zvýšeniu ejekčnej frakcie a zlepšeniu klinických výsledkov (štúdie IMPRESS, OVERTURE), avšak bez výhod oproti ACE inhibítorom.
Vo veľkých klinických štúdiách s použitím omapatrilátu sa však zistil vyšší výskyt angioedému v porovnaní s ACE inhibítormi. Je známe, že výskyt angioedému pri užívaní ACE inhibítorov je od 0,1 do 0,5 % v populácii, z toho 20 % prípadov je život ohrozujúcich, čo je spojené s mnohonásobným zvýšením koncentrácií bradykinínu a jeho metabolitov. Výsledky veľkej multicentrickej štúdie OCTAVE (n=25 302), ktorá bola špeciálne navrhnutá na štúdium výskytu angioedému, ukázali, že výskyt tohto nežiaduceho účinku počas liečby omapatrilátom prevyšuje výskyt v skupine s enalaprilom – 2,17 % oproti 0,68 % (relatívne riziko 3.4). Bolo to vysvetlené zvýšeným účinkom na hladinu kinínov počas synergickej inhibície ACE a NEP, spojenej s inhibíciou aminopeptidázy P, ktorá sa podieľa na degradácii bradykinínu.
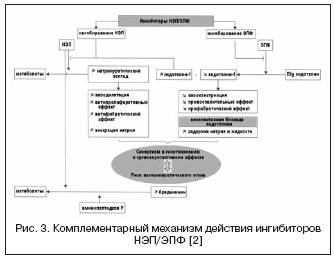
Nový duálny inhibítor vazopeptidázy blokujúci ACE/NEP, ilepatril, má vyššiu afinitu k ACE ako NEP. Pri štúdiu farmakodynamických účinkov ilepatrilu na účinok na aktivitu RAAS a natriuretického peptidu u zdravých dobrovoľníkov sa zistilo, že liek v závislosti od dávky (v dávkach 5 a 25 mg) a významne (viac ako 88 %) potláča ACE v plazme dlhšie ako 48 hodín, bez ohľadu na citlivosť na soľ. Súčasne liek výrazne zvýšil aktivitu plazmatického renínu na 48 hodín a znížil hladinu aldosterónu. Tieto výsledky ukázali výraznú a dlhšiu supresiu RAAS, na rozdiel od ACE inhibítora ramiprilu v dávke 10 mg, čo bolo vysvetlené výraznejším tkanivovým účinkom ilepatrilu na ACE a vyššou afinitou k ACE a porovnateľným stupňom blokády RAAS v porovnaní s kombináciou irbesartan 150 mg + 10 mg ramiprilu. Na rozdiel od účinku na RAAS sa účinok ilepatrilu na natriuretický peptid prejavil prechodným zvýšením hladiny jeho vylučovania v období 4-8 hodín po dávke 25 mg, čo svedčí o nižšej a slabšej afinite pre NEP a odlišuje ho od omapatrilat. Okrem toho, pokiaľ ide o úroveň vylučovania elektrolytov, liek nemá dodatočný natriuretický účinok v porovnaní s ramiprilom alebo irbesartanom, ako aj s inými inhibítormi vazopeptidázy. Maximálny hypotenzný účinok sa vyvinie 6-12 hodín po užití lieku a pokles priemerného krvného tlaku je 5±5 a 10±4 mm Hg. pri nízkej a vysokej citlivosti na soľ. Podľa farmakokinetických charakteristík je ilepatril proliečivo s aktívnym metabolitom, ktorý sa rýchlo tvorí s maximálnou koncentráciou za 1-1,5 hodiny a pomaly sa eliminuje. V súčasnosti prebiehajú klinické štúdie fázy III.
Alternatívna cesta k duálnej supresii RAAS a NEP je reprezentovaná kombináciou blokády ATII receptorov a NEP (obr. 2). Blokátory ATII receptorov neovplyvňujú metabolizmus kinínov, na rozdiel od ACE inhibítorov, preto majú potenciálne nižšie riziko vzniku angioedému. V súčasnosti prvý liek, blokátor ATII receptorov s účinkom inhibície NEP v pomere 1:1, LCZ696, prechádza klinickým skúšaním fázy III. Kombinovaná molekula liečiva obsahuje valsartan a inhibítor NEP (AHU377) vo forme proliečiva. Vo veľkej štúdii u pacientov s hypertenziou (n=1328) preukázal LCZ696 v dávkach 200-400 mg výhodu v hypotenznom účinku oproti valsartanu v dávkach 160-320 mg vo forme dodatočného poklesu krvného tlaku o 5 /3 a 6/3 mmHg. . Hypotenzívny účinok LCZ696 bol sprevádzaný výraznejším poklesom pulzného tlaku: o 2,25 a 3,32 mm Hg. v dávkach 200 a 400 mg, čo sa v súčasnosti považuje za pozitívny prognostický faktor pre účinok na stuhnutosť cievnej steny a kardiovaskulárne výsledky. Štúdia neurohumorálnych biomarkerov pri liečbe LCZ696 zároveň preukázala zvýšenie hladiny natriuretického peptidu s porovnateľným stupňom zvýšenia hladiny renínu a aldosterónu v porovnaní s valsartanom. Znášanlivosť u pacientov s hypertenziou bola dobrá a nezaznamenali sa žiadne prípady angioedému. Štúdia PARAMOUMT bola teraz dokončená u 685 pacientov s CHF a nepoškodenou EF. Výsledky štúdie ukázali, že LCZ696 v porovnaní s valsartanom rýchlejšie a výraznejšie znižuje hladinu NT-proBNP (primárny koncový ukazovateľ je marker zvýšenej aktivity natriuretického peptidu a zlej prognózy pri CHF) a tiež znižuje veľkosť ľavej predsiene , čo naznačuje regresiu jeho prestavby . Prebieha štúdia u pacientov s CHF a zníženou EF (štúdia PARADIGM-HF).
Inhibítory endotelínového systému
Endotelínový systém hrá dôležitú úlohu v regulácii vaskulárneho tonusu a regionálneho prietoku krvi. Spomedzi troch známych izoforiem je najaktívnejší endotelín-1. Okrem známych vazokonstrikčných účinkov stimuluje endotelín proliferáciu a syntézu medzibunkovej hmoty a tiež sa priamym účinkom na tonus obličkových ciev podieľa na regulácii homeostázy vody a elektrolytov. Účinky endotelínu sa realizujú prostredníctvom interakcie so špecifickými receptormi typu A a typu B, ktorých funkcie sú vzájomne opačné: vazokonstrikcia nastáva prostredníctvom receptorov typu A a vazodilatácia typu B. V posledných rokoch sa zistilo, že receptory typu B hrajú dôležitú úlohu pri odstraňovaní endotelínu-1, t.j. blokáda týchto receptorov narúša receptor-dependentný klírens endotelínu-1 a zvyšuje jeho koncentráciu. Okrem toho sa receptory typu B podieľajú na regulácii renálnych účinkov endotelínu-1 a udržiavaní homeostázy vody a elektrolytov, čo je dôležité.
V súčasnosti je úloha endotelínu preukázaná pri vzniku celého radu ochorení, vr. AH, CHF, pľúcna hypertenzia, chronické ochorenie obličiek; ukazuje úzky vzťah medzi hladinou endotelínu a metabolickým syndrómom, endoteliálnou dysfunkciou a aterogenézou. Od 90. rokov 20. storočia prebieha hľadanie antagonistov endotelínového receptora vhodných na klinické použitie; Už je známych 10 liekov („sentanov“) s rôznym stupňom selektivity pre receptory typu A/B. Prvý neselektívny antagonista endotelínového receptora – bosentan – v klinickej štúdii u pacientov s hypertenziou preukázal hypotenznú účinnosť porovnateľnú s účinnosťou ACE inhibítora enalaprilu. Ďalšie štúdie o účinnosti antagonistov endotelínu pri hypertenzii ukázali ich klinický význam pri liečbe rezistentnej hypertenzie a pri vysokom kardiovaskulárnom riziku. Tieto údaje sa získali v dvoch veľkých klinických štúdiách DORADO (n=379) a DORADO-AC (n=849), v ktorých bol darusentan pridaný k trojkombinačnej liečbe u pacientov s rezistentnou hypertenziou. V štúdii DORADO boli pacienti s rezistentnou hypertenziou spájaní s chronickým ochorením obličiek a proteinúriou a v dôsledku pridania darusentanu bol pozorovaný nielen výrazný pokles krvného tlaku, ale aj zníženie vylučovania bielkovín. Antiproteinurický účinok antagonistov endotelínových receptorov bol následne potvrdený v štúdii u pacientov s diabetickou nefropatiou s použitím avocentanu. V štúdii DORADO-AC však nebola žiadna výhoda v dodatočnom znížení TK oproti komparátorom a placebu, čo bolo dôvodom ukončenia ďalších štúdií. Okrem toho v 4 veľkých štúdiách antagonistov endotelínu (bosentan, darusentan, enrasentan) u pacientov s CHF boli získané protichodné výsledky, čo bolo vysvetlené zvýšením koncentrácie endotelínu-1. Ďalšia štúdia antagonistov endotelínového receptora bola pozastavená z dôvodu nepriaznivých účinkov spojených s retenciou tekutín (periférny edém, objemové preťaženie). Rozvoj týchto účinkov je spojený s účinkom antagonistov endotelínu na receptory typu B, čo zmenilo hľadanie liekov, ktoré ovplyvňujú endotelínový systém inými cestami; a antagonisty endotelínového receptora majú v súčasnosti iba jednu indikáciu, a to liečbu pľúcnej hypertenzie.
Berúc do úvahy veľký význam endotelínového systému v regulácii cievneho tonusu, prebieha hľadanie ďalšieho mechanizmu účinku prostredníctvom vazopeptidázy - EPF, ktorá sa podieľa na tvorbe aktívneho endotelínu-1 (obr. 3). Blokovanie ACE a kombinácia s inhibíciou NEP môže účinne potlačiť tvorbu endotelínu-1 a zosilniť účinky natriuretického peptidu. Výhody duálneho mechanizmu účinku spočívajú na jednej strane v predchádzaní nevýhodám inhibítorov NEP spojených s možnou vazokonstrikciou sprostredkovanou aktiváciou endotelínu, na druhej strane natriuretická aktivita inhibítorov NEP umožňuje kompenzovať zadržiavanie tekutín. spojené s neselektívnou blokádou endotelínových receptorov. Daglutril je duálny inhibítor NEP a EPF, ktorý je vo fáze II klinických skúšok. Štúdie preukázali výrazné kardioprotektívne účinky lieku v dôsledku zníženia prestavby srdca a ciev, regresie hypertrofie a fibrózy.
Priame inhibítory renínu
Je známe, že ACE inhibítory a blokátory ATII receptorov zvyšujú aktivitu renínu mechanizmom spätnej väzby, čo je dôvodom úniku účinnosti blokátorov RAAS. Renin predstavuje úplne prvý krok v kaskáde RAAS; je produkovaný juxtaglomerulárnymi bunkami obličiek. Renín prostredníctvom angiotenzinogénu podporuje tvorbu ATII, vazokonstrikciu a sekréciu aldosterónu a tiež reguluje mechanizmy spätnej väzby. Preto inhibícia renínu umožňuje dosiahnuť úplnejšiu blokádu systému RAAS. Hľadanie inhibítorov renínu prebieha od 70. rokov 20. storočia; po dlhú dobu nebolo možné získať perorálnu formu inhibítorov renínu pre ich nízku biologickú dostupnosť v gastrointestinálnom trakte (menej ako 2 %). Prvý priamy inhibítor renínu vhodný na perorálne podanie, aliskiren, bol zaregistrovaný v roku 2007. Aliskiren má nízku biologickú dostupnosť (2,6 %), dlhý polčas (24-40 hodín), extrarenálnu eliminačnú cestu. Farmakodynamika aliskirenu je spojená s 80 % poklesom hladiny ATII. V klinických štúdiách u pacientov s hypertenziou viedol aliskiren v dávkach 150-300 mg/deň k zníženiu SBP o 8,7-13 a 14,1-15,8 mm Hg. a DBP - o 7,8-10,3 a 10,3-12,3 mm Hg. . Hypotenzívny účinok aliskirenu sa pozoroval u rôznych podskupín pacientov, vrátane pacientov s metabolickým syndrómom, obezitou; z hľadiska závažnosti bol porovnateľný s účinkom ACE inhibítorov, blokátorov ATII receptorov a aditívny účinok bol zaznamenaný v kombinácii s valsartanom, hydrochlorotiazidom a amlodipínom. Množstvo klinických štúdií preukázalo organoprotektívne účinky lieku: antiproteinurický účinok u pacientov s diabetickou nefropatiou (štúdia AVOID, n=599), regresia hypertrofie ľavej komory u pacientov s hypertenziou (štúdia ALLAY, n=465). V štúdii AVOID teda po 3 mesiacoch liečby losartanom v dávke 100 mg/deň a dosiahnutí cieľovej hladiny krvného tlaku (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Okrem toho prebieha séria klinických štúdií aliskirenu v liečbe iných kardiovaskulárnych ochorení s hodnotením vplyvu na prognózu pacientov: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n =7000) štúdie u pacientov s CHF, štúdia ALTITUDE u pacientov s diabetes mellitus a vysokým kardiovaskulárnym rizikom, štúdia ASPIRE u pacientov s postinfarktovou remodeláciou.
Záver
Na riešenie problémov prevencie kardiovaskulárnych ochorení pokračuje tvorba nových liekov so zložitým viacnásobným mechanizmom účinku, čo umožňuje komplexnejšiu blokádu RAAS prostredníctvom kaskády mechanizmov hemodynamickej a neurohumorálnej regulácie. Potenciálne účinky takýchto liekov umožňujú nielen poskytnúť dodatočný antihypertenzívny účinok, ale tiež dosiahnuť kontrolu hladín krvného tlaku u vysokorizikových pacientov, vrátane rezistentnej hypertenzie. Lieky s viacnásobným mechanizmom účinku vykazujú výhody vo výraznejšom organoprotektívnom účinku, ktorý zabráni ďalšiemu poškodeniu kardiovaskulárneho systému. Štúdium výhod nových liekov, ktoré blokujú RAAS, si vyžaduje ďalší výskum a hodnotenie ich vplyvu na prognózu pacientov s hypertenziou a inými kardiovaskulárnymi ochoreniami.


Literatúra
1 Campbell D.J. Inhibícia vazopeptidázy: dvojsečná zbraň? // Hypertenzia. 2003 Vol. 41. str. 383-389.
2. Laurent S., Schlaich M., Esler M. Nové lieky, postupy a zariadenia na hypertenziu // Lancet. 2012. Zv. 380. S. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. a kol. Inhibítory vazopeptidázy: nový terapeutický koncept pri kardiovaskulárnych ochoreniach? // Obeh. 2001 Vol. 104. S. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. a kol. Neutrálna inhibícia endopeptidázy a natriuretický peptidový systém: rozvíjajúca sa stratégia v kardiovaskulárnych terapeutikách // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. a kol. Porovnanie inhibítora vazopeptidázy, omapatrilátu a lizinoprilu na toleranciu záťaže a morbiditu u pacientov so srdcovým zlyhaním: randomizovaná štúdia IMPRESS // Lancet. 2000 Vol. 356. S. 615-620.
6. Packer M., Califf R.M., Konstam M.A. a kol. Porovnanie omapatrilátu a enalaprilu u pacientov s chronickým srdcovým zlyhaním: Randomizovaná štúdia omapatrilátu verzus enalaprilu užitočnosti pri znižovaní udalostí (OVERTURE) // Cirkulácia. 2002 Vol. 106. S. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Blokátory receptorov angiotenzínu II u pacientov s angioedémom indukovaným ACE inhibítorom // Ann. Pharmacother. 2000 Vol. 34. S. 526-528.
8. Kostis J.B., Packer M., Black H.R. a kol. Omapatrilát a enalapril u pacientov s hypertenziou: štúdia Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hypertens. 2004 Vol. 17. S. 103-111.
9. Azizi M., Bissery A., Peyrard S. a kol. Farmakokinetika a farmakodynamika inhibítora vazopeptidázy AVE7688 u ľudí // Clin. Pharmacol. Ther. 2006 Vol. 79. S. 49-61.
10. Gu J., Noe A., Chandra P. a kol. Farmakokinetika a farmakodynamika LCZ696, nového duálneho inhibítora angiotenzínového receptora-neprilyzínu (ARNi) // J. Clin. Pharmacol. 2010 Vol. 50. str. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. a kol. Zníženie krvného tlaku pomocou LCZ696, nového duálneho inhibítora receptora angiotenzínu II a neprilyzínu: randomizovaná, dvojito zaslepená, placebom kontrolovaná, aktívna porovnávacia štúdia // Lancet. 2010 Vol. 375. S. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. a kol. Inhibítor neprilyzínu angiotenzínového receptora LCZ696 pri zlyhaní srdca so zachovanou ejekčnou frakciou: dvojito zaslepená randomizovaná kontrolovaná štúdia fázy 2 // Lancet. 2012. Zv. 380 (9851). P. 1387-1395.
13. Levin E.R. Endotelíny // N. Engl. J. Med. 1995 Vol. 333. S. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. a kol. Úloha endotelínu-1 pri klinickej hypertenzii: 20 rokov // Hypertenzia. 2008 Vol. 52. S. 452-459.
15. Burnier M., Forni V. Antagonisty endotelínového receptora: miesto v manažmente esenciálnej hypertenzie? // Nefrol. Vytočiť. transplantácia. 2011,0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. a kol. Účinok antagonistu endotelínového receptora, bosentanu, na krvný tlak u pacientov s esenciálnou hypertenziou. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998 Vol. 338. S. 784-790.
17. Weber M.A., Black H., Bakris G. a kol. Selektívny antagonista endotelínového receptora na zníženie krvného tlaku u pacientov s hypertenziou rezistentnou na liečbu: randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia // Lancet. 2009 Vol. 374. S. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. a kol. Rozdielne výsledky s použitím klinického a ambulantného krvného tlaku: správa o štúdii hypertenzie rezistentnej na darusentan // Hypertenzia. 2010 Vol. 56. S. 824-830.
19. Mann J.F., Green D., Jamerson K. a kol. Avosentan na zjavnú diabetickú nefropatiu // J. Am. soc. Nephrol. 2010 Vol. 21. S. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. a kol. Enzým konvertujúci endotel/inhibítor neutrálnej endopeptidázy SLV338 zabraňuje hypertenznej remodelácii srdca spôsobom nezávislým od krvného tlaku // Hypertenzia. 2011 Vol. 57. str. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. a kol. Potlačenie angiotenzínu II u ľudí teoreticky aktívnym inhibítorom renínu Aliskirenom (SPP100): porovnanie s enalaprilom // Hypertenzia. 2002 Vol. 39 ods. P.E1-8.
22. Alreja G., Joseph J. Renin a kardiovaskulárne choroby: Cesta opotrebovania alebo nový smer? // Svet J. Cardiol. 2011 Vol. 3(3). S. 72-83.
23. Ingelfinger J.R. Aliskiren a duálna liečba diabetes mellitus 2. typu // N. Engl. J. Med. 2008 Vol. 358 (23). S. 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (za vyšetrovateľov ALLAY). Potlačenie aldosterónu sprostredkúva regresiu hypertrofie ľavej komory u pacientov s hypertenziou // J. Renín-angiotenzín-aldosterónový systém. 2011 Vol. 12. str. 483-490.
25. Kelly D.J., Zhang Y., Moe G. a kol. Aliskiren, nový inhibítor renínu, je renoprotektívny v modeli pokročilej diabetickej nefropatie u potkanov // Diabetol. 2007 Vol. 50. str. 2398-2404.


