אלדוסטרון בבני אדם הוא הנציג העיקרי של הורמונים מינרלוקורטיקואידים שמקורם בכולסטרול.
סִינתֶזָה
זה מתבצע באזור הגלומרולרי של קליפת יותרת הכליה. נוצר מכולסטרול, פרוגסטרון עובר חמצון רציף בדרכו לאלדסטרון. 21-הידרוקסילאז, 11-הידרוקסילאז ו-18-הידרוקסילאז. בסופו של דבר נוצר אלדוסטרון.

תכנית הסינתזה של הורמונים סטרואידים (תכנית מלאה)
ויסות סינתזה והפרשה
לְהַפְעִיל:
- אנגיוטנסין IIמשתחרר במהלך הפעלת מערכת הרנין-אנגיוטנסין,
- ריכוז מוגבר יוני אשלגןבדם (קשור לדפולריזציה של הממברנה, פתיחת תעלות סידן והפעלה של אדנילט ציקלאז).
הפעלת מערכת רנין-אנגיוטנסין
- ישנן שתי נקודות התחלה להפעלת מערכת זו:
- הפחתת לחץבעורקים האפרנטיים של הכליות, אשר נקבע ברורצפטוריםתאים של המנגנון juxtaglomerular. הסיבה לכך עשויה להיות כל הפרה של זרימת הדם הכלייתית - טרשת עורקים. עורקי כליה, צמיגות דם מוגברת, התייבשות, איבוד דם וכו'.
- ירידה בריכוז יוני Na +בשתן הראשוני באבוביות הדיסטליות של הכליות, אשר נקבע על ידי האוסמרצפטורים של התאים של המנגנון juxtaglomerular. מתרחשת כתוצאה מדיאטה נטולת מלחים, עם שימוש ממושך במשתנים.
הפרשת הרנין (בסיסית) נשמרת על ידי מערכת העצבים הסימפתטית, קבועה ובלתי תלויה בזרימת הדם הכלייתית.
- בעת ביצוע פריט אחד או שניהם בתא מנגנון juxtaglomerularמופעלים ומהם מופרש האנזים לפלסמת הדם רנין.
- קיים מצע לרנין בפלזמה - חלבון של שבריר α2-globulin אנגיוטנינוגן. כתוצאה מפרוטוליזה, נקרא דקפפטיד אנגיוטנסין I. יתר על כן, אנגיוטנסין I בהשתתפות אנזים הממיר אנגיוטנסין(ACE) הופך ל אנגיוטנסין II.
- היעדים העיקריים של אנגיוטנסין II הם מיוציטים חלקים. כלי דםו קליפת המוח הגלומרולריתבלוטות יותרת הכליה:
- גירוי של כלי דם גורם לעווית ולהחלמה שלהם לחץ דם.
- מופרש מבלוטת יותרת הכליה לאחר גירוי אלדוסטרוןפועל על הצינוריות הדיסטליות של הכליות.
בחשיפה לאלדסטרון, האבובות של הכליות מגבירות את הספיגה מחדש יוני Na +, בעקבות מהלכי נתרן מים. כתוצאה מכך, הלחץ במערכת הדם משוחזר וריכוז יוני הנתרן עולה בפלסמת הדם ולכן גם בשתן הראשוני, מה שמפחית את פעילות ה-RAAS.

הפעלת מערכת רנין-אנגיוטנסין-אלדוסטרון
מנגנון פעולה
ציטוזולי.
מטרות ואפקטים
משפיע בלוטות הרוק, על הצינוריות הדיסטליות וצינורות האיסוף של הכליות. משפר בכליות ספיגה מחדש של יוני נתרןואובדן יוני אשלגן באמצעות ההשפעות הבאות:
- מגדיל את כמות Na + ,K + -ATPase ב- קרום בסיסתאי האפיתל,
- ממריץ את הסינתזה של חלבוני המיטוכונדריה ועלייה בכמות האנרגיה המיוצרת בתא לצורך פעולת Na +, K + -ATPase,
- מגרה היווצרות של תעלות Na על הממברנה האפיקלית של תאי אפיתל כליות.
פָּתוֹלוֹגִיָה
תפקוד יתר
תסמונת קון (אלדוסטרוניזם ראשוני) - מתרחשת עם אדנומות של האזור הגלומרולרי. הוא מאופיין בשלישיית סימנים: יתר לחץ דם, היפרנתרמיה, אלקלוזה.
מִשׁנִיהיפראלדוסטרוניזם - היפרפלזיה ותפקוד יתר של תאים יוקסגלומרולריים והפרשת יתר של רנין ואנגיוטנסין II. יש עלייה בלחץ הדם והופעת בצקת.
מערכת רנין-אנגיוטנסין-אלדוסטרון היא קומפלקס של אנזימים והורמונים השומרים על הומאוסטזיס. מסדיר את מאזן המלח והמים בגוף ואת רמת לחץ הדם.
מנגנון עבודה
הפיזיולוגיה של מערכת רנין-אנגיוטנסין-אלדוסטרון מקורה בגבול קליפת המוח ושם ישנם תאים ג'וקסגלומרולריים המייצרים פפטידאז (אנזים) - רנין.
רנין הוא הורמון והקשר הראשוני של ה-RAAS.
מצבים בהם רנין משתחרר לדם
ישנם מספר מצבים שבהם ההורמון חודר לזרם הדם:
- ירידה בזרימת הדם ברקמת הכליה - עם תהליכים דלקתיים (גלומרולונפריטיס וכו'), עם נפרופתיה סוכרתית, גידולי כליות.
- ירידה (עם דימום, הקאות חוזרות, שלשולים, כוויות).
- ירידה בלחץ הדם. בעורקי הכליות ישנם ברורצפטורים המגיבים לשינויים בלחץ המערכתי.
- שינוי בריכוז יוני הנתרן. בגוף האדם יש הצטברויות של תאים המגיבים לשינויים בהרכב היוני של הדם על ידי גירוי ייצור רנין. מלח הולך לאיבוד הזעה מרובהכמו גם הקאות.
- מתח, מתח פסיכו-רגשי. הכליות עוברות עצבים על ידי עצבים סימפטיים, המופעלים על ידי השפעות פסיכולוגיות שליליות.
בדם, רנין נפגש עם חלבון - אנגיוטנינוגן, המיוצר על ידי תאי כבד ולוקח ממנו שבר. נוצר אנגיוטנסין I, המהווה את מקור הפעולה של האנזים הממיר אנגיוטנסין (ACE). התוצאה היא אנגיוטנסין II, המשמש חוליה שנייה ומהווה מכווץ כלי דם רב עוצמה. מערכת עורקים(מכווץ כלי דם).
השפעות של אנגיוטנסין II
מטרה: להגדיל לחץ עורקי.
- מקדם את הסינתזה של אלדוסטרון באזור הגלומרולרי של קליפת יותרת הכליה.
- משפיע על מרכז הרעב והצמא במוח, גורם לתיאבון "מלח". ההתנהגות האנושית הופכת למוטיבציה לחפש מים ומזונות מלוחים.
- משפיע עצבים סימפטיים, קידום שחרור נוראדרנלין, שהוא גם מכווץ כלי דם, אך פחות חלש בפעולה.
- משפיע על כלי הדם, גורם להם לעווית.
- משתתף בפיתוח של אי ספיקת לב כרונית: מקדם שגשוג, פיברוזיס כלי דם בשריר הלב.
- מפחית
- מעכב את ייצור ברדיקינין.

אלדוסטרון הוא המרכיב השלישי הפועל על הצינוריות הסופיות של הכליות ומקדם הפרשת יוני אשלגן ומגנזיום מהגוף וספיגה הפוכה (ספיגה חוזרת) של נתרן, כלור ומים. בשל כך, נפח הנוזלים במחזור גדל, מספרי לחץ הדם עולים וזרימת הדם הכלייתית עולה. קולטנים לאלדוסטרון קיימים לא רק בכליות, אלא גם בלב ובכלי הדם.
כאשר הגוף מגיע להומיאוסטזיס, מתחילים להיווצר מרחיבים כלי דם (חומרים המרחיבים את כלי הדם) - ברדיקינין וקאלידין. ומרכיבי ה-RAAS נהרסים בכבד.
ערכת מערכת רנין-אנגיוטנסין-אלדוסטרון

כמו כל מערכת, ה-RAAS יכול להיכשל. הפתופיזיולוגיה של מערכת רנין-אנגיוטנסין-אלדוסטרון מתבטאת בתנאים הבאים:
- פגיעה בקליפת יותרת הכליה (זיהום, דימום וטראומה). מתפתח מצב של מחסור באלדוסטרון, והגוף מתחיל לאבד נתרן, כלוריד ומים, מה שמוביל לירידה בנפח הנוזלים במחזור ולירידה בלחץ הדם. התנאי מפצה על ידי ההקדמה תמיסות מלחוממריצים קולטן לאלדסטרון.
- גידול בקליפת יותרת הכליה מוביל לעודף של אלדוסטרון, אשר מבין את השפעותיו ומגביר את לחץ הדם. מופעלים גם תהליכי חלוקת תאים, היפרטרופיה ופיברוזיס שריר הלב מתרחשת ומתפתחת אי ספיקת לב.
- פתולוגיה של הכבד, כאשר הרס האלדוסטרון מופרע ומתרחשת הצטברותו. הפתולוגיה מטופלת באמצעות חוסמי קולטני אלדוסטרון.
- מחלות דלקתיות של הכליות.

משמעות RAAS לחיים ולרפואה
מערכת רנין-אנגיוטנסין-אלדוסטרון ותפקידה בגוף:
- מקבל השתתפות פעילהבשמירה על מחוון לחץ דם תקין;
- מבטיח את איזון המים והמלחים בגוף;
- שומר על איזון חומצה-בסיס בדם.
המערכת עלולה לקרוס. על ידי פעולה על מרכיביו, אתה יכול להילחם ביתר לחץ דם. מנגנון המופע של יתר לחץ דם כליות קשור גם הוא קשר הדוק ל-RAAS.
קבוצות יעילות מאוד של תרופות המסונתזות הודות למחקר של RAAS
- "פרילי". אֵס. אנגיוטנסין I אינו הופך לאנגיוטנסין II. ללא כיווץ כלי דם - ללא עלייה בלחץ הדם. תכשירים: Amprilan, Enalapril, Captopril וכו'. מעכבי ACE משפרים משמעותית את איכות החיים של חולי סוכרת, מספקים מניעה של אי ספיקת כליות. התרופות נלקחות במינון מינימלי, שאינו גורם לירידה בלחץ, אלא רק משפר את זרימת הדם המקומית ואת הסינון הגלומרולרי. תרופות הכרחיות לאי ספיקת כליות, מחלה כרוניתלבבות ולשמש כאחד האמצעים לטיפול ביתר לחץ דם (אם אין התוויות נגד).
- "סארטנים". חוסמי קולטן לאנגיוטנסין II. הכלים לא מגיבים לזה ולא מתכווצים. תרופות: Losartan, Eprosartan וכו'.

ההפך ממערכת הרנין-אנגיוטנסין-אלדוסטרון היא מערכת הקינין. לכן, חסימת ה-RAAS מובילה לעלייה במרכיבי הדם של מערכת הקינינים (ברדיקינין וכו'), המשפיעה לטובה על רקמות הלב ודפנות כלי הדם. שריר הלב אינו חווה רעב, מכיוון שברדיקינין משפר את זרימת הדם המקומית, ממריץ את הייצור של מרחיבי כלי דם טבעיים בתאי המדולה הכלייתית ובמיקרוציטים של צינורות האיסוף - פרוסטגלנדינים E ו-I2. הם מנטרלים את פעולת הלחץ של אנגיוטנסין II. כלי הדם אינם עוויתיים, מה שמבטיח אספקת דם מספקת לאיברי ולרקמות הגוף, הדם אינו משתהה והיווצרות רובדים טרשתיים וקרישי דם מופחתת. לקינינים יש השפעה מועילה על הכליות, מגבירים משתן (תפוקת שתן יומית).
רנין
- אנזים המסונתז על ידי תאים juxtaglomerular של arterioles אפרנטי הכליות, בעל MM של כ-40 kDa. היווצרות רנין אינטנסיבית במיוחד מתרחשת במהלך איסכמיה כלייתית. הלוקליזציה של תאים juxtaglomerular הופכת אותם לרגישים במיוחד לשינויים בלחץ הדם, כמו גם לריכוז יוני Na + ו-K + בנוזל הזורם דרך צינוריות הכליה. בשל תכונות אלו, כל שילוב של גורמים הגורם לירידה בנפח הנוזלים (התייבשות, ירידה בלחץ הדם, איבוד דם ועוד) או ירידה ב ריכוז NaClממריץ את שחרור רנין.
במקביל, רוב הרגולטורים של סינתזת רנין פועלים דרך ברוררצפטורים בכליות.שחרור רנין מושפע ממצב מערכת העצבים המרכזית, וכן משינוי במיקום הגוף בחלל. במיוחד כאשר עוברים ממצב שכיבה לישיבה או עמידה (בדיקה קלינוסטטית), הפרשת רנין עולה. תגובת רפלקס זו נובעת מעלייה בטון של החלק הסימפטי של האוטונומי מערכת עצבים, אשר מעבירה דחפים לקולטנים b-adrenergic של תאים juxtaglomerular.
המצע העיקרי עליו פועל רנין הוא אנגיוטנינוגן- חלבון המהווה חלק משבריר 2 -גלובולין ונוצר על ידי הכבד. בהשפעת גלוקוקורטיקואידים ואסטרוגנים, הסינתזה של אנגיוטנזינוגן עולה באופן משמעותי. כתוצאה מפעולת הרנין, אנגיוטנזינוגן הופך לדקפפטיד אנגיוטנסיןאני.לתרכובת זו השפעה חלשה ביותר ואין לה השפעה משמעותית על רמות לחץ הדם.
בינתיים אנגיוטנסיןאניבהשפעת מה שנקרא אנזים הממיר אנגיוטנסין (ACE)הופך לגורם מכווץ כלי דם חזק - אנגיוטנסיןII. אֵס(dipeptidecarboxypeptidase) הוא חלבון אינטגרלי הממוקם בעיקר על הממברנה של תאי אנדותל, אפיתל, תאים חד-גרעיניים, קצות עצבים, תאי אברי הרבייה וכו'. הצורה המסיסה של ACE קיימת כמעט בכל נוזלי הגוף.
נהוג להבחין בין שני איזופורמים של ACE. הראשון שבהם קיבל את שם הקוד "סומטי". לאיזופורם זה יש MM של 170 kDa וכולל תחומים C ו-N הומולוגיים. הצורה השנייה של ACE ("רבייה") נמצאת בנוזל הזרע, בעלת MM של כ-100 kDa והיא מתאימה לתחום ה-C של האיזופורם הראשון של ACE. כל אחד מ-2 התחומים המצוינים מכיל שאריות חומצות אמינו שיכולות לקחת חלק ביצירת הקשר עם אטום האבץ. מבנים מסוג Zn 2+ אופייניים למטלופרוטאנאזים רבים והם האתרים העיקריים של אינטראקציה של האנזים הן עם הסובסטרט והן עם מעכבי ACE.
יש לציין כי ACE לא רק מוביל להיווצרות אנגיוטנסין II,אלא גם הורס ברדיקינין -חיבור שמתרחב כלי דם. לכן, עלייה בלחץ הדם בהשפעת ACE קשורה הן להיווצרות אנגיוטנסין II והן לפירוק של ברדיקינין (איור 32).
תפקיד חשוב לפעולה של ACE משוחק על ידי ההרכב היוני ובמיוחד התוכן של יוני כלוריד. אז, בריכוז גבוה של Cl - C-domain של ACE מבצע הידרוליזה של ברדיקינין ואנגיוטנסין-I מהר יותר מתחום N. באזורים חוץ-תאיים, שבהם ריכוז האניונים הכלוריים גבוה, תחום ה-N אחראי בעיקר להמרה של אנגיוטנסין-I. עם זאת, תוך תאי, כאשר ריכוז Cl נמוך, תחום ה-N יכול להשתתף בהידרוליזה של חומרים פפטידים אחרים.
מֵאָחוֹר השנים האחרונותנמצא כי ACE ממלא תפקיד חשוב בהמטופואזה, כי בהשפעתו היווצרות של פפטיד המטופואטיעיכוב היווצרות של תאים המטופואטיים במח העצם.
תפקידו של ACE בגוף זוהה בעכברים חסרי הגן ACE. בבעלי חיים כאלה צוינו לחץ דם נמוך, הפרעות בתפקוד כלי דם שונים, פגיעה במבנה ובתפקוד הכליות ואי פוריות בזכרים.
אנגיוטנסיןII
מגביר את לחץ הדם על ידי גרימת התכווצות עורקים והוא הסוכן הווזואקטיבי החזק ביותר הידוע. בנוסף, הוא מעכב היווצרות ושחרור של רנין על ידי תאי ה-juxtaglomerular של הכליה על ידי מנגנון משוב, שאמור בסופו של דבר לשחזר את רמות לחץ הדם התקינות. תחת השפעה אנגיוטנסיןIIהייצור של המינרלוקורטיקואיד הראשי עולה בחדות - אלדוסטרון.למרות שפעולה זו היא ישירה, אנגיוטנסין II אינו משפיע על ייצור הקורטיזול. המטרה העיקרית של אלדוסטרון היא לשמור על Na + (על ידי הגברת הספיגה מחדש שלו באבוביות הכליה) ושחרור של K + ו- H + (בעיקר דרך הכליות). תגובות אלו מבוצעות כדלקמן.
אלדוסטרון
חודר מהנוזל החוץ תאי לציטופלזמה של התא ושם הוא מתחבר עם קולטן ספציפי, ולאחר מכן הקומפלקס שנוצר (אלדוסטרון + קולטן) חודר לגרעין. אלדוסטרון גם ממריץ את פתיחת תעלות Na+, שבגללן יוני Na+ חודרים לתא דרך הממברנה האפיקלית מהלומן של הצינורית.
העלייה בהפרשת K+ בהשפעת אלדוסטרון נובעת מעלייה בחדירות הממברנה האפיקלית ביחס ליונים אלו, עקב כך חודר K+ מהתא ללומן של הצינורית.
שימור Na + בגוף, כמו אנגיוטנסין II, תורם לעלייה בלחץ הדם.
אנגיוטנסיןIIמסוגל להיקשר לקולטנים ספציפיים על התאים הגלומרולריים של בלוטת יותרת הכליה. התוכן של קולטנים אלה תלוי במידה רבה בריכוז יוני K +. אז, אם רמת K + עולה, אז מספר הקולטנים עבור אנגיוטנסין II בתאי הגלומרול גדל. עם ירידה בריכוז של יוני K +, האפקט ההפוך מצוין. לכן, יוני K+ ממלאים תפקיד מרכזי בפעולת אנגיוטנסין II על בלוטות יותרת הכליה.
מֵאָחוֹר לָאַחֲרוֹנָהקבע את זה אנגיוטנסיןIIמסוגל להפעיל מקרופאגים, ובכך להגביר את צבירת הטסיות ולהאיץ את קרישת הדם. במקביל, הוא משחרר מעכב מפעיל פלסמינוגן-אני (IAP-1),אשר עשוי להיות מלווה בדיכאון של פיברינוליזה. א נגיוטנסיןIIהוא אחד הגורמים התורמים להתפתחות אתרוגזה, עיכוב אפופטוזיס ולחץ חמצוני מוגבר ברקמות, ובכך מעורר הצטברות טסיות דם ופקקת.
אנגיוטנסיןIIמסוגל לשפר את תפקוד שריר הלב, מעורב בביוסינתזה של נוראפינפרין וחומרים פעילים פיזיולוגית אחרים. יחד עם זאת, זה יכול לפעול כגורם גדילה, מה שמוביל להיפרטרופיה של כלי הדם והלב.
כמה חיות ובני אדם אנגיוטנסיןIIתחת השפעת אנזים aminopeptidasesהומר להפטפפטיד אנגיוטנסיןIII.בבני אדם, רמת האנגיוטנסין II גבוהה פי 4 בערך מזו של אנגיוטנסין III. שתי התרכובות הללו משפיעות על לחץ הדם וייצור האלדוסטרון ומתכלות די מהר על ידי אנזימים. אנגיוטנסין.
במחלות כליות קשות המלוות באיסכמיה שלהן, עקב היווצרות והפרשה מוגברת של רנין, נצפית עליה מתמשכת בלחץ הדם ( יתר לחץ דם כליות). השימוש במעכבי ACE במצבים אלו מוביל לנורמליזציה מהירה של לחץ הדם.
לסיכום, יש להדגיש שוב כי מערכת האנגיוטנסין-רנינו-אלדוסטרון קשורה קשר הדוק לתפקוד מערכת הקליקריין-קינין, מכיוון שיצירת אנגיוטנסין II והרס של ברדיקינין מתבצעים בהשפעת אותו. אנזים - ACE.
Catad_theme יתר לחץ דם עורקי- מאמרים
Catad_tema השמנת יתר - מאמרים
השמנת יתר ויתר לחץ דם עורקי
פורסם במגזין:בעיות בריאות האישה מס' 4, כרך 3, 2008
א.י.אסטשקין, מ.ג.גלזר
האקדמיה הרפואית של מוסקבה. I.M. Sechenov
סיכום
הסקירה מנתחת את תפקידה של השמנת יתר בהתפתחות יתר לחץ דם עורקי ו מחלות לב וכלי דם, מנגנונים פתופיזיולוגיים של קשר זה, התפקיד הדומיננטי של מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS). נדונות הנושאים של תיקון תרופתי של לחץ דם גבוה בחולים שמנים באמצעות שילוב קבוע של תרופות חוסמות RAAS ו-verpamil. מוצג ניתוח של היעילות והבטיחות של השימוש בסיבוטרמין לירידה במשקל בחולים עם לחץ דם גבוה.
מילות מפתח:השמנת יתר, יתר לחץ דם עורקי, טיפול.
תַקצִיר
המחברים ניתחו את תפקידה של השמנת יתר בהתפתחות יתר לחץ דם עורקי ומחלות לב וכלי דם, מנגנונים פתופיזיולוגיים של קשר זה, ותפקידה השולט של מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS). הוכח כי תיקון תרופתי של לחץ דם גבוה בחולים עם השמנת יתר עם שילוב קבוע של חוסמי RAAS ו-verpamil יעיל. מוצג ניתוח היעילות והבטיחות של סיבוטרמין לירידה במשקל בחולים עם לחץ דם גבוה.
מילות מפתח:השמנת יתר, יתר לחץ דם עורקי, טיפול.
הרלוונטיות של הנושא הנדון נובעת מהעובדה שבכל העולם בשנים האחרונות חלה עלייה משמעותית במספר האנשים הסובלים מהשמנת יתר. השמנת יתר נחשבת כיום כאחד הגורמים העיקריים התורמים להתפתחות מחלות, שהן הגורמים העיקריים למבנה התמותה בקרב האוכלוסייה הבוגרת. ראשית כל אנחנו מדבריםעל התפתחות סוכרת מסוג 2, כמו גם לב וכלי דם ו מחלות אונקולוגיות. עלייה במשקל ב-1 ק"ג מעלה את הסיכון למחלות לב וכלי דם ב-3.1% וסוכרת ב-4.5-9%.
ידוע כי בהשמנה הסיכון לפתח יתר לחץ דם עורקי - גורם המשפיע באופן משמעותי גם על הופעת מחלות לב וכלי דם כמו התקפי לב ושבץ מוחי - גבוה פי שלושה מאשר אצל אנשים עם משקל גוף תקין. כפי שהוצג במחקר INTERSALT, על כל 4.5 ק"ג של עלייה במשקל, לחץ הדם הסיסטולי (BP) עולה ב-4.5 מ"מ כספית. אומנות. .
השמנת יתר כגורם סיכון אצל נשים עם יתר לחץ דם עורקי, במיוחד בגיל מבוגר יותר, שכיח יותר מאשר אצל גברים. אחת הסיבות לכך היא היפו-אסטרוגניה המתרחשת בתקופה שלאחר גיל המעבר. יש לציין כמה מאפיינים של שכיחות השמנת יתר בסוגים שונים של יתר לחץ דם עורקי. לפיכך, בקרב נשים מבוגרות עם יתר לחץ דם סיסטולי מבודד, השמנת יתר שכיחה פחות, ואין נתונים על השפעת הירידה במשקל על קטגוריית חולים זו. בנשים עם השמנת יתר בטנית, עם צורות סיסטולי-דיאסטולי של יתר לחץ דם עורקי, ירידה במשקל היא נקודה חשובהבבקרת מחלות.
בהשמנת יתר מתרחשים מספר שינויים המודינמיים, בפרט, עלייה בנפח הדם במחזור הדם, נפח השבץ ותפוקת הלב עם התנגדות כלי דם רגילה יחסית. מאמינים שלחץ דם גבוה בחולים שמנים נובע בעיקר מתפוקת לב מוגברת עם התנגדות היקפית "לא תקינה מספיק".
מצב המודינמי זה מגרה שתי מערכות ויסות אנטגוניסטיות השולטות בנפח הדם ו התנגדות היקפית- מערכת רנין-אנגיוטנסין-אלדוסטרון (RAAS) ומערכת הפפטידים הנטריאורטיים של הלב. חוסר הוויסות שלהם עשוי להסביר במידה רבה את תפוקת הלב הגבוהה בחולים עם יתר לחץ דם שמנים. יתרה מכך, מערכות ויסות קרדיווסקולריות אלו מעורבות בשינויים המטבוליים הקשורים למשקל גוף עודף במחלות לב וכלי דם.
אז עם השמנת יתר בפתוגנזה של יתר לחץ דם עורקי, שלושה מנגנונים עיקריים ממלאים תפקיד משמעותי:
הפתוגנזה של התפתחות יתר לחץ דם עורקי ומחלות לב וכלי דם בהשמנת יתר מוצגת באופן סכמטי באיור 1.
איור 1. תכנית הפתוגנזה של יתר לחץ דם עורקי ומחלות לב וכלי דם בהשמנת יתר
מערכת רנין-אנגיוטנסין-אלדוסטרון מערכתית ורקמתית ושינוייה בהשמנה
ההרכב של ה-RAAS כולל אנגיוטנסין, רנין, אנגיוטנסין I, אנזים הממיר אנגיוטנסין (ACE) ואנגיוטנסין II (AT II). ל-AT II השפעה מגוונת על תאים שונים שיש להם קולטנים ספציפיים.
לפי תפיסות קלאסיות, אנגיוטנסין נוצר בכבד ובהשפעת רנין המסונתז בתאי הפריגלומרולר של הכליות (תאים juxtaglomerular), אנגיוטנסין הופך בדם לאנגיוטנסין I. ACE אחראי לפירוק AT I, מה שגורם להיווצרות AT II.
חשוב לציין שבהשמנה ישנה הפרה של מנגנוני הוויסות של ה-RAAS. בתנאים פיזיולוגיים, עלייה בפעילות RAAS מובילה לעלייה בעמידות כלים היקפייםוכתוצאה מכך עלייה בלחץ הדם. על פי עקרון המשוב, עלייה בלחץ הדם אמורה לגרום לירידה בהפרשת רנין, לירידה ברמת AT II ולירידה בתכולת האלדוסטרון. זה, בתורו, מפחית את אצירת הנוזלים והנתרן ושומר על לחץ הדם ברמות נורמליות.
עם זאת, בחולים עם השמנה קרביים, הוויסות של רמת הרכיבים הסיסטמיים במחזור הדם של ה-RAAS נפגע. למרות עלייה בלחץ הדם, אצירת נתרן ונוזלים, ועלייה בנפח הדם במחזור הדם, פעילות רנין ואלדוסטרון בפלזמה נשארת תקינה או אפילו מוגברת מעט. חוסר ויסות כזה של ה-RAAS בהשמנת יתר עשוי לנבוע מעלייה ביצירת רכיבי RAAS ו/או עלייה משנית בריכוזם עקב פגמים במערכת הפפטידים הנטריאורטית.
נמצא כי בנוסף ל-RAAS בדם, ישנה רקמה, או מה שנקרא RAAS מקומי, אשר התגלתה במספר רקמות ואיברים, לרבות המוח, הלב, כלי הדם, הכליות, האשכים, רקמת השומן וכו'. .
כידוע, שני גורמים ממלאים תפקיד מרכזי ביצירת AT II: פעילות רנין וריכוז אנגיוטנינוגן. סינתזה והפרשה של אנגיוטנינוגן בתאים סוג אחרלא רק קובע את העלייה בריכוז המקומי של AT II, אלא גם מגביר את הפעילות המערכתית של RAAS. עירוי כרוני של AT II לעכברים לוותה בעלייה משמעותית בתכולת ה-mRNA של אנגיוטנינוגן באדיפוציטים. תוצאות אלו מצביעות על נוכחות של משוב חיובי בין AT II לבין אנגיוטנסינוגן, כאשר עלייה ברמתו של גורם אחד מגרה את היווצרותו של השני. בהשמנת יתר, במיוחד מהסוג הקרביים, פעילות רנין בפלזמה נמשכת, כאמור, במצב נורמלי או במידת מה. רמה מוגבהת, והרמות של אנגיוטנינוגן ו-AT II עולות.
מבנה ותכונות פיזיולוגיות של רקמת השומן
רקמת השומן מורכבת מסוגים שונים של תאים, כולל אדיפוציטים, מקרופאגים, פיברובלסטים, תאי אנדותל כלי דם ופראדיפוציטים (אדיפובלסטים). סוג התא האחרון מקורו בתאי גזע מזודרמים פלוריפוטנטיים. מפראדיפוציטים בגוף האדם הבוגר, נוצרים אדיפוציטים חדשים מובחנים ("קטנים"). אדיפוציטים אלו גדלים בגודלם ("אדיפוציטים גדולים") עקב צריכה מוגברת בתזונה. חומצות שומן. חומצות שומן ארוכות שרשרת חודרות לאדיפוציטים מהדם ומופקדות כטריאצילגליצרולים ניטרליים. רקמת השומן אחראית לאגירה והפרשה של חומצות שומן ארוכות שרשרת, המשמשות כאחד ממצעי האנרגיה העיקריים לאיברים ורקמות רבים, כגון שרירי הלב והשלד. אדיפוציטים "גדולים" מפרישים הרבה יותר חומצות שומן רוויות. ההידרוליזה של טריגליצרידים ושחרור חומצות שומן מתרחשות בהשפעת ליפאז רגיש להורמונים תוך תאי, שפעילותו נשלטת על ידי קטכולאמינים (ויסות חיובי) ואינסולין (ויסות שלילי).
פעילות אנדוקרינית של רקמת השומן
בניגוד שומן תת עורי, המהווה בדרך כלל 75% מכלל רקמת השומן בגוף ומהווה את האחסון העיקרי של שומנים, שומן קרביים נחשב כיום כרקמה פעילה המייצרת הורמונים.
אדיפוציטים מייצרים טווח רחבהורמונים וציטוקינים המעורבים במטבוליזם של גלוקוז (אדיפונקטין, רסיסטין וכו'), שומנים (חלבון העברת כולסטרול אסטר), דלקת (TNF-α, אינטרלוקין-6), קרישה (מעכב פלסמינוגן מפעיל-1), ויסות לחץ דם (אנגיוטנינוגן, AT II), התנהגות אכילה(לפטין), וכן משפיע על חילוף החומרים והפעילות התפקודית של איברים ורקמות שונות, לרבות שרירים, כבד, מוח וכלי דם (ראה טבלה).
שולחן. תפקוד אנדוקריניאדיפוציטים: אדיפוציטוקינים
| אדיפוציטוקינים | השפעות של אדיפוציטוקינים |
| לפטין | ספיגת מזון, מסת שומן |
| אדיפונקטין | |
| להתנגד | עמידות לאינסולין, דלקת |
| ויספטין | עמידות לאינסולין |
| omentin | עמידות לאינסולין |
| סרפין המשתחרר מרקמת הקרביים השומן (וספין) | עמידות לאינסולין |
| אפלין | הרחבת כלי דם |
| חלבון העברת כולסטרול אסטר (CETP) | חילוף חומרים שומנים |
| ליפופרוטאין ליפאז (LPL) | חילוף חומרים שומנים |
| ליפאז רגיש להורמונים (HSL) | חילוף חומרים שומנים |
| חומצות שומן קושרות חלבון באדיפוציטים-4 (A-FABP-4 (aP2)) | חילוף חומרים שומנים |
| פרליפין | חילוף חומרים שומנים |
| חלבון קושר רניטול (RBP) | חילוף חומרים שומנים |
| אצילציה מגרה חלבון (ASP) | חילוף חומרים שומנים |
| אנגיוטנסין II (AT II) | לחץ עורקי |
| אנזים הממיר אנגיוטנסין (ACE) | לחץ עורקי |
| אנגיוטנינוגן (AGT) | לחץ עורקי |
| גורם נמק גידול אלפא (TNF-a) | דַלֶקֶת |
| Interleukin, 6 (IL-6) | דַלֶקֶת |
| C-reactive protein (CRP) | דַלֶקֶת |
| טריפסין אדיפוציטים/גורם משלים D (אדיפסין) | דַלֶקֶת |
| Macrophage chemoattractant protein-1 (MCP-1) | חומר משיכה למקרופאגים |
| מולקולת הידבקות בין-תאית-1 (ICAM-1) | הפעלת מקרופאג |
| מעכב מפעיל פלסמינוגן-1 (PAI-1) | פיברינוליזה |
חשוב להדגיש שגם עלייה קטנה בנפח שומן קרבייםממלא תפקיד משמעותי בהפרעות מטבוליות, ויסות מאזן המים והאלקטרוליטים ומחלות לב וכלי דם.
עם עלייה במסת רקמת השומן, התוכן של כמעט כל האדיפוקינים בדם עולה. היוצא מן הכלל הוא אדיפונקטין, שרמתו נופלת בתנאים אלו. לפטין ואדיפונקטין הם האדיפוקינים הנחקרים ביותר כיום.
לפטין.ייצור לפטין מתרחש בעיקר באדיפוציטים "גדולים". לפטין נתפס לעתים קרובות כמולקולת איתות המתווכת את הקשר בין צריכת חומרי הזנה, רקמת השומן ומערכת העצבים המרכזית (היפותלמוס). לפטין מגביר את חמצון השומנים בכבד וכן ליפוליזה באדיפוציטים ו שרירי שלד. אינסולין ממריץ את ייצור לפטין. רמות הלפטין מושפעות גם מחומצות שומן חופשיות, TNF-α, אסטרוגנים והורמון גדילה.
אדיפונקטין.היווצרות אדיפונקטין מתרחשת אך ורק באדיפוציטים. לאדיפונקטין מגוון השפעות ביולוגיות - יש לו השפעה אנטי-אתרוגנית, מגביר את רגישות התאים לאינסולין, מעכב סינתזה של גלוקוז בכבד, משפר את הובלתו לשרירים ומגביר את חמצון חומצות השומן. רמות האדיפונקטין מופחתות בהשמנת יתר, עמידות לאינסולין וסוכרת מסוג 2.
רקמת שומן ופעילות RAAS
התברר שרקמת השומן נמצאת במקום השני אחרי הכבד ביצירת אנגיוטנינוגן. לדוגמה, כמות ה-mRNA של אנגיוטנינוגן באדיפוציטים היא כ-70% מזו שבכבד. הקשר בין רמת האנגיוטנינוגן, השמנת יתר ויתר לחץ דם עורקי מודגם בבירור בניסויים במודל של עכברים מהונדסים המבטאים כמויות מופרזות של אנגיוטנינוגן ברקמת השומן. עכברים אלו סובלים מהשמנת יתר ויתר לחץ דם. Preadipocytes והתמיינות תאי שומןיש סט שלם של רכיבים הדרושים לסינתזה המקומית של AT II, כמו גם קולטן AT 1 עבור AT II, המספק שידור תוך תאי של אותות הפעלה המופעלים על ידי AT II. עם השמנת יתר, נפח האדיפוציטים המובחן הקרביים גדל פי 20-30. השמנת יתר מאופיינת בתפקוד לקוי של אדיפוציטים, המובן כעלייה ביצירת ובהפרשה של אדיפוקינים שונים, ציטוקינים, וכן עלייה בתכולת רכיבי RAAS, בעיקר בשומן הקרביים.
בסיכום נתוני מחקרים שונים, ניתן לקבוע כי בהשמנה חלה עלייה בפעילות RAAS, המתבטאת בעובדות הבאות:
פעילות גבוהה RAAS, בתורו, מוביל לעלייה במסה של רקמת השומן. בפרט, עכברים מהונדסים המבטאים יתר על המידה אנגיוטנינוגן רק בתאי שומן הוכחו כמגבירים את רמות האנגיוטנינוגן בדם, מפתחים יתר לחץ דם ומגדילים את מסת רקמת השומן. רקמה AT II מתפקדת למעשה כגורם גדילה לאדיפוציטים. AT II הפועל על קולטני AT 1 גורם לעלייה בחלבון cyclin D 1, המעורב בוויסות הצמיחה והחלוקה של תאי השומן. הוכח כי AT II משרה את המעבר של שלב G 1 מחזור התאבפראדיפוציטים אנושיים. השפעה זו הייתה קשורה להשפעה על קולטני AT 1 והפעלה שלאחר מכן של קינאז תלוי cyclin D 1.
הוכח כי AT II גורם להתמיינות של קדם-אדיפוציטים, מפעיל אנזימים מרכזיים של יצירת שומנים (ליפוגנזה) ומגביר את הצטברות הטריגליצרידים באדיפוציטים.
השמנה קרביים מלווה בעלייה בפעילות של 11-beta-hydroxysteroid dehydrogenase מסוג 1, המובילה ליצירת קורטיזול, הורמון מפתח בהתמיינות הפראדיפוציטים לאדיפוציטים.
הפעילות של RAS רקמות קשורה קשר הדוק לייצור אדיפוקינים על ידי רקמת שומן. לדוגמה, הוכח כי AT II מעורר ביטוי לפטין באדיפוציטים. הוצע כי פעילות כזו אופיינית רק ל-AT II המסונתז מקומית, בניגוד ל-AT II מערכתית.
השמנת יתר ופעילות מערכת העצבים הסימפתטית
בהשמנת יתר, במיוחד בגרסה הבטנית שלה, נצפית לעתים קרובות מאוד הפעלה של מערכת העצבים הסימפתטית. מחקר ההזדקנות הנורמוטיסטי (NAS) מצא עלייה בכמות הנוראפינפרין בשתן פרופורציונלית לאינדקס מסת הגוף. עם ירידה במשקל, הפעילות של מערכת העצבים הסימפתטית פוחתת.
פעילות מוגברת של מערכת העצבים הסימפתטית בהשמנת יתר תורמת לנוכחות היפראינסולינמיה ועמידות לאינסולין. אינסולין יכול להגביר את הפעילות של המערכת הסימפתואדרנלית בעצמו, אך ייתכן שהדבר נובע בחלקו מפעולת הלפטין. ידוע שככל שדרגת ההשמנה עולה, עולה רמת הלפטין בצום, המופרש על ידי אדיפוציטים. לפטין מגביר את פעילות מערכת העצבים הסימפתטית, במיוחד בכליות. הדבר מוביל, מצד אחד, לתפוקה גבוהה ולעלייה בקצב הלב, ומצד שני, לעלייה בספיגה מחדש של נתרן ולעלייה בנפח הדם התוך-וסקולרי.
הוכחה נוכחות של מערכת יחסים בין ה-RAAS למערכת העצבים הסימפתטית. עלייה בהפרשת רנין בכליות קשורה להפעלת מערכת העצבים הסימפתטית, וזו מתרחשת ללא קשר למערכת התוך-כליתית. מערכת החושיםמסדיר את הפרשת הרנין על ידי הכליות. יתר על כן, עלייה באדנוזין מונופוספט מחזורי בהשפעת קטכולאמינים מגרה את הביטוי של אנגיוטנינוגן באדיפוציטים אנושיים. עלייה ברמת AT II מגבירה את פעילות מערכת העצבים הסימפתטית בבני אדם. הוכח כי AT II מפעיל את מערכת העצבים הסימפתטית המקומית המעורבת בעלייה בטמפרטורת הגוף (תרמוגנזה). טיפול בקור מוביל לעלייה בתכולת AT II באדיפוציטים ללא שינוי נלווה ברמת AT II בפלזמה.
לפיכך, חוסר ויסות RAAS בהשמנה מסוגל גם לעורר את פעילות מערכת העצבים הסימפתטית.
שיטות לתיקון תרופתי של לחץ דם מוגבר בהשמנת יתר
התרומה של מנגנונים פתוגנטיים שונים לשמירה על לחץ דם גבוה בהשמנת יתר עשויה להיות שונה. לכן, במצב זה, תרופות להורדת לחץ דם במגוון מנגנוני פעולה עשויות להשפיע לטובה.
בהתאם להמלצות העדכניות לטיפול ביתר לחץ דם עורקי, המפתח להצלחת הפחתה משמעותית בלחץ הדם הוא השימוש בטיפול משולב. עבור חולים עם השמנת יתר, קודם כל, המרכיבים העיקריים של טיפול כזה צריכים להכיל שילוב של תרופות המפחיתות את פעילות ה-RAAS (מעכבי ACE וסרטנים), תרופות המפחיתות את פעילות מערכת העצבים הסימפתטית (חוסמי β ו- נוגדי סידן שאינם דיהידרופירידין), ומשתנים. יעילות גבוהההשימוש בתרופות החוסמות את ה-RAAS בהשמנת יתר הוכח במחקרים רבים. לגבי השימוש בחוסמי β, הנתונים סותרים מאוד, בעיקר בשל ספקות לגבי התועלת שלהם לטיפול בחולים עם יתר לחץ דם עורקי לא פשוט, ושנית, בשל העובדה שחסמי β, לפחות קלאסיים, יכולים לעלות משקל החולים והגברת תנגודת לאינסולין. לכן, אם חוסמי β נבחרים לטיפול בחולים עם השמנת יתר או תסמונת מטבולית, אז אלה צריכות להיות תרופות בעלות תכונות מיוחדות, בפרט, קרוודילול ונביבולול.
יחד עם זאת, הוכח כי אנטגוניסט סידן שאינו דיהידרופירידין ורפמיל יכול לא רק להפחית משמעותית את לחץ הדם, אלא גם להפחית את פעילות מערכת העצבים הסימפתטית.
לפיכך, במקרה של השמנת יתר, ניתן להשתמש בשילוב של תרופות חוסמות RAAS ו-verpamil לטיפול ביתר לחץ דם עורקי.
יש להדגיש כי סוג זה של שילוב תרופותקיים בצורה של משולב מוכן צורת מינון- התרופה Tarka, המכילה בהרכבה מעכב ACE מסיס בשומן - טרנדולפריל ו-Verapamil בשחרור איטי (verapamil SR). גישה זו חשובה מאוד לטיפול יעיל, שכן השימוש בצורות מינון מוגמרות משפר את דבקות המטופל לטיפול.
קיימות עדויות לכך שטרקה מפחיתה את לחץ הדם במידה רבה יותר מכל מרכיביה, בעלת יכולת בולטת להפחית היפרטרופיה של חדר שמאל, תורמת לנורמליזציה של תפקוד האנדותל, והיא ניטרלית מבחינה מטבולית, גם בחולי סוכרת.
פעולה כפולה- ירידה בפעילות RAAS בהשפעת טרנדולפריל ומערכת העצבים הסימפתטית עקב פעולה ממושכת של ורפמיל - מספקים השפעה חשובה על מנגנונים פתוגנייםהתפתחות יתר לחץ דם עורקי בהשמנת יתר ומנגנונים המעוררים נזק לאברי מטרה בסוג זה של יתר לחץ דם.
תשומת לב מיוחדת, כאשר דנים בטיפול ביתר לחץ דם בהשמנת יתר, יש לשים לב לכך שטיפול המבוסס על שילוב של טרנדלפריל עם ורפמיל ארוך טווח יכול להפחית את הסיכון לפתח סוכרת בהשוואה לשימוש בטקטיקה טיפולית אחרת - שילוב של סרטן. עם מינון נמוך של משתן תיאזיד. תוצאות מחקר STAR מראות בבירור שכאשר משתמשים ב-Tarka למשך שנה, מתפתחים פחות אנשים עם תסמונת מטבולית, שבה השמנה בטנית מקבלת תפקיד דומיננטי. סוכרת(איור 2).
איור 2. התפתחות מקרים חדשים של סוכרת (גלוקוז בצום > 126 מ"ג/ד"ל או בדיקת סבילות לגלוקוז של שעתיים > 200 מ"ג/ד"ל) לפי סוג טיפול להורדת לחץ דם באנשים עם תסמונת מטבולית במחקר STAR

בנוסף, על פי מחקר STAR-LET, גם אם סוכרת מתרחשת על רקע טיפול תרופתיהעברת חולים אלה לקבלת התרופה Tarka אפשרה למחצית מהחולים לנרמל חילוף חומרים של פחמימות.
תוצאות המחקרים הללו מחייבות לשקול מחדש המלצות לגבי טיפול תרופתייתר לחץ דם אצל אנשים עם תסמונת מטבולית ולהתחיל טיפול בשילוב המכיל מעכב ACE (או סרטן) ואנטגוניסט לסידן, או להעביר חולים לטיפול כזה.
כפי שהוזכר שוב ושוב, לטיפול ביתר לחץ דם עורקי, הפחתת משקל החולים ומידת ההשמנה הבטנית משחקת תפקיד חשוב. כמובן שלירידה במשקל בדרך זו או אחרת יכולה להיות השפעה משמעותית על הפחתת השכיחות של מחלות לב וכלי דם. נכון לעכשיו, קיימות גישות שונות לטיפול תרופתי בהשמנת יתר. הראשון הוא טיפול סימפטומטי, כלומר, הפחתת מספר הקלוריות הנצרכות על ידי הפחתת ספיגת השומן מהמזון. גישה כזו יכולה להיקרא מפצה. ואכן, בטיפול כזה, המחלה אינה מסולקת (מאחר שהחולה ממשיך לאכול יתר על המידה), אלא מפוצה רק באופן זמני על ידי התרופה. גישה נוספת לטיפול בעודף משקל והשמנה היא לטפל בשורש הבעיה, כלומר אכילת יתר כרונית. כך פועלת סיבוטרמין (התרופה של מרידיה). זה מוביל להופעת רוויה מהירה, מפחית את כמות המזון הנצרכת על ידי דיכוי ספיגה חוזרת של נוראפינפרין וסרוטונין בסינפסות של מעגלים עצביים. היום מרידיה היא היחידה תרופה מקוריתביטול הגורם להשמנה.
ההבדל המהותי בין סיבוטרמין הוא שבלי לגרום לירידה בתיאבון, הוא תורם להופעה מוקדמת יותר של תחושת שובע. אדם נפטר מההרגל הפתולוגי של אכילת יתר, וכתוצאה מכך ירידה הדרגתית וקבועה במשקל הגוף. בהשפעת סיבוטרמין, צריכת המזון מופחתת בכ-20%. יחד עם זה, סיבוטרמין משפיע בעקיפין על רמת האמינים הביוגניים בדם, המפעילים אדרנורצפטורים ברקמת השומן ומתניעים ליפוליזה באדיפוציטים, המלווה בשינוי בתכולת מצעי האנרגיה בדם. סיבוטרמין, עקב הפעלת קולטני β 2 - ו- β 3 -אדרנרגיים, משפר את תהליכי התרמוגנזה ומגביר את צריכת האנרגיה בגוף.
היעילות הקלינית והבטיחות של סיבוטרמין (מרידיה) הוכחו ב במספרים גדוליםלימודים רב מרכזיים. בפרט, במחקר STORM (Sibutramine Trial on Obesity Reduction and Maintenance), שכלל 605 חולים שמנים, הוכח שצריכה של סיבוטרמין במשך שנתיים הפחיתה את משקל החולים פי 3, ואת היקף המותניים - פי 2 יותר. בולט מאשר פלצבו. . חשוב לציין, 80% מהמטופלים שמרו על הירידה במשקל במשך שנתיים בהשוואה ל-16% מחולי הפלצבו (p< 0,001). Показательно, что при этом улучшался липидный спектр: уровень липопротеидов צפיפות גבוההעלה ב-21% עם ירידה ברמות ליפופרוטאין וטריגליצרידים בצפיפות נמוכה.
ההשפעה החיובית של הפחתת משקל בטיפול בחולים עם יתר לחץ דם עורקי ומחלות לב וכלי דם אחרות עשויה להיות גם שהפחתת השומן התוך בטני יכולה להפחית את הדחיסה המכנית של הכליות, מה שעלול להוביל לשיפור באספקת הדם שלהם. ירידה בפעילות RAAS. הפחתת רקמת השומן בכליות ובסביבתה יכולה להוביל לירידה בלחץ הבין-סטיציאלי, דחיסה של החלק הדק של הלולאה של הנלי, עלייה בזרימת הדם ב-vasa recta וירידה בספיגה חוזרת של Na+ ומים. לפיכך, ירידה במשקל הנגרמת על ידי שיטות של תיקון לא תרופתי או תרופתי יכולה להפחית את גובה לחץ הדם.
עם זאת, עד לאחרונה, במציאות פרקטיקה קליניתהשתמשו בסיבוטרמין בזהירות, מחשש שזה אפשרי השפעה שליליתעל לחץ הדם וקצב הלב, אשר בתורם עלולים להוביל, אם כי במספר קטן של חולים, לא נעים רגשות סובייקטיביים. כדי לחקור את השפעת הסיבוטרמין על מערכת הלב וכלי הדם ולהוכיח את בטיחות התרופה בקבוצת חולים עם סיכון מוגבר למחלות לב וכלי דם, מחקר בינלאומי רב-מרכזי, כפול סמיות, מבוקר פלצבו SCOUT (Sibutramine Cardiovascular) OUTcomes) החלה, שם נצפו 10,742 חולים, מתוכם 97% סבלו ממחלות של מערכת הלב וכלי הדם, 88 - יתר לחץ דם עורקי ו-84% - סוכרת מסוג 2. על פי תוצאות השלב הראשון שהושלם במחקר, נמצא כי מינוי סיבוטרמין הוביל ל(p< 0,001) уменьшению веса (медиана изменения составила 2,2 кг), окружности талии (на 2 см в равной степени выраженному у мужчин и женщин) и снижению АД систолического на 3,0 мм рт. ст. и диастолического - на 1,0 мм рт. ст. Частота сердечных сокращений увеличивалась в среднем на 1,5 удара в минуту. Увеличение АД и увеличение частоты пульса наблюдалось соответственно у 4,7 и 3,5% пациентов. Таким образом, в данном исследовании было показано, что даже у пациентов, относящихся к группам высокого риска, применение сибутрамина (препарата Меридиа) было высокоэффективным и безопасным . Дальнейший анализ данных исследования SCOUT позволил установить, что у пациентов с артериальной гипертонией снижение АД при приеме сибутрамина было более выраженным и составило в среднем для систолического АД -6,5 (-27,0; 8,0) мм рт. ст., а для диастолического -2,0 (-15,0; 8,0) мм рт. ст. (p < 0,001). Среди пациентов, у которых снижение веса не было выраженным, снижение АД было достоверным, но менее выраженным, чем у лиц с успешным снижением веса, и составило в среднем для систолического -3,5 (-26,0; 10,0) мм рт. ст. и -1,5 (-16,0; 9,0) мм рт. ст. для диастолического АД (p < 0,001). У лиц с нормальным АД было достоверное, но не выраженное увеличение АД - 1,5 (-15,0; 19,5) мм рт. ст. систолического и на 1,0 (-10,5; 13,0) мм рт. ст. диастолического АД (p < 0,001). Степень повышения АД при приеме сибутрамина уменьшалась в соответствии со степенью потери веса .
מתעוררת שאלה טבעית כיצד סוג זה או אחר של טיפול נגד יתר לחץ דם יתאם לטיפול בסיבוטרמין. על מנת לענות על שאלה זו בוצעו מספר מחקרים. לדוגמה, הוכח כי השימוש בצורת מינון משולבת המכילה וראפמיל 180 מ"ג / טרנדולפריל 2 מ"ג בשילוב עם סיבוטרמין 10 מ"ג הוביל לירידה בולטת יותר בלחץ הדם במשך 6 חודשים מאשר טיפול נוגד לחץ דם בלבד - לחץ הדם הסיסטולי ירד, בהתאמה. ב-21.9 ± 8.1 לעומת 15.9 ± 12.3 מ"מ כספית. אומנות. ודיאסטולי - ב-15.7 ± 8.1 לעומת 9.1 ± 9.9 מ"מ כספית. אומנות. (p = 0.03). טיפול משולב הוביל גם לשיפור בולט יותר בפרמטרים אנתרופומטריים; אמין (עמ'<5) по сравнению с исходным уровнем снижение малых липопротеидов низкой плотности, С-реактивного белка и висфатина наблюдалось только в группе пациентов, получавших комбинированную терапию сибутрамином с антигипертензиным препаратом Тарка .
במחקר פרוספקטיבי, רב-מרכזי, מבוקר פלצבו, כפול סמיות (Hypertension-Obesity-Sibutramine) במשך 16 שבועות, נערכה השוואה בין הביצועים של משטרי נוגדי לחץ דם שונים (פלודיפין 5 מ"ג / רמיפריל 5 מ"ג (n=57) , וראפמיל 180 מ"ג ליום). טרנדולפריל 2 מ"ג (n = 55), metoprolol succinate 95 מ"ג/הידרוכלורותיאזיד 12.5 מ"ג n = 59) עם סיבוטרמין ופלסבו. במחקר זה, אושר כי סיבוטרמין יכול להגביר את לחץ הדם. לכן, כמובן, יש צורך לבצע טיפול נוגד לחץ דם כראוי במהלך תקופת השימוש בסיבוטרמין בחולים עם יתר לחץ דם עורקי. כמו כן, הוכח כי בטיפול בשילוב של חוסם β והידרוכלורותיאזיד, ההשפעות החיוביות של סיבוטרמין על ירידה במשקל, היקף מותניים וההשפעה על הפרופיל המטבולי היו פחות בולטות באופן משמעותי מאשר בשילוב של טיפול משולב עם ACE. מעכבים ואנטגוניסטים לסידן עם סיבוטרמין. זה שוב מאשר את הצורך בבחירה קפדנית של טיפול נגד יתר לחץ דם בחולים עם השמנת יתר, במיוחד בעת ביצוע תוכניות שמטרתן ירידה במשקל. לסיכום, יש לציין כי מנקודת מבטנו, אחת הבעיות המשמעותיות המפחיתות את יעילות המאבק בהשמנה היא שלא הרופאים ולא הציבור רואים בהשמנה גורם סיכון משמעותי. יתרה מכך, מטופלים לרוב אינם מגדירים את עצמם כשמנים. לדוגמה, במחקר POLONEZ, על פי הערכת הרופאים המבוססת על BMI, השמנת יתר אצל גברים ונשים נרשמה בתדירות גבוהה פי שלושה מאשר בדיווח עצמי של חולים. לפיכך, יש לחזק ולבצע עבודת הסבר בקרב האוכלוסייה על הצורך במניעת עלייה במשקל, תיקון השמנת יתר קיימת וחשיבות טיפול מתמשך ביתר לחץ דם עורקי. סִפְרוּת
1. Flegal K.M., Carroll M.D., Ogden C.K., Johnson C.L. שכיחות ומגמות בהשמנת יתר בקרב מבוגרים בארה"ב, 1999-2000. JAMA 2002; 288:1723-7.
2. Pi-Sunyer F.X. האפידמיולוגיה של חלוקת שומן מרכזית ביחס למחלות. Nutr Rev 2004; 62(7): 120-6.
3. ארבני סי.מ. מענה לצורך הרפואי הבלתי מסופק בטיפולים בטוחים ויעילים להרזיה. Obes Res 2004; יב(8): 1191-6.
4. Stamler J., Rose G., Stamler R., et al. ממצאי מחקר INTERSALT. השלכות בריאות הציבור והרפואה. יתר לחץ דם 1989; 14(5): 570-7.
5. Jedrychowski W., Mroz E., Bojanczyk M., Jedrychowska I. משקל יתר ויתר לחץ דם בקשישים - תוצאות המחקר הקהילתי. Arch Gerontol Geriatr 1991; 13(1): 61-9.
6. Kanai H., Tokunaga K., Fujioka S., et al. ירידה בשומן הקרביים התוך בטני עשויה להפחית את לחץ הדם בנשים עם יתר לחץ דם. יתר לחץ דם 1996; 27(1): 125-9.
7. Poirier P., Giles T.D., Bray G.A., et al. איגוד הלב האמריקאי; ועדת השמנת יתר של המועצה לתזונה, פעילות גופנית וחילוף חומרים. השמנת יתר ומחלות לב וכלי דם: פתופיזיולוגיה, הערכה והשפעה של ירידה במשקל: עדכון של ההצהרה המדעית של איגוד הלב האמריקאי משנת 1997 על השמנת יתר ומחלות לב מוועדת ההשמנה של המועצה לתזונה, פעילות גופנית ומטבוליזם. תפוצה 2006; 113: 898-918.
8 אלפרט מ.א. קרדיומיופתיה של השמנת יתר; פתופיזיולוגיה ואבולוציה של התסמונת הקלינית. Am J Med Sci 2001; 321:225-36.
9. Aneja A., El-Atat F., McFarlane S.I., Sowers J.R. יתר לחץ דם והשמנה. Recent Progr Horm Res 2004; 59:169-205.
10. אנגלי ש., שארמה א.מ. מערכת רנין-אנגיוטנסין ופפטידים נטריאורטיים ביתר לחץ דם הקשור להשמנה. J Mol Med 2001; 79:21-9.
11. Lafontan M., Moro C., Sengenes C., et al. תפקיד מטבולי בלתי נחשד לפפטידים נטריאורטיים פרוזדורים: שליטה בליפוליזה, גיוס שומנים ורמות חומצות שומן לא-אסטרימיות בבני אדם. Arterioscler Thromb Vasc Biol 2005; 25:2032-42.
12. אולם J.E. הכליות, יתר לחץ דם והשמנה. יתר לחץ דם 2003; 41(3): 625-33.
13. Cooper R., McFarlane Anderson N., Bennet F.I., et al. ACE, אנגיוטנינוגן והשמנת יתר: מסלול פוטנציאלי המוביל ליתר לחץ דם. J Hum Hypertens 1997; 11:107-11.
14. Lu H., Boustany-Kari C.M., Daugherty A., Cassis L.A. אנגיוטנסין II מגביר ביטוי אנגיוטנסין שומני. Am J Physiol Endocrinol Metab 2007; 292:1280-7.
15. אנגלי ש., נגרל ר., שארמה א.מ. פיזיולוגיה ופתופיזיולוגיה של מערכת רנין-אנגיוטנסין רקמת השומן. יתר לחץ דם 2000; 35(6): 1270-7.
16. Otto T.C., Lane M.D. התפתחות שומנית: מתא גזע לאדיפוציט. Crit Rev Biochem Mol Biol 2005; 40:229-42.
17. Hajer G.R., van Haeften T.W., Visseren F.L.J. תפקוד לקוי של רקמת השומן בהשמנת יתר, סוכרת ומחלות כלי דם. Eur Heart J 2008; 29:2959-71.
18. Wannamethee S.G., Lowe G.D., Rumley A., et al. אדיפוקינים וסיכון לסוכרת מסוג 2 בגברים מבוגרים. סוכרת Core 2007; 30:1200-5.
19. Chu N.F., Spiegelman D., Hotamisligil G.S., et al. רמות אינסולין בפלזמה, לפטין ורמות קולטן TNF מסיסים ביחס לגורמי סיכון למחלות קרדיו-וסקולריות אתרוגניות וטרומבוגניות הקשורות להשמנה בקרב גברים. טרשת עורקים 2001; 157:495-503.
20. Skurk T., Alberti-Huber C., Herder C., Hauner H. קשר בין גודל אדיפוציטים לבין ביטוי והפרשת אדיפוקין. J Clin Endocrinol Metab 2007; 6(92): 1023-33.
21. Ran J., Hirano T, Fukui T., et al. עירוי אנגיוטנסין II מפחית את רמת האדיפונקטין בפלסמה באמצעות קולטן מסוג 1 בחולדות: השלכה על תנגודת לאינסולין הקשורה ליתר לחץ דם. מטבוליזם 2006; 55:478-88.
22. Considine R.V., Sinha M.K., Heiman M.L., et al. ריכוז אימונראקטיבי-לפטין בסרום בבני אדם בעלי משקל תקין והשמנת יתר. N Engl J Med 1996; 334:292-5.
23. Schwartz M.W., Woods S.C., Porte D. Jr., et al. שליטה במערכת העצבים המרכזית על צריכת המזון. טבע 2000; 404(6778): 661-71.
24. Cheung C.C., Clifton D.K., Steiner R.A. נוירוני פרואופיומלנוקורטין הם מטרות ישירות ללפטרין בהיפותלמוס. אנדוקרינולוגיה 1997; 138; 4489-92.
25 Long Y.C., Zierath J.R. איתות חלבון קינאז המופעל על ידי AMP בוויסות מטבולי. J Clin Invest 2006; 116:1776-83.
26. Saladin R., De Vos P., Guerre-Millo M., et al. עלייה חולפת בביטוי גנים שמנים לאחר מתן מזון או אינסולין. טבע 1995; 377:527-9.
27. Zhang H.H., Kumar S., Barnet A.H., Eggo M.C. גורם נמק גידול-אלפא מפעיל השפעות כפולות על סינתזה ושחרור לפטין שומני אנושי. Mol Cell Endocrinol 2000; 159:79-88.
28. Lindsay R.S., Funahashi T., Hanson R.L., et al. אדיפונקטין והתפתחות סוכרת מסוג 2 באוכלוסיית פימה ההודית. Lancet 2002; 360:57-8.
29. Hajer G.R., van der Graaf Y., Olijhoek J.K., et al. רמות נמוכות בפלזמה של אדיפונקטין קשורות בסיכון נמוך לאירועים קרדיווסקולריים עתידיים בחולים עם מחלת כלי דם בולטת קלינית. Am Heart J 2007; 154(750): 1-7.
30. Massiera F., Bloch-Faure M., Ceiler D., et al. אנגיוטנינוגן שומני מעורב בצמיחת רקמת שומן וויסות לחץ הדם. FASEB J 2001; 15:2727-9.
31. Paul M., Mehr A.P., Kreutz R. פיזיולוגיה של מערכות רנין-אנגיוטנסין מקומיות. Physiol Rev 2006; 86:747-803.
32. Karlsson C., Lindell K., Ottosson M., et al. רקמת שומן אנושית מבטאת אנגיוטנסין ואנזימים הדרושים להפיכתו לאנגיוטנסין II. J Clin Endocrinol Metab 1998; 83:3925-9.
33. Gorzelniak K., Engeli S., Janke J., et al. ויסות הורמונלי של מערכת רנין-אנגיוטנסין רקמת השומן האנושית: קשר להשמנה ויתר לחץ דם. J Hypertens 2002; 20:965-73.
34. אנגלי ש', גורזלניאק ק', קרויץ ר' ואח'. ביטוי משותף של גנים של מערכת רנין-אנגיוטנסין ברקמת שומן אנושית. J Hypertens 1999; 17:555-60.
35. Achard V., Boullu-Ciocca S., Desbriere R., et al. ביטוי קולטן לרנין ברקמת שומן אנושית. Am J Physiol Regul Integr Comp Physiol 2007; 292:274-82.
36. Sarzani R., Savi F., Dessi-Fulgheri P., Rappelli A. Renin-angiotensin system, פפטידים נטריאורטיים, השמנת יתר, תסמונת מטבולית ויתר לחץ דם: השקפה משולבת באדם. J Hypertens 2008; 26:831-43.
37. Crandall D.L., Armellino D.C., Busler D.E., et al. קולטני אנגיוטנסין II בפראדיפוציטים אנושיים: תפקיד בוויסות מחזור התא. אנדוקרינולוגיה 1999; 140:154-8.
38. Saint-Marc P., Kozak L.P., Ailhaud G., et al. אנגיוטנסין II כגורם טרופי של רקמת שומן לבנה: גירוי של היווצרות תאי שומן. אנדוקרינולוגיה 2001; 142:487-92.
39. Watanabe G., Lee R.J., Albanese C., et al. הפעלת אנגיוטנסין II של פעילות קינאז תלויה ציקלין D1. J Biol Chem 1996; 271:22570-7.
40. Darimont C., Vassaux G., Ailhaud G., Negrel R. בידול של תאים preadipose: תפקיד paracrine של prostacyclin עם גירוי של תאי שומן על ידי אנגיוטנסין-II. אנדוקרינולוגיה 1994; 135:2030-6.
41. Jones B.H., Standridge M.K., Moustaid N. Angiotensin II מגביר ליפוגנזה ב-3T3-L1 ובתאי שומן אנושיים. אנדוקרינולוגיה 1997; 138:1512-9.
42. Wake D.J., Walker B.R. עיכוב של 11beta-hydroxysteroid dehydrogenase סוג 1 בהשמנת יתר. Endocrine 2006; 29:101-8.
43. Engeli S., Bohnke J., Feldpausch M., et al. ויסות של גנים 11beta-HSD ברקמת שומן אנושית: השפעה של השמנה מרכזית וירידה במשקל. Obes Res 2004; 12:9-17.
44. Kim S., Whelan J., Claycombe K., et al. אנגיוטנסין II מגביר את הפרשת הלפטין על ידי 3T3-L1 ואדיפוציטים אנושיים באמצעות מנגנון בלתי תלוי פרוסטגלנדין. J Nutr 2002; 132:1135-40.
45. Cassis L.A., English V.L., Bharadwaj K., Boustany C.M. השפעות דיפרנציאליות של אנגיוטנסין II מקומי לעומת מערכתי בוויסות שחרור לפטין משומן. אנדוקרינולוגיה 2004; 145:169-74.
46. Mancia G., Bousquet P., Elghozi J.L., et al. מערכת העצבים הסימפתטית והתסמונת המטבולית. J Hypertens 2007; 25:909-20.
47. Tentolouris N., Liatis S., Katsilambros N. פעילות מערכת סימפטית בהשמנה ותסמונת מטבולית. Ann N Y Acad Sci 2006; 1083:129-52.
48. Landsberg L., Troisi R., Parker D., et al. השמנת יתר, לחץ דם ומערכת העצבים הסימפתטית. אן אפידמיול 1991; 1:295-303.
49. Serazin V., Dos Santos E., Morot M., Giudicelli Y. ביטוי והפרשת גן אנגיוטנינוגן שומני אנושי מעוררים על ידי AMP מחזורי באמצעות פעילות מוגברת של DNA מחזורי AMP מגיב לאלמנטים. Endocrine 2004; 25:97-104.
50. קסיס ל.א. תפקידו של אנגיוטנסין II בתרמוגנזה שומנית חומה במהלך אקלום קר. Am J Physiol Endocrinol Metab 1993; 265:860-5.
51. Cassis L.A., Dwoskin L.P. אפנון פרה-סינפטי של שחרור נוירוטרנסמיטר על ידי אנגיוטנסין II אנדוגני ברקמת שומן חומה. J Neural Transm 1991; 34:129-37.
52. רייסין E., Weir M., Falkner B., et al. Lisinopril לעומת הידרוכלורותיאזיד בחולים עם יתר לחץ דם שמנים: ניסוי מבוקר פלצבו רב מרכזי. קבוצת המחקר לטיפול בחולים שמנים עם יתר לחץ דם (TROPHY). יתר לחץ דם 1997; 30(1): 2140-5.
53. Neutel J.M., Saunders E., Bakris G.L., et al. היעילות והבטיחות של שילובים קבועים במינונים נמוכים וגבוהים של אירבסארטן/הידרוכלורותיאזיד בחולים עם לחץ דם סיסטולי בלתי מבוקר במונותרפיה: ניסוי INCLUSIVE. J Clin Hypertens (Greenwich) 2005; 7(10): 578-86.
54. Belenkov Yu.N., Chazova I.E., Mychka V.B. מטעם קבוצת המחקר "ECO". מחקר רב-מרכזי, אקראי, פתוח של היעילות של שינויים באורח החיים וטיפול במעכבי ACE (quinapril) בחולים שמנים עם יתר לחץ דם עורקי (IVF). יתר לחץ דם עורקי 2003; 9(6): 3-6.
55. Jacob S., Rett K., Henriksen E.J. טיפול להורדת לחץ דם ורגישות לאינסולין: האם עלינו להגדיר מחדש את תפקידם של חומרים חוסמי בטא? Am J Hypertens 1998; 11(10): 1258-65.
56. Kaaja R., Kujala S., Manhem K., et al. השפעות של טיפול סימפטוליטי על מדדי רגישות לאינסולין בנשים עם יתר לחץ דם לאחר גיל המעבר. Int J Clin Pharmacol Ther 2007; 45(7): 394-401.
57. Kuperstein R., Sasson Z. השפעות של טיפול נגד יתר לחץ דם על חילוף החומרים של גלוקוז ואינסולין ועל מסת החדר השמאלי: מחקר אקראי, כפול סמיות, מבוקר של 21 אנשים שמנים יתר לחץ דם. תפוצה 2000; 102(15): 1802-6.
58. Halperin A.K., Cubeddu L.X. תפקידם של חוסמי תעלות סידן בטיפול ביתר לחץ דם. Am Heart J 1986; 111(2): 363-82.
59. מקאליסטר ר.ג. ג'וניור פרמקולוגיה קלינית של חומרים חוסמי ערוצים איטיים. Prog Cardiovasc Dis 1982; 25(2): 83-102.
60. Binggeli C., Corti R., Sudano I., et al. השפעות של חסימת תעלות סידן כרונית על פעילות העצבים הסימפתטיים ביתר לחץ דם. יתר לחץ דם 2002; 39(4): 892-6.
61. Lefrandt J.D., Heitmann J., Sevre K., et al. ההשפעות של כיתות אנטגוניסטים של דיהידרופירידין ופנילאלקימין סידן על תפקוד אוטונומי ביתר לחץ דם: מחקר VAMPHYRE. Am J Hypertens 2001; 14(11): 1083-9.
62. Wanovich R., Kerrish P., Gerbino P.P., Shoheiber O. דפוסי היענות של חולים שטופלו ב-2 חומרים נפרדים להורדת לחץ דם לעומת טיפול משולב במינון קבוע Am J Hypertens 2004; 175:223.
63. Dezii C.M. מחקר רטרוספקטיבי של התמדה בטיפול משולב בכדור בודד לעומת טיפול מקביל בשני גלולות בחולים עם יתר לחץ דם. טיפול ניהולי. 2000; 9(9): 2-6.
64. Gerbino P.P., Shoheiber O. דפוסי דבקות בקרב חולים המטופלים בשילוב מינון קבוע לעומת תרופות נפרדות להורדת לחץ דם. Am J Health Syst Pharm 2007; 64(12): 1279-83.
65. Jackson K. התמדה של שילוב קבוע לעומת חופשי עם valsartan ו- HCTZ עבור חולים עם יתר לחץ דם. Value Health Suppl 2006; 9:363.
66. Aepfelbacher F.C., Messerli F.H., Nunez E., Michalewicz L. השפעות קרדיווסקולריות של שילוב trandolapril/verapamil בחולים עם יתר לחץ דם חיוני קל עד בינוני. Am J Cardiol 1997; 79(6): 826-8.
67. Reynolds N.A., Wagstaff A.J., Keam S.J. שחרור מושהה של טרנדולפריל/וראפמיל: סקירה של השימוש בו בטיפול ביתר לחץ דם חיוני. סמים 2005; 65(13): 1893-914.
68. Sharma S.K., Ruggenenti P., Remuzzi G. ניהול יתר לחץ דם בחולי סוכרת - התמקדות בשילוב trandolapril/verapamil. Vasc Health Risk Management 2007; 3(4): 453-65.
69. Bakris G., Molitch M., Hewkin A., et al. הבדלים בסבילות לגלוקוז בין שילובי תרופות להורדת לחץ דם במינון קבוע אצל אנשים עם תסמונת מטבולית. Diabetes Care 2006; 29(12): 2592-7.
70. Bakris G., Molitch M., Zhou Q., et al. היפוך של סבילות לקויה לגלוקוז הקשורה למשתנים וסוכרת חדשה: תוצאות של מחקר STAR-LET. J Cardiometab Syndr 2008; 3(1): 18-25.
71. Bailey C.J., Day C. גישות פרמקולוגיות חדשות להשמנה. תרגול השמנת יתר 2005; 1:2-5.
72. ינובסקי ש.ז., ינובסקי י.א.י. הַשׁמָנָה. N Engl J Med 2002; 346(8): 591-602.
73. יום ג', ביילי סי ג'יי. עדכון סיבוטרמין. Br J Diabetes Vasc Dis 2002; 2:392-7.
74. James W.P., Astrup A., Finer N., et al. השפעת סיבוטרמין על שמירה על משקל לאחר ירידה במשקל: ניסוי אקראי. קבוצת לימוד STORM. ניסוי סיבוטרמין להפחתת השמנת יתר ותחזוקה. Lancet 2000; 356:2119-25.
75. Torp-Pedersen C., Caterson I., Coutinho W., et al. תגובות קרדיווסקולריות לניהול משקל וסיבוטרמין בנבדקים בסיכון גבוה: ניתוח מניסוי SCOUT. Eur Heart J 2007; 28(23): 2915-23.
76. Sharma A.M., Caterson I.D., Coutinho W., et al. שינויים בלחץ הדם הקשורים לסיבוטרמין ולניהול משקל - ניתוח מתקופת ההובלה בת 6 השבועות של ניסוי התוצאות הקרדיווסקולריות של סיבוטרמין (SCOUT). Diabetes Obes Metab 2008. doi 10.1111/J.1463-1326.2008.00930.
77. Nakou E., Filippatos T.D., Liberopoulos E.N., et al. השפעות של שילוב שחרור מושהה של סיבוטרמין עם ורפאמיל/טרנדולפריל על לחץ דם ומשתנים מטבוליים בחולים עם יתר לחץ דם שמנים. מומחה Opin Pharmacother 2008; 9(10): 1629-39.
78. Scholze J., Grimm E., Herrmann D., et al. טיפול אופטימלי ליתר לחץ דם הקשור להשמנה: מחקר יתר לחץ דם-השמנה-סיבוטרמין (HOS). תפוצה 2007; 115(15): 1991-8.
79. גלזר מ.ג. תוצאות המחקר הרוסי POLONEZ (יעילות ובטיחות של ENARENAL במטופלים עם יתר לחץ דם עורקי). ארכיון טיפולי 2006; 4:44-50.
לציטוט: Leonova M.V. תרופות חדשות ומבטיחות החוסמות את מערכת הרנין-אנגיוטנסין-אלדוסטרון // RMJ. סקירה רפואית. 2013. מס' 17. ש' 886
תפקידה של מערכת הרנין-אנגיוטנסין-אלדוסטרון (RAAS) בהתפתחות יתר לחץ דם עורקי (AH) ומחלות לב וכלי דם אחרות נחשב כיום לדומיננטי. ברצף הקרדיווסקולרי, יתר לחץ דם הוא בין גורמי הסיכון, והמנגנון הפתופיזיולוגי העיקרי של פגיעה במערכת הלב וכלי הדם הוא אנגיוטנסין II (ATII). ATII הוא מרכיב מרכזי ב-RAAS - אפקטור המיישם כיווץ כלי דם, שימור נתרן, הפעלת מערכת העצבים הסימפתטית, ריבוי תאים והיפרטרופיה, התפתחות של עקה חמצונית ודלקת של דופן כלי הדם.
נכון להיום, כבר פותחו שני סוגים של תרופות החוסמות את ה-RAAS ונמצא בשימוש קליני נרחב - מעכבי ACE וחוסמי קולטן ATII. ההשפעות הפרמקולוגיות והקליניות של מחלקות אלה שונות. ACE הוא אבץ מטלופרוטאינאז פפטידאז אשר מבצע חילוף חומרים של ATI, AT1-7, ברדיקינין, חומר P ופפטידים רבים אחרים. מנגנון הפעולה של מעכבי ACE קשור בעיקר למניעת היווצרות ATII, המעודד הרחבת כלי דם, נטריאוזיס ומבטל את ההשפעות הפרו-דלקתיות, ההתרבותיות ואחרות של ATII. בנוסף, מעכבי ACE מונעים את הפירוק של ברדיקינין ומעלים את רמתו. ברדיקינין הוא מרחיב כלי דם רב עוצמה, הוא מגביר את הנטריאוזיס, והכי חשוב, יש לו קרדיו-פרוטקטיבי (מונע היפרטרופיה, מפחית נזק איסכמי בשריר הלב, משפר את אספקת הדם הכלילי) ופעילות מגוננת על כלי הדם, משפר את תפקוד האנדותל. יחד עם זאת, רמה גבוהה של ברדיקינין היא הגורם להתפתחות אנגיואדמה, שהיא אחד החסרונות החמורים של מעכבי ACE, אשר מעלים משמעותית את רמת הקינינים.
מעכבי ACE לא תמיד מסוגלים לחסום לחלוטין את היווצרות ATII ברקמות. כעת הוכח כי אנזימים אחרים שאינם קשורים ל-ACE, בעיקר אנדופפטיזים, שאינם מושפעים ממעכבי ACE, יכולים גם הם להשתתף בהפיכתו ברקמות. כתוצאה מכך, מעכבי ACE אינם יכולים לבטל לחלוטין את ההשפעות של ATII, אשר עשויה להיות הסיבה לחוסר היעילות שלהם.
הפתרון לבעיה זו הוקל על ידי גילוי קולטני ATII והמעמד הראשון של תרופות החוסמות באופן סלקטיבי את קולטני AT1. באמצעות קולטני AT1 מתממשות ההשפעות השליליות של ATII: כיווץ כלי דם, הפרשת אלדוסטרון, וזופרסין, נוראדרנלין, אגירת נוזלים, שגשוג של תאי שריר חלקים וקרדיומיוציטים, הפעלת SAS, כמו גם מנגנון המשוב השלילי - יצירת רנין . קולטני AT2 מבצעים פונקציות "מועילות", כגון הרחבת כלי דם, תהליכי תיקון והתחדשות, פעולה אנטי-פרוליפרטיבית, התמיינות והתפתחות רקמות עובריות. ההשפעות הקליניות של חוסמי קולטני ATII מתווכות באמצעות סילוק ההשפעות ה"מזיקות" של ATII ברמה של קולטני AT1, מה שמספק חסימה מלאה יותר של ההשפעות השליליות של ATII והגברת ההשפעה של ATII על קולטני AT2. , המשלים את ההשפעות מרחיבות כלי דם ואנטי-התרבות. לחסמי קולטן ATII יש השפעה ספציפית על ה-RAAS מבלי להפריע למערכת הקינין. חוסר ההשפעה על פעילות מערכת הקינין, מחד גיסא, מפחית את חומרת התופעות הלא רצויות (שיעול, אנגיואדמה), אך מאידך מונע מחוסמי קולטן ATII השפעה אנטי-איסכמית והגנה מפני כלי דם. מה שמבדיל אותם ממעכבי ACE. מסיבה זו, האינדיקציות לשימוש בחוסמי קולטן ATII חוזרות ברובן על ההתוויות למינוי מעכבי ACE, מה שהופך אותן לתרופות חלופיות.
למרות הכנסתם של חוסמי RAAS לתרגול הנרחב של טיפול ביתר לחץ דם, נותרו בעיות של שיפור התוצאות והפרוגנוזה. אלה כוללים: אפשרות לשפר את בקרת לחץ הדם באוכלוסייה, יעילות הטיפול ביתר לחץ דם עמיד, אפשרות להפחית עוד יותר את הסיכון למחלות לב וכלי דם.
החיפוש אחר דרכים חדשות להשפיע על ה-RAAS נמשך באופן פעיל; מערכות אחרות בעלות אינטראקציה הדוקה נחקרות ומפותחות תרופות בעלות מנגנוני פעולה מרובים, כגון מעכבי ACE ומעכבי אנדופפטיז (NEP), אנזים הממיר אנדותלין (EPF) ומעכבי NEP, מעכבי ACE/NEP/EPF.
מעכבי Vasopeptidase
בנוסף ל-ACE הידוע, vasopeptidases כוללים 2 אבץ metalloproteinases אחרים - neprilysin (אנדופפטידאז נייטרלי, NEP) ואנזים ממיר אנדותלין, שיכולים להיות גם מטרות להשפעות תרופתיות.
Neprilysin הוא אנזים המיוצר על ידי האנדותל של כלי הדם ומעורב בפירוק של פפטיד נטריאורטי, כמו גם ברדיקינין.
מערכת הפפטידים הנטרי-אורטית מיוצגת על ידי שלושה איזופורמים שונים: פפטיד נטרי-אורטי פרוזדורי (סוג A), פפטיד נטרי-אורטי במוח (סוג B), אשר מסונתזים באטריום ובשריר הלב, ופפטיד C אנדותל, שהם מעכבי RAAS אנדוגניים ב הפונקציות הביולוגיות שלהם ואנדותלין-1 (טבלה 1). ההשפעות הקרדיווסקולריות והכליותיות של פפטיד נטריאורטי הן להפחית את לחץ הדם באמצעות ההשפעה על טונוס כלי הדם ומאזן המים והאלקטרוליטים, וכן בהשפעות אנטי-פרוליפרטיביות ואנטי-פיברוטיות על איברי המטרה. לאחרונה, מערכת הפפטידים הנטריאורטית מעורבת בוויסות מטבולי של חמצון שומנים, היווצרות והתמיינות של אדיפוציטים, הפעלת אדיפונקטין, הפרשת אינסולין וסבילות לפחמימות, העשויות להעניק הגנה מפני התפתחות התסמונת המטבולית.
עד כה נודע כי התפתחות מחלות לב וכלי דם קשורה לחוסר ויסות של מערכת הפפטידים הנטריאורטית. אז, ביתר לחץ דם, קיים מחסור בפפטיד נטרי-אורטי, המוביל לרגישות למלח ולפגיעה ב-natriuresis; באי ספיקת לב כרונית (CHF), על רקע מחסור, נצפה תפקוד לא תקין של ההורמונים של מערכת הפפטידים הנטריאורטית.
לכן, ניתן להשתמש במעכבי NEP כדי להעצים את מערכת הפפטידים הנטרי-אורטית על מנת להשיג השפעות נוספות של ירידת לחץ דם ומגנה על הלב. עיכוב של neprilysin מוביל להגברת ההשפעות הנטריאורטיות, המשתנות והרחבת כלי הדם של פפטיד אנדוגני נטריאורטי, וכתוצאה מכך לירידה בלחץ הדם. עם זאת, NEP מעורב גם בפירוק של פפטידים כלי דם אחרים, בפרט ATI, ATII ואנדותלין-1. לכן, מאזן ההשפעות על טונוס כלי הדם של מעכבי NEP משתנה ותלוי בדומיננטיות של השפעות מכווצות והרחבות. בשימוש ממושך, ההשפעה נגד יתר לחץ דם של מעכבי נפריליזין מתבטאת בצורה חלשה עקב הפעלה מפצה של היווצרות ATII ואנדותלין-1.
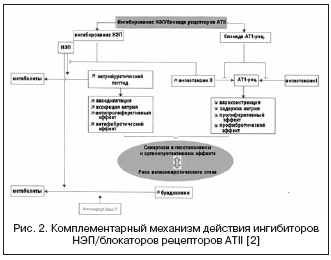
בהקשר זה, השילוב בין ההשפעות של מעכבי ACE ומעכבי NEP יכול להעצים משמעותית השפעות המודינמיות ואנטי-פרוליפרטיביות כתוצאה ממנגנון פעולה משלים, שהוביל ליצירת תרופות בעלות מנגנון פעולה כפול, המאוחדות תחת השם. - מעכבי vasopeptidase (טבלה 2, איור 1).
מעכבים ידועים של vasopeptidases מאופיינים בדרגות שונות של סלקטיביות עבור NEP/ACE: omapatrilat - 8.9:0.5; פזידופרילט - 5.1:9.8; sampatrilat - 8.0:1.2. כתוצאה מכך, מעכבי vasopeptidase קיבלו הזדמנויות גדולות בהרבה להשגת אפקט לחץ דם נמוך, ללא קשר לפעילות ה-RAAS ורמת שימור הנתרן, ובהגנה על איברים (רגרסיה של היפרטרופיה, אלבומינוריה, נוקשות כלי דם). הנחקר ביותר במחקרים הקליניים היה omapatrilat, שהראה יעילות גבוהה יותר להורדת לחץ דם בהשוואה למעכבי ACE, ובמטופלים עם CHF הובילה לעלייה בשבר הפליטה ולשיפור התוצאות הקליניות (מחקרי IMPRESS, OVERTURE), אך ללא יתרונות על פני מעכבי ACE.
עם זאת, בניסויים קליניים גדולים עם שימוש באומפטרלט, נמצאה שכיחות גבוהה יותר של אנגיואדמה בהשוואה למעכבי ACE. ידוע ששכיחות אנגיואדמה בשימוש במעכבי ACE היא בין 0.1 ל-0.5% באוכלוסייה, מתוכם 20% מהמקרים מסכני חיים, מה שקשור לעלייה מרובה בריכוזי ברדיקינין ומטבוליטים שלו. תוצאות מחקר רב-מרכזי גדול OCTAVE (n=25,302), אשר תוכנן במיוחד לחקור את שכיחות אנגיואדמה, הראו כי השכיחות של תופעת לוואי זו במהלך הטיפול באומפטריל עולה על זו שבקבוצת האנלפריל - 2.17% לעומת 0.68% (סיכון יחסי 3.4). זה הוסבר על ידי ההשפעה המוגברת על רמת הקינינים במהלך עיכוב סינרגטי של ACE ו-NEP, הקשורה לעיכוב של aminopeptidase P, המעורב בפירוק ברדיקינין.
מעכב vasopeptidase כפול ACE/NEP חדשני, ilepatril, בעל זיקה גבוהה יותר ל-ACE מאשר ל-NEP. כאשר חקרו את ההשפעות הפרמקודינמיות של אילפטריל על ההשפעה על פעילות RAAS ופפטיד נטריאורטי אצל מתנדבים בריאים, נמצא כי התרופה תלויה במינון (במינונים של 5 ו-25 מ"ג) ובאופן משמעותי (יותר מ-88%) מדכאת ACE. בפלזמה בדם במשך יותר מ-48 שעות, ללא קשר לרגישות למלח. במקביל, התרופה העלתה משמעותית את פעילות הרנין בפלזמה למשך 48 שעות והפחיתה את רמת האלדוסטרון. תוצאות אלו הראו דיכוי בולט וארוך יותר של ה-RAAS, בניגוד למעכב ACE ramipril במינון של 10 מ"ג, אשר הוסבר על ידי השפעת רקמות משמעותית יותר של ilepatril על ACE וזיקה גדולה יותר ל-ACE, וברמה דומה. של חסימה של RAAS בהשוואה לשילוב של irbesartan 150 מ"ג + 10 מ"ג ramipril. בניגוד להשפעה על ה-RAAS, השפעת אילפטריל על הפפטיד הנטריאורטי התבטאה בעלייה חולפת ברמת הפרשתו בתקופה של 4-8 שעות לאחר נטילת מינון של 25 מ"ג, מה שמעיד על רמה נמוכה וחלשה יותר. זיקה ל-NEP ומבדילה אותו מ-omapatrilat. יתרה מכך, מבחינת רמת הפרשת האלקטרוליטים, לתרופה אין השפעה נטריאורטית נוספת בהשוואה לרמיפריל או לאירבסארטן, כמו גם מעכבי vasopeptidase אחרים. ההשפעה המקסימלית של לחץ דם נמוך מתפתחת 6-12 שעות לאחר נטילת התרופה, והירידה בלחץ הדם הממוצע היא 5±5 ו-10±4 מ"מ כספית. ברגישות נמוכה וגבוהה למלח, בהתאמה. על פי המאפיינים הפרמקוקינטיים, ilepatril הוא פרו-תרופה עם מטבוליט פעיל, שנוצר במהירות בריכוז מקסימלי תוך 1-1.5 שעות ומסלק באיטיות. ניסויים קליניים שלב III נערכים כעת.
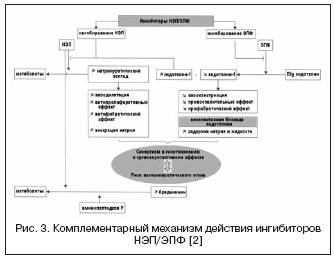
מסלול חלופי לדיכוי כפול של RAAS ו-NEP מיוצג על ידי שילוב של חסימה של קולטני ATII ו-NEP (איור 2). חוסמי קולטן ATII אינם משפיעים על חילוף החומרים של קינינים, בניגוד למעכבי ACE, ולכן יש להם סיכון נמוך יותר לפתח אנגיואדמה. נכון לעכשיו, התרופה הראשונה, חוסם קולטן ATII בעל השפעה של עיכוב NEP ביחס של 1:1, LCZ696, עוברת ניסויים קליניים שלב III. מולקולת התרופה המשולבת מכילה valsartan ומעכב NEP (AHU377) בצורה של פרו-תרופה. במחקר גדול בחולים עם יתר לחץ דם (n=1328), LCZ696 במינונים של 200-400 מ"ג הראה יתרון בהשפעה של לחץ דם נמוך על פני valsartan במינונים של 160-320 מ"ג בצורה של ירידה נוספת בלחץ הדם ב-5 /3 ו-6/3 מ"מ כספית. . . ההשפעה על לחץ הדם של LCZ696 לוותה בירידה בולטת יותר בלחץ הדופק: ב-2.25 ו-3.32 מ"מ כספית. במינונים של 200 ו-400 מ"ג, בהתאמה, הנחשב כיום כגורם פרוגנוסטי חיובי להשפעה על קשיחות דופן כלי הדם ותוצאות קרדיווסקולריות. במקביל, המחקר של סמנים ביולוגיים נוירו-הומורליים במהלך הטיפול ב-LCZ696 הראה עלייה ברמת הפפטיד הנטריאורטי עם דרגת עלייה דומה ברמת הרנין והאלדוסטרון בהשוואה לוולסרטן. הסבילות בחולים עם יתר לחץ דם הייתה טובה, ולא צוינו מקרים של אנגיואדמה. ניסוי PARAMOUMT הושלם כעת ב-685 חולים עם CHF ו-EF ללא הפרעות. תוצאות המחקר הראו ש-LCZ696 מפחית את רמת ה-NT-proBNP מהר יותר ובולט יותר (נקודת הסיום העיקרית היא סמן של פעילות פפטיד נטוורטית מוגברת ופרוגנוזה גרועה ב-CHF) בהשוואה לוולסרטן, וגם מפחית את גודל הפרוזדור השמאלי. , מה שמעיד על נסיגה של העיצוב מחדש שלו. מחקר בחולים עם CHF ו-EF מופחת מתקיים (מחקר PARADIGM-HF).
מעכבי מערכת האנדותלין
למערכת האנדותלין תפקיד חשוב בוויסות טונוס כלי הדם וזרימת הדם האזורית. מבין שלושת האיזופורמים הידועים, אנדותלין-1 הוא הפעיל ביותר. בנוסף להשפעות מכווצות כלי הדם הידועות, אנדותלין ממריץ את השגשוג והסינתזה של המטריצה הבין-תאית, וגם, עקב השפעה ישירה על הטון של כלי הכליה, מעורב בוויסות הומאוסטזיס של מים ואלקטרוליטים. ההשפעות של אנדותלין מתממשות באמצעות אינטראקציה עם קולטנים מסוג A וסוג B ספציפיים, שתפקודיהם מנוגדים זה לזה: כיווץ כלי הדם מתרחש דרך הקולטנים מסוג A, והרחבת כלי הדם מתרחשת דרך סוג B. בשנים האחרונות הוכח כי לקולטנים מסוג B יש תפקיד חשוב בפינוי אנדותלין-1, כלומר. חסימה של קולטנים אלו משבשת את הפינוי התלוי בקולטן של אנדותלין-1 ומגבירה את ריכוזו. בנוסף, קולטנים מסוג B מעורבים בוויסות ההשפעות הכליות של אנדותלין-1 ובשמירה על הומאוסטזיס מים ואלקטרוליטים, שהיא חשובה.
נכון לעכשיו, תפקידו של האנדותלין הוכח בהתפתחות של מספר מחלות, כולל. AH, CHF, יתר לחץ דם ריאתי, מחלת כליות כרונית; מראה קשר הדוק בין רמת האנדותלין ותסמונת מטבולית, הפרעה בתפקוד האנדותל והאטרוגנזה. מאז שנות ה-90 מתבצע חיפוש אחר אנטגוניסטים לקולטן אנדותלין המתאימים לשימוש קליני; כבר ידועות 10 תרופות ("סנטנים") עם דרגות שונות של סלקטיביות לקולטנים מסוג A/B. האנטגוניסט הראשון לקולטן אנדותלין הלא סלקטיבי - בוסנטן - במחקר קליני בחולים עם יתר לחץ דם הראה יעילות נמוכה של לחץ דם דומה לזו של מעכב ACE אנלפריל. מחקרים נוספים על יעילותם של אנטגוניסטים לאנדותלין ליתר לחץ דם הראו את הרלוונטיות הקלינית שלהם בטיפול ביתר לחץ דם עמיד ובסיכון קרדיווסקולרי גבוה. נתונים אלו הושגו בשני ניסויים קליניים גדולים של DORADO (n=379) ו-DORADO-AC (n=849), שבהם נוספה Darusentan לטיפול משולב משולש בחולים עם יתר לחץ דם עמיד. במחקר DORADO חולים עם יתר לחץ דם עמיד היו קשורים למחלת כליות כרונית ולפרוטאינוריה, וכתוצאה מתוספת של דארוסנטן נצפתה לא רק ירידה משמעותית בלחץ הדם, אלא גם ירידה בהפרשת החלבון. ההשפעה האנטי-פרוטאינורית של אנטגוניסטים לקולטן אנדותלין אושרה לאחר מכן במחקר בחולים עם נפרופתיה סוכרתית באמצעות אבוקנטן. עם זאת, במחקר DORADO-AC, לא היה יתרון בהפחתת לחץ דם נוספת על פני משווים ופלסבו, וזו הייתה הסיבה להפסקת מחקרים נוספים. בנוסף, ב-4 מחקרים גדולים של אנטגוניסטים לאנדותלין (בוסנטן, דארוסנטן, אנרסנטן) בחולים עם CHF, התקבלו תוצאות סותרות, אשר הוסברו בעלייה בריכוז האנדותלין-1. מחקר נוסף של אנטגוניסטים לקולטן אנדותלין הושעה עקב השפעות שליליות הקשורות לאגירת נוזלים (בצקת היקפית, עומס יתר בנפח). התפתחות ההשפעות הללו קשורה להשפעה של אנטגוניסטים לאנדותלין על קולטנים מסוג B, ששינתה את החיפוש אחר תרופות המשפיעות על מערכת האנדותלין דרך מסלולים אחרים; ולאנטגוניסטים של קולטן אנדותלין יש כיום רק אינדיקציה אחת, טיפול ביתר לחץ דם ריאתי.
בהתחשב בחשיבות הגבוהה של מערכת האנדותלין בוויסות טונוס כלי הדם, מתבצע חיפוש אחר מנגנון פעולה נוסף באמצעות vasopeptidase - EPF, המעורב ביצירת אנדותלין-1 פעיל (איור 3). חסימת ACE והשילוב עם עיכוב NEP יכולים לדכא ביעילות את היווצרות אנדותלין-1 ולהעצים את ההשפעות של הפפטיד הנטריאורטי. היתרונות של מנגנון פעולה כפול הם, מצד אחד, במניעת החסרונות של מעכבי NEP הקשורים לכיווץ כלי דם אפשרי בתיווך הפעלת אנדותלין, מצד שני, הפעילות הנטריאורטית של מעכבי NEP מאפשרת לפצות על אצירת נוזלים. קשור לחסימה לא סלקטיבית של קולטני אנדותלין. Daglutril הוא מעכב כפול של NEP ו-EPF, שנמצא בשלב II של ניסויים קליניים. מחקרים הראו השפעות מגנות לב לב בולטות של התרופה עקב ירידה בשיפוץ הלב וכלי הדם, נסיגה של היפרטרופיה ופיברוזיס.
מעכבי רנין ישירים
ידוע כי מעכבי ACE וחוסמי קולטן ATII מגבירים את פעילות הרנין על ידי מנגנון משוב, וזו הסיבה לבריחת היעילות של חוסמי RAAS. רנין מייצג את הצעד הראשון במפל RAAS; הוא מיוצר על ידי התאים ה-juxtaglomerular של הכליות. רנין דרך אנגיוטנזינוגן מקדם יצירת ATII, כיווץ כלי דם והפרשת אלדוסטרון, וגם מסדיר את מנגנוני המשוב. לכן, עיכוב רנין מאפשר להשיג חסימה מלאה יותר של מערכת ה-RAAS. החיפוש אחר מעכבי רנין נמשך מאז שנות ה-70; במשך זמן רב, לא ניתן היה להשיג צורה פומית של מעכבי רנין בשל הזמינות הביולוגית הנמוכה שלהם במערכת העיכול (פחות מ-2%). מעכב הרנין הישיר הראשון המתאים למתן דרך הפה, אלישקירן, נרשם בשנת 2007. לאליסקרן זמינות ביולוגית נמוכה (2.6%), זמן מחצית חיים ארוך (24-40 שעות), דרך סילוק חוץ-כליתית. הפרמקודינמיקה של אלישקירן קשורה לירידה של 80% ברמת ATII. במחקרים קליניים בחולים עם יתר לחץ דם, אליסקירן במינונים של 150-300 מ"ג ליום הובילו לירידה ב-SBP ב-8.7-13 ו-14.1-15.8 מ"מ כספית. בהתאמה, ו-DBP - ב-7.8-10.3 ו-10.3-12.3 מ"מ כספית. . ההשפעה של hypotensive של aliskiren נצפתה בתת-קבוצות שונות של חולים, כולל חולים עם תסמונת מטבולית, השמנת יתר; במונחים של חומרה, זה היה דומה להשפעה של מעכבי ACE, חוסמי קולטן ATII, וצוינה השפעה נוספת בשילוב עם valsartan, hydrochlorothiazide ואמלודיפין. מספר מחקרים קליניים הראו השפעות אורגניות של התרופה: השפעה אנטי-פרוטאינורית בחולים עם נפרופתיה סוכרתית (מחקר AVOID, n=599), נסיגה של היפרטרופיה של חדר שמאל בחולים עם יתר לחץ דם (מחקר ALLAY, n=465). לפיכך, במחקר AVOID, לאחר 3 חודשים של טיפול בלוסארטן במינון של 100 מ"ג ליום והגעה לרמת היעד של לחץ הדם (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
בנוסף, נערכת סדרת מחקרים קליניים של אלישקירן בטיפול במחלות לב וכלי דם אחרות עם הערכה של ההשפעה על הפרוגנוזה של החולים: ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n) =7000) מחקרים בחולים עם CHF, מחקר ALTITUDE בחולים עם סוכרת וסיכון קרדיווסקולרי גבוה, מחקר ASPIRE בחולים עם שיפוץ לאחר אוטם.
סיכום
כדי לפתור את הבעיות של מניעת מחלות לב וכלי דם, נמשכת יצירתן של תרופות חדשות בעלות מנגנון פעולה מרובה מורכב, המאפשרת חסימה מלאה יותר של ה-RAAS באמצעות מפל מנגנונים של ויסות המודינמי ונוירו-הומורלי. ההשפעות הפוטנציאליות של תרופות כאלה מאפשרות לא רק לספק אפקט נוסף להורדת לחץ דם, אלא גם להשיג שליטה ברמות לחץ הדם בחולים בסיכון גבוה, כולל יתר לחץ דם עמיד. תרופות בעלות מנגנון פעולה מרובה מראות יתרונות בהשפעה אורגנית בולטת יותר, שתמנע נזק נוסף למערכת הלב וכלי הדם. לימוד היתרונות של תרופות חדשות החוסמות את ה-RAAS דורש מחקר והערכה נוספים של השפעתן על הפרוגנוזה של חולים עם יתר לחץ דם ומחלות לב וכלי דם אחרות.


סִפְרוּת
1 קמפבל D.J. עיכוב Vasopeptidase: חרב פיפיות? // יתר לחץ דם. 2003 כרך. 41. עמ' 383-389.
2. Laurent S., Schlaich M., Esler M. תרופות חדשות, נהלים והתקנים ליתר לחץ דם // Lancet. 2012. כרך. 380. עמ' 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. מעכבי Vasopeptidase: מושג טיפולי חדש במחלות לב וכלי דם? // מחזור. 2001 כרך 104. עמ' 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. עיכוב אנדופפטידאז ניטרלי ומערכת הפפטידים הנטריאורטית: אסטרטגיה מתפתחת בטיפולים קרדיווסקולריים // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. השוואה של מעכבי vasopeptidase, omapatrilat וליזינופריל על סובלנות ותחלואה בפעילות גופנית בחולים עם אי ספיקת לב: ניסוי אקראי של IMPRESS // Lancet. 2000 כרך 356. עמ' 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. השוואה של omapatrilat ו-enalapril בחולים עם אי ספיקת לב כרונית: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002 כרך. 106. עמ' 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. חוסמי קולטן לאנגיוטנסין II בחולים עם אנגיואדמה הנגרמת על ידי מעכבי ACE // אן. פרמקוטר. 2000 כרך 34. עמ' 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat ו-enalapril בחולים עם יתר לחץ דם: הניסוי Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) // Am. J. Hypertens. 2004 כרך 17. עמ' 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. פרמקוקינטיקה ופרמקודינמיקה של מעכב vasopeptidase AVE7688 בבני אדם // Clin. פרמקול. ת'ר. 2006 כרך. 79. עמ' 49-61.
10. Gu J., Noe A., Chandra P. et al. פרמקוקינטיקה ופרמקודינמיקה של LCZ696, מעכב רצפטורנפריליזין אנגיוטנסין דו-אקטיטיבי (ARNi) // J. Clin. פרמקול. 2010 כרך. 50. עמ' 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. הפחתת לחץ דם עם LCZ696, מעכב דו-אקטיב חדש של הקולטן לאנגיוטנסין II ונפריליזין: מחקר אקראי, כפול סמיות, מבוקר פלצבו, מחקר משווה פעיל // Lancet. 2010 כרך. 375. עמ' 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. מעכב הקולטן לאנגיוטנסין neprilysin LCZ696 באי ספיקת לב עם מקטע פליטה משומר: ניסוי אקראי מבוקר כפול סמיות שלב 2 // Lancet. 2012. כרך. 380(9851). עמ' 1387-1395.
13. לוין א.ר. אנדותלינים // N. Engl. J. Med. 1995 כרך. 333. עמ' 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. תפקידו של אנדותלין-1 ביתר לחץ דם קליני: 20 שנה לאחר // יתר לחץ דם. 2008 כרך. 52. עמ' 452-459.
15. Burnier M., Forni V. אנטגוניסטים לקולטן אנדותלין: מקום בניהול יתר לחץ דם חיוני? // נפרול. חוּגָה. לְהַשְׁתִיל. 2011.0:1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. ההשפעה של אנטגוניסט לקולטן אנדותלין, בוסנטן, על לחץ הדם בחולים עם יתר לחץ דם חיוני. חוקרי יתר לחץ דם Bosentan // N. Engl. J. Med. 1998 כרך 338. עמ' 784-790.
17. Weber M.A., Black H., Bakris G. et al. אנטגוניסט סלקטיבי לקולטן אנדותלין להפחתת לחץ דם בחולים עם יתר לחץ דם עמיד לטיפול: ניסוי אקראי, כפול סמיות, מבוקר פלצבו // Lancet. 2009 כרך. 374. עמ' 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. תוצאות שונות באמצעות לחץ דם מרפאתי ואמבולטורי: דיווח על ניסוי יתר לחץ דם עמיד לדרוסנטן // יתר לחץ דם. 2010 כרך. 56. עמ' 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan עבור נפרופתיה סוכרתית גלויה // J. Am. soc. נפרול. 2010 כרך. 21. עמ' 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. אנזים הממיר אנדותלין/מעכב אנדופפטידאז נייטרלי SLV338 מונע שיפוץ לב יתר לחץ דם באופן בלתי תלוי בלחץ דם // יתר לחץ דם. 2011 כרך 57. עמ' 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. דיכוי אנגיוטנסין II בבני אדם על ידי מעכב רנין פעיל תיאורטית Aliskiren (SPP100): השוואה לאנלפריל // יתר לחץ דם. 2002 כרך. 39(1). P.E1-8.
22. Alreja G., Joseph J. Renin ומחלות לב וכלי דם: דרך שחוקה, או כיוון חדש? // World J. Cardiol. 2011 כרך. 3(3). עמ' 72-83.
23. אינגלפינגר J.R. Aliskiren וטיפול כפול בסוכרת מסוג 2 // N. Engl. J. Med. 2008 כרך. 358(23). עמ' 2503-2505.
24. Pouleur A.C., Uno H., Prescott M.F., Desai A. (עבור חוקרי ALLAY). דיכוי אלדוסטרון מתווך נסיגה של היפרטרופיה של חדר שמאל בחולים עם יתר לחץ דם // J. Renin-Angiotensin-Aldosterone System. 2011 כרך 12. עמ' 483-490.
25. Kelly D. J., Zhang Y., Moe G. et al. Aliskiren, מעכב רנין חדשני, מגן מחדש במודל של נפרופתיה סוכרתית מתקדמת בחולדות // Diabetol. 2007 כרך. 50. עמ' 2398-2404.


